 | Информационная система |  |
Утверждаю
Начальник Управления
Ветеринарии
Федерального агентства
по сельскому хозяйству
В.А. АПАЛЬКИН
3 октября 2005 г. № 5-1-14/971
МЕТОДИЧЕСКИЕ УКАЗАНИЯ
ПО ЛАБОРАТОРНОЙ ДИАГНОСТИКЕ ИЕРСИНИОЗА
ЖИВОТНЫХ И ОБНАРУЖЕНИЮ ВОЗБУДИТЕЛЯ БОЛЕЗНИ
В МЯСНОМ СЫРЬЕ, МОЛОКЕ И РАСТИТЕЛЬНЫХ КОРМАХ
Разработчики:
Всероссийский научно-исследовательский институт ветеринарной санитарии, гигиены и экологии; ФГУ "Всероссийский государственный центр качества и стандартизации лекарственных средств для животных и кормов"; ЗАО "Инфамед"; Саратовский государственный аграрный университет им. Н.И. Вавилова.
1. ОБЩИЕ ПОЛОЖЕНИЯ
1.1. Иерсиниоз - острое инфекционное заболевание людей и животных разных видов, включая птиц. Возбудителями болезни являются патогенные штаммы Yersinia enterocolitica, относящиеся к роду Yersinia, семейству Enterobacteriaceae.
1.2. Бактерии вида Y. enterocolitica широко распространены в природе ввиду высокой адаптации к сапрофитному образу жизни, что является одной из характерных биологических особенностей данного вида бактерий. Наряду с сапрофитными свойствами многие штаммы иерсиний проявляют патогенные свойства за счет токсигенности, адгезивности, инвазивности и способности противостоять фагоцитозу в организме теплокровных животных. Резервуаром возбудителя иерсиниоза, помимо больных животных, являются объекты окружающей среды - вода, почва, растительные корма, пищевые продукты, особенно молоко.
Большую роль в распространении возбудителя иерсиниоза играют синантропные грызуны (серые крысы, мыши) в связи с тем, что с их экскрементами иерсинии часто попадают на овощи в период хранения.
Температура от +4 до +40 °С является благоприятной для размножения Y. enterocolitica, что способствует накоплению иерсиний на объектах животноводческих помещений - стойл, полов, подстилке, навозной жиже, овощехранилищах и пр.
1.3. Иерсиниоз чаще протекает в кишечной форме, но иногда развивается бактериемия с поражением различных внутренних органов. В зависимости от продолжительности болезни она может иметь острое и подострое течение.
Заболеванию особенно подвержен молодняк, у которого иерсиниоз проявляется в виде спорадических случаев или энзоотической вспышки, чему способствуют многие факторы, связанные с несоблюдением технологических, ветеринарно-санитарных, зоогигиенических и общих противоэпизоотических требований при его выращивании.
Клиническая картина болезни не имеет специфических особенностей и характеризуется признаками, свойственными кишечным инфекциям, вызванным другими микроорганизмами. У больных животных наблюдается потеря аппетита, понос, нарастающая слабость, адинамия, учащенное и поверхностное дыхание, учащенный пульс, интоксикация, поражение центральной нервной системы - судороги, депрессия, чередующаяся с возбуждением. При затяжном течении болезни возникает обезвоживание организма, западание глазных яблок, истощение. У некоторых животных могут быть серозно-катаральные или серозно-гнойные истечения из носовой полости, хрипы в области бронхов и легких, конъюнктивит, артриты. Температура тела обычно в пределах нормы или повышена на 0,5 - 1,0 °С, в предагональном состоянии - ниже нормы.
При кишечной форме возбудитель болезни локализуется в желудочно-кишечном тракте и мезентериальных лимфатических узлах; при септической - еще и в паренхиматозных органах, крови, костном и головном мозге и регионарных лимфатических узлах.
У взрослых животных клинические признаки болезни обычно отсутствуют. В отдельных случаях могут быть артриты, аборты, эндометриты, маститы и еще реже - диарея.
Основной путь заражения - алиментарный. Не исключается возможность инфицирования при контакте с больными животными, а также с ранее переболевшими животными и работниками животноводческих ферм - бактерионосителями. Выздоровевшие животные могут длительное время оставаться бактерионосителями и выделять возбудителя болезни в окружающую среду.
У животных-бактерионосителей клинические признаки отсутствуют. У крупного рогатого скота иерсинии встречаются в кишечнике, у свиней - на слизистой корня языка, миндалинах глотки, в подчелюстных лимфатических узлах, у лактирующих животных - в молоке.
1.4. Патологоанатомические изменения у погибших от иерсиниоза животных имеют картину катарального или катарально-геморрагического гастроэнтерита с наличием точечных, пятнистых и полосчатых кровоизлияний на слизистой оболочке тонкого и толстого отделов кишечника; мезентериальные лимфатические узлы увеличены, на разрезе розово-красного или вишневого цвета. В брюшной полости может содержаться серозный экссудат светло-желтого цвета. Селезенка иногда имеет утолщенные края или слегка увеличена с точечными кровоизлияниями под капсулой; печень нередко перерождена, глинистого цвета, пульпа на разрезе имеет дряблую консистенцию и легко снимается при соскобе.
В почках под капсулой могут быть точечные кровоизлияния. На разрезе граница коркового и мозгового слоев в ряде случаев сглажена. На эпи- и эндокарде в области клапанов сердца часто отмечаются точечные и пятнистые кровоизлияния. Легкие могут иметь мраморный рисунок с наличием лобарной пневмонии. В бронхах и трахее - пенистый экссудат. Сосуды головного мозга сильно гиперемированы, мозговая ткань отечна.
Указанные изменения наблюдаются в отдельных или одновременно в нескольких органах.
1.5. Диагноз иерсиниоза у животных ставят на основании результатов бактериологического и молекулярно-генетического исследования (ПЦР) с учетом эпизоотологических данных, клинических признаков болезни и патологоанатомической картины.
1.6. При убое и разделке туш животных-бактерионосителей может происходить контаминация иерсиниями мяса этих животных и получаемых от них субпродуктов в результате загрязнения частицами фекалий, помета птиц, содержимого кишечника, через режущие необеззараженные инструменты, тару и пр.
У лактирующих животных-бактерионосителей иерсинии могут содержаться в молоке и приготовленных из него сливках или попадать в молоко с контаминированной поверхности молочной железы во время доения коров, необеззараженных доильного оборудования и молочной посуды.
1.7. Возможность контаминации различных растений, корнеплодов, злаковых и бахчевых культур иерсиниями обусловлена способностью этих бактерий продолжительное время выживать и размножаться при температуре от +4 до +40 °С в воде и влажной почве, богатой органическими веществами. В связи с этим растительные культуры и приготовленные из них салаты и корма могут быть источником заражения людей и животных патогенными штаммами иерсиний. Установлено, что в период вегетации растений, выросших на почвах, в которые попадают сточные воды с животноводческих ферм, иерсинии проникают внутрь растений. И хотя в таких случаях в смывах с овощей указанные бактерии не удается обнаружить, но при измельчении зеленой массы из выделяемого сока может быть выделена культура иерсиний.
2. БАКТЕРИОЛОГИЧЕСКОЕ ИССЛЕДОВАНИЕ
2.1. Целью бактериологического исследования материала на иерсиниоз является выделение чистой культуры возбудителя болезни с изучением ее морфологических, тинкториальных, культуральных, ферментативных свойств и определением ее патогенности в пластинчатой РА с помощью диагностической агглютинирующей сыворотки к патогенным штаммам иерсиний (СПИ), входящей в состав "Тест-системы для идентификации патогенных штаммов Yersinia enterocolitica".
2.2. Взятие материала и пересылка его для лабораторного исследования
2.2.1. Для прижизненной диагностики иерсиниоза в лабораторию направляют материал от больных животных, не подвергавшихся лечению антибактериальными препаратами, отобранный в стерильные пробирки (флаконы) с резиновыми пробками:
а) фекалии в количестве 2 - 3 г, отобранные непосредственно из прямой кишки с помощью предварительно прокипяченного резинового катетера или в момент дефекации;
б) молоко в количестве 10 - 15 мл, взятое выборочно от 15 - 20 коров стада после санитарной обработки молочной железы и сдаивания первых порций молока, - одна сборная проба. В зависимости от поголовья коров на ферме количество сборных проб молока может варьировать в пределах от 3 до 5. Молоко должно быть доставлено в лабораторию для исследования в день взятия пробы. При отсутствии такой возможности молоко консервируют кристаллической борной кислотой (0,1 г на 10 мл). Консервированное молоко пригодно для исследования в течение 10 дней.
2.2.2. Для посмертной диагностики в лабораторию направляют материал от погибших или вынужденно убитых животных, желательно не подвергавшихся лечению антибактериальными препаратами.
Трупы мелких животных (поросят, пушных зверей, птиц и др.) направляют целиком (2 - 4 тушки).
От крупных животных посылают следующий материал: сердце, перевязанное лигатурой вблизи разреза сосудов и аорты; селезенку; долю печени с желчным пузырем; почку; пораженные участки тонкого или толстого отдела кишечника с содержимым, перевязанные с двух концов лигатурой, вместе с регионарными мезентериальными лимфатическими узлами (в отдельной посуде или полиэтиленовом пакете); голову; трубчатую кость; подчелюстные лимфатические узлы; у свиней и поросят еще и соскобы с задней стенки глотки, с поверхности корня языка и глоточных миндалин, взятые стерильным скальпелем.
2.2.3. Для диагностики иерсиниоза птиц из неблагополучных секций птичника направляют по 3 - 5 свежих трупов или 3 - 5 птиц с клиническими признаками диареи. Больную птицу убивают в лаборатории и подвергают патологоанатомическому и бактериологическому исследованию.
2.2.4. Пробы мясного сырья, молока и сливок для бактериологического исследования отбирают согласно правилам и в количествах, предусмотренных следующими ГОСТами:
- мясо - ГОСТ 7269-79. Методы отбора образцов и органолептические методы определения свежести;
- мясо птицы, субпродукты и полуфабрикаты птичьи - ГОСТ Р 50396.0-92. Методы отбора проб и подготовка их к микробиологическим исследованиям;
- молоко и сливки - ГОСТ 13928-84. Правила приемки, методы отбора проб и подготовка их к анализу.
2.2.5. Корнеплоды, хранящиеся в овощехранилищах или буртах, подвергают исследованию не ранее чем через 30 дней после их закладки. Пробы растительных кормов для исследования на наличие в них бактерий вида Yersinia enterocolitica отбирают согласно следующим ГОСТам:
- корма растительного происхождения - ГОСТ 27662-87. Методы отбора проб (зеленый корм, сено, силос, сенаж);
- комбикорма, сырье - ГОСТ 13496.0-80. Методы отбора проб (кормовая мука, травяная мука, сушеный свекловичный жом, сухие кукурузные корма и т.д.);
- картофель свежий продовольственный - ГОСТ Р 51808-2001. Методы отбора проб;
- свекла столовая, кормовая свежая - ГОСТ Р 51811-2001.
2.2.6. Пробы материала, отобранные для бактериологического исследования, упаковывают в полиэтиленовые пакеты или во влагонепроницаемую тару и в тот же день направляют в лабораторию. Если материал (органы, ткани и фекалии животных) доставить в лабораторию в течение 3 - 4 ч не представляется возможным, особенно в теплое время года, его консервируют стерильным 30 %-ным водным раствором химически чистого глицерина, объем которого должен превышать объем материала в 2 - 3 раза.
СХЕМА
БАКТЕРИОЛОГИЧЕСКОГО ИССЛЕДОВАНИЯ МАТЕРИАЛА
НА ВОЗБУДИТЕЛЬ ИЕРСИНИОЗА
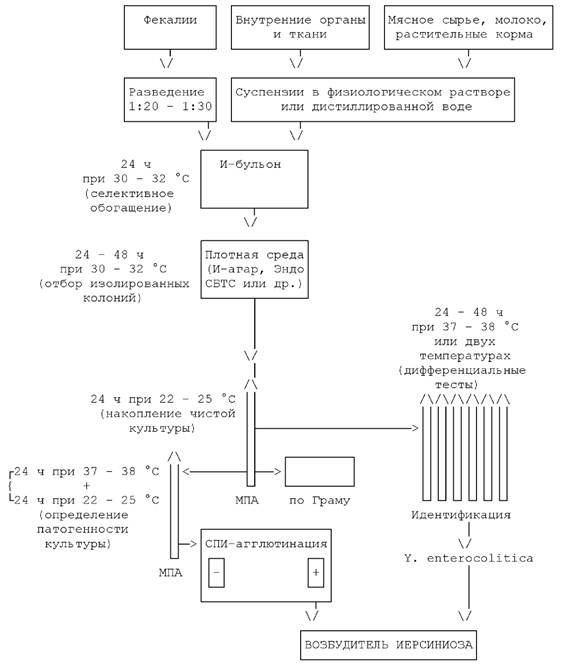
2.3. Исследование материала
2.3.1. Присланный в лабораторию материал исследуют в день его поступления, соблюдая правила асептики.
2.3.2. Для выделения иерсиний из исследуемого материала используют жидкую селективную среду обогащения (И-бульон, разлитый в пробирки в количестве 4 - 5 мл) и одну из плотных дифференциально-диагностических или селективных сред, разлитую в чашки Петри и подсушенную в течение 40 - 60 мин. в термостате: И-агар; селективные среды для выделения иерсиний компании "HiMedia Laboratories Limited" или фирмы "OXOID"; агар Эндо; среду с желчью и индикатором бромтимоловым синим, СБТС; или среду для выделения иерсиний (г. Махачкала).
2.3.3. Пробы фекалий и соскобы со слизистой кишечника, корня языка и заглоточных миндалин (две последние пробы можно объединить) в количестве приблизительно 0,5 г переносят в пробирки с 8 - 10 мл стерильного физиологического раствора и суспендируют. Взвесь отстаивают при комнатной температуре в течение 10 - 15 минут. Надосадочную жидкость после оседания крупных частиц в количестве 0,2 - 0,4 мл высевают в И-бульон в пробирке.
В тех случаях, когда пробы фекалий консервированы глицериновым раствором, последний сливают и 0,5 г фекалий разводят физиологическим раствором, последующее исследование проводят, как указано в 2.3.2.
2.3.4. Из печени, селезенки, почки, лимфатических узлов вырезают ножницами кусочки размером не менее 1 - 1,5 см3, увлажняют спиртом, обжигают поверхность до сгорания спирта, после чего помещают в пробирки с 3 - 5 мл стерильного физиологического раствора, суспендируют и высевают взвесь по 0,2 - 0,3 мл в И-бульон в пробирке.
Внутренние органы можно исследовать и другим образом. Поверхность органа прижигают раскаленным шпателем. Стерильной пастеровской пипеткой в участке фламбированной поверхности отсасывают ткань в объеме 0,2 - 0,3 мл и высевают ее в И-бульон в пробирке.
2.3.5. Кровь сердца, желчь, головной и костный мозг отсасывают по 0,2 - 0,3 мл пастеровскими пипетками и вносят в пробирки с И-бульоном, которые встряхивают для перемешивания материала.
2.3.6. Для исследования мяса и субпродуктов из средней пробы материала отвешивают навеску в 25 г, нарезают ножницами на мелкие кусочки, последние растирают в стерильной фарфоровой ступке с небольшим количеством стерильного физиологического раствора или дистиллированной воды, затем суспензии переливают в колбы, встряхивают и отстаивают в течение 10 - 15 мин. для осаждения крупных частиц, надосадочную жидкость переносят в колбу, содержащую 100 мл И-бульона и тщательно перемешивают.
2.3.7. Пробы мясного фарша, сырого молока и полученных из него сливок в количестве по 25 г вносят в колбы, содержащие 100 мл И-бульона, которые встряхивают в течение 2 - 3 мин. с целью размешивания материала.
2.3.8. Для исследования овощей (корнеплодов) из сборной пробы делают навески по 0,5 кг, обмывают поверхность корнеплодов ватно-марлевыми стерильными тампонами, смоченными стерильным физиологическим раствором или дистиллированной водой, которые затем погружают в колбу со стерильным физиологическим раствором или дистиллированной водой в объеме 80 - 100 мл.
Содержимое колбы тщательно встряхивают в течение 4 - 5 мин., отстаивают 10 - 15 мин. для осаждения крупных частиц грунта и вносят по 25 мл в колбы со 100 мл И-бульона.
2.3.9. Пробы растительных кормов отбирают в количестве 25 г, измельчают предварительно прокипяченными ножницами или ножом на мелкие кусочки и вносят в колбы со 100 мл И-бульона, закрывают стерильными резиновыми пробками и тщательно встряхивают в течение 10 - 15 мин. вручную или на шуттель-аппарате.
2.4. Выделение и идентификация культур иерсиний
2.4.1. Пробирки (колбы) с засеянным исследуемым материалом в И-бульоне инкубируют при температуре 30 - 32 °С в течение 24 ч.
2.4.2. Культуры, полученные в И-бульоне, пересевают бактериологической петлей частыми широкими штрихами в отдельные чашки Петри с И-агаром или одной из плотных питательных сред (см. п. 2.3.2) по всей поверхности агара или на отдельные секторы чашек, которые помещают в термостат на 48 ч.
2.4.3. Через 24 - 48 ч учитывают характер роста колоний, выросших в чашках Петри на поверхности одной из плотных питательных сред, визуально и с помощью лупы (табл. 2.1).
Таблица 2.1
ХАРАКТЕР РОСТА Y. ENTEROCOLITICA НА РАЗЛИЧНЫХ ПЛОТНЫХ СРЕДАХ
|
Питательная среда |
Характеристика колоний через 48 ч роста |
|
Селективный И-агар |
Колонии диаметром 0,8 - 1,5 мм бесцветные, округлые, матовые с темно-красным бугорком в центре. Края колоний с небольшими неровностями. Цвет среды остается розовым |
|
Среда для выделения иерсиний |
Колонии диаметром 0,5 - 1,5 мм бледно-розовые с сиреневым оттенком, крутые, блестящие, выпуклые. Цвет среды остается светло-коричневым |
|
(Г. Махачкала) Среда с желчью и бромтимоловым синим (СБТС) |
Колонии диаметром 2 - 3 мм темно-оливкового цвета, более светлые к периферии, сильно шероховатые с выпуклым более темным центром, края изрезанные, фестончатые. Темно-зеленая с бирюзовым оттенком среда вокруг колоний обесцвечивается и приобретает оливковый цвет - более светлый, чем основной фон. Колонии других энтеробактерий выпуклые, сочные, округлой формы, более крупные, темно-зеленого, коричневого или черного цвета |
|
Агар Эндо |
Колонии диаметром 1,0 - 1,5 мм округлые. Периферическая часть колоний розовая, блестящая, прозрачная. Центр колоний выпуклый, шероховатый, окрашен в темно-розовый цвет. Цвет среды - бледно-розовый |
Селективные и дифференциально-диагностические среды для выделения иерсиний подавляют рост многих видов посторонней микрофлоры, однако это обстоятельство не исключает необходимость идентификации культур бактерий, подозрительных на иерсинии, по биохимическим свойствам.
2.4.4. Типичные для иерсиний колонии отсевают на скошенный МПА (с каждой чашки 1 - 2 колонии), инкубируют при 22 - 25 °С в течение 24 ч и затем проводят изучение морфологических, тинкториальных и биохимических свойств выделенных культур.
2.4.5. Из суточных агаровых культур бактерий, выращенных на скошенном МПА, делают мазки, окрашивают по Граму и микроскопируют.
Y. enterocolitica - биполярные полиморфные овоидные или палочкообразные грамотрицательные бактерии размером от 0,5 до 2,0 мкм, не образующие спор и капсул, расположенные одиночно или короткими цепочками. В молодых развивающихся культурах микробные клетки могут быть более крупными, часто располагаются цепочками или в виде длинных изогнутых нитей, состоящих из неразделившихся клеток, что особенно характерно для R-форм. Старые культуры в отличие от молодых содержат одиночно расположенные более мелкие и коккообразные клетки.
2.4.6. Для определения подвижности бактерий выделенные культуры выращивают при 22 - 25 °С и при 37 - 38 °С в полужидком МПА (0,25 - 0,3 %). Посев проводят уколом в столбик полужидкого агара. Подвижными считают штаммы, выросшие диффузно, вызывающие помутнение среды; неподвижными -растущие только по ходу укола.
Определение подвижности бактерий можно проводить у односуточных агаровых культур в препарате "раздавленная капля". Y. enterocolitica подвижны при 22 - 25 °С и неподвижны при 37 - 38 °С.
2.4.7. Характерными свойствами бактерий семейства Enterobacteriaceae, к которому относится род Yersinia, являются отсутствие фермента оксидазы и наличие фермента каталазы.
2.4.8. Для изучения ферментативных свойств используют односуточные агаровые культуры, выращенные на МПА при 22 - 25 °С, которые пересевают в следующие среды:
- с углеводами (глюкоза, лактоза, сахароза, маннит, мальтоза, сорбит, рамноза) и индикатором Андреде или полужидкие с индикатором ВР;
- с мочевиной по Кристенсену или Преусу;
- цитратную среду Симмонса;
- среду Кларка (для реакций с метиловым красным и Фогеса-Проскауэра);
- среду с фенилаланином;
- среду с сульфатом железа (для определения продукции Н2S);
- МПБ, 1 %-ную пептонную воду или бульон Хоттингера (для определения индола).
Посев в среду Кларка для постановки реакции Фогеса-Проскауэра проводят в две пробирки, одну из которых инкубируют при 22 - 25 °С, а другую при 37 °С; остальные посевы инкубируют также при 37 °С.
Родовую и видовую принадлежность выделенных культур бактерий устанавливают по показателям таблицы 2.2.
Таблица 2.2
ОСНОВНЫЕ ДИФФЕРЕНЦИАЛЬНЫЕ ПРИЗНАКИ ЛАКТОЗООТРИЦАТЕЛЬНЫХ БАКТЕРИЙ СЕМЕЙСТВА ENTEROBACTERIACEAE*
______________
* Если не указана другая температура, представлены результаты тестов, проводимых при 37 - 38 °С.
|
ТЕСТЫ |
Yersinia |
Hafnia alvei |
Salmonella** |
Edwardsiella tarda |
Proteus |
Morganella morganii |
Providencia |
||||||
|
Y. enterocolitica |
Y. pseudotuberculosis |
P. vulgaris |
P. mirabilis |
P. myxofaciens |
P. rettgeri |
P. stuartii |
P. alcalifaciens |
||||||
|
Оксидаза |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
|
|
Каталаза |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
|
|
Глюкоза |
+ |
+ |
+Г |
+ |
+Г |
+Г |
+Г |
+Г |
+Г |
+ |
+ |
+Г |
|
|
Метиловый красный |
+ |
+ |
- |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
|
|
Фогеса- |
22 - 25 °С |
+ |
- |
+ |
- |
- |
- |
Р |
+ |
- |
- |
- |
- |
|
Проскауэра |
37 - 38 °С |
- |
- |
Р |
- |
- |
- |
Р |
+ |
- |
- |
- |
- |
|
Цитрат |
22 - 25 °С |
- |
- |
+ |
Р |
- |
Р |
Р |
Р |
- |
+ |
+ |
+ |
|
Симмонса |
37 - 38 °С |
- |
- |
Р |
+ |
- |
Р |
Р |
Р |
- |
+ |
+ |
+ |
|
Индол |
Р |
- |
- |
- |
+ |
+ |
- |
- |
+ |
+ |
+ |
+ |
|
|
Сероводород |
- |
- |
- |
+ |
+ |
+ |
+ |
- |
- |
- |
- |
- |
|
|
Мочевина |
+ |
+ |
- |
- |
- |
+ |
+ |
+ |
+ |
+ |
Р |
- |
|
|
Фенилаланин |
- |
- |
- |
- |
- |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
|
|
Сахароза |
+ |
- |
- |
- |
- |
+ |
- |
+ |
- |
- |
Р |
- |
|
|
Маннит |
+ |
+ |
+ |
+ |
- |
- |
- |
- |
- |
+ |
- |
- |
|
|
Мальтоза |
Р |
+ |
+ |
+ |
+ |
+ |
- |
+ |
- |
- |
- |
- |
|
|
Рамноза |
- |
Р |
+ |
+ |
- |
- |
- |
- |
- |
Р |
- |
- |
|
|
Сорбит |
+ |
- |
- |
+ |
- |
- |
- |
- |
- |
- |
- |
- |
|
|
Подвижность |
22 - 25 °С |
+ |
+ |
+ |
Р |
Р |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
|
37 - 38 °С |
- |
- |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
|
______________
** Кроме сальмонелл тифо-паратифозной группы; обозначения: "+" - положительная реакция; "-" -отрицательная реакция; "Р" - различные показатели у разных штаммов; "Г" - образование газа.
Бактерии вида Y. enterocolitica расщепляют мочевину, не обладают фенилаланиндезаминазной активностью, не утилизируют цитрат, не образуют сероводород, ферментируют углеводы с образованием кислоты без газообразования (глюкозу, сахарозу, маннит, сорбит, мальтозу), не ферментируют лактозу, рамнозу, неподвижны при 37 - 38 °С и подвижны при 22 - 25 °С. Реакция Фогеса-Проскауэра также положительна при 22 - 25 °С и отрицательная при 37 - 38 °С. Часть штаммов возбудителя иерсиниоза образует индол.
Иерсинии вида Y. pseudotuberculosis в отличие от Y. enterocolitica дают отрицательную реакцию Фогеса-Проскауэра при 22 - 25 °С, не ферментируют сахарозу и сорбит, но часто ферментируют рамнозу (табл. 2.3).
Таблица 2.3
ОСНОВНЫЕ
ДИФФЕРЕНЦИАЛЬНЫЕ ПРИЗНАКИ Y. ENTEROCOLITICA
И Y. PSEUDOTUBERCULOSIS (ПРИ 37 - ...)
|
ТЕСТЫ |
Y.enterocolitica |
Y. Pseudotuberculosis |
|
|
Сахароза |
+ |
- |
|
|
Рамноза |
- |
Р |
|
|
Сорбит |
+ |
- |
|
|
Орнитин-декарбоксилаза |
+ |
- |
|
|
Индол |
Р |
- |
|
|
Фогеса- |
22 - 25 °С |
+ |
- |
|
Проскауэра |
37 - 38 °С |
- |
- |
2.5. Определение патогенности выделенных культур иерсиний
2.5.1. Определение патогенности культур Y. enterocolitica проводят с использованием "Тест-системы для идентификации патогенных штаммов Yersinia enterocolitica", в состав которой входят:
- сыворотка диагностическая к патогенным иерсиниям адсорбированная кроличья (СПИ) в разведении 1:10; 2 флакона по 10 мл;
- сыворотка нормальная кроличья в разведении 1:10; 2 флакона по 10 мл.
СПИ содержит агглютинины к поверхностным антигенам патогенных штаммов Yersinia enterocolitica, имеющих плазмиду вирулентности (pYV), и предназначена для идентификации плазмидосодержащих штаммов (pYV+) Yersinia enterocolitica в реакции агглютинации (РА) на стекле.
Сыворотка нормальная кроличья предназначена для контроля исследуемой культуры на отсутствие способности к спонтанной агглютинации.
2.5.2. Порядок применения тест-системы
2.5.2.1. Подготовка компонентов реакции
Культуру, предназначенную для исследования, выращивают на скошенном МПА в течение 24 ч при 37 - 38 °С, а затем еще 24 ч - при 22 - 25 °С с целью оптимального формирования антигенов вирулентности у (pYV+) Yersinia enterocolitica. Для исследования в РА используют культуры, подвергнутые пересевам не более 5 раз при 22 - 38 °С.
Сыворотки после вскрытия флаконов пригодны к использованию в течение трех месяцев при условии хранения в холодильнике при 2 - 10 °С.
2.5.2.2. Проведение РА на стекле
На предметное стекло или стеклянную пластину наносят одну каплю (0,04 - 0,05 мл) СПИ и рядом одну каплю нормальной сыворотки, в которых бактериологической петлей суспендируют исследуемую культуру иерсиний. После смешивания компонентов рекомендуется легкое покачивание предметного стекла или пластины.
2.5.3. Учет результатов и оценка реакции
2.5.3.1. Реакцию учитывают в косо падающем свете на темном фоне визуально или с помощью лупы 5 - 7-кратного увеличения в течение 3-х минут после смешивания компонентов с оценкой в крестах по следующей схеме:
++++ - четко выраженный агглютинат с полным просветлением жидкости;
+++ - хорошо выраженный агглютинат на фоне слабого помутнения жидкости;
++ - нечеткий агглютинат со слабым просветлением жидкости;
+ - едва заметный агглютинат; просветления жидкости нет;
- - гомогенная мутная жидкость.
2.5.3.2. Оценка результатов реакции
Иерсинии, содержащие плазмиду вирулентности, должны давать положительную реакцию агглютинации в капле СПИ с оценкой не менее чем на 3 креста в течение 3-х минут после смешивания компонентов при отсутствии агглютината в капле нормальной сыворотки (допускается агглютинация с оценкой на один крест).
В случае положительной реакции с СПИ и отрицательной с нормальной кроличьей сывороткой (ИКС) культуру Y. enterocolitica считают патогенной и относят к возбудителю болезни.
Общий срок бактериологического исследования материала - до 8 суток.
2.6. Оформление результатов бактериологического исследования
Результаты бактериологического исследования формулируют следующим образом: при положительном результате - "Из присланного материала (указать какого) выделен возбудитель иерсиниоза (указать вид бактерий)", при отрицательном результате - "В присланном материале (указать каком) возбудитель иерсиниоза не обнаружен".
|
Алгоритм идентификации и дифференциации энтеропатогенных иерсиний |
||||
|
ТЕСТЫ |
РЕЗУЛЬТАТЫ |
|||
|
Оксидаза |
- |
- |
||
|
Глюкоза |
К |
К |
||
|
Цитрат Симмонса |
- |
- |
||
|
Мочевина (уреаза) |
+ |
+ |
||
|
Сахароза |
+ |
- |
||
|
Салицин |
- |
± |
||
|
Сорбит |
+ |
- |
||
|
Рамноза |
- |
+ |
||
|
Глицерин |
+ |
± |
||
|
Мальтоза |
+ |
+ |
||
|
|
||||
|
ВИД |
Y. enterocolitica |
Y. pseudotuberculosis |
||
|
Индол |
+ |
- |
- |
|
|
Ксилоза |
+ |
+ |
- |
|
|
|
||||
|
БИОВАР |
II |
III |
IV |
- |
3. МОЛЕКУЛЯРНО-ГЕНЕТИЧЕСКАЯ ДИАГНОСТИКА ИЕРСИНИОЗА*
____________
* Используется в лабораториях, имеющих условия для проведения амплификации и анализа фрагментов нуклеиновых кислот.
3.1. Выявление возбудителя иерсиниоза проводят методом полимеразной цепной реакции (ПЦР) при помощи тест-системы на ДНК Yersinia enterocolitica ("ЭНТЕРКОЛ").
В основе метода лежит амплификация специфического участка ДНК-возбудителя за счет многократного повторения циклов денатурации ДНК в исследуемой пробе, отжига специфических олигонуклеотидных затравок (праймеров) и синтеза комплементарных цепей ДНК с использованием фермента Taq-полимеразы и дезоксинуклеозид-5'-трифосфатов.
Тест-система предназначена для выявления ДНК-возбудителя иерсиниоза Yersinia enterocolitica в фекалиях животных, моче, содержимом кишечника, лимфатических узлах, внутренних органах, крови, молоке, кормах и воде.
3.2. В состав тест-системы, рассчитанной на 100 анализов, включая контрольные пробы, входят:
- набор для выделения ДНК (набор "ДНК-сорб-В");
- набор для проведения ПЦР-амплификации участка ДНК (набор "АмплиСенс-100");
- набор для электрофоретического анализа продуктов ПЦР (набор "ЭФ-200");
- набор контрольных образцов (вкладывается в набор "АмплиСенс-100").
Транспортируют и хранят тест-систему при температуре 2 - 8 °С. Тест-система пригодна для применения в течение 6 мес. от даты изготовления.
3.2.1. Набор для выделения ДНК состоит из следующих компонентов:
- лизирующий раствор (1 флакон; 30,0 мл);
- отмывочный раствор № 1 (1 флакон; 30,0 мл);
- отмывочный раствор № 2 (1 флакон; 100,0 мл);
- суспензия сорбента (2 пробирки по 1,25 мл);
- буфер для элюции ДНК (2 пробирки по 5,0 мл).
3.2.2. Набор для проведения ПЦР состоит из следующих компонентов:
- ПЦР-смесь № 1 "Y. enterocolitica" (1 проб.; 0,55 мл);
- ПЦР-смесь № 2 "2,2 мМ Mg++" (1 пробирка; 1,2 мл);
- воск для ПЦР (1 пробирка; 1,7 мл);
- масло минеральное (2 флакона по 4,0 мл).
3.2.3. Набор для электрофоретического анализа продуктов ПЦР состоит из следующих компонентов:
- концентрат буфера с бромидом этидия (2 по 25,0 мл);
- агароза для электрофореза (2 флакона по 1,8 г).
3.2.4. Набор контрольных образцов состоит из следующих компонентов:
- положительный контрольный образец (ПКО) ДНК Y. enterocolitica (1 пробирка; 0,1 мл);
- отрицательный контрольный образец (ОКО) (1 пробирка; 1,6 мл);
- ДНК-буфер для разведения и хранения ДНК-контролей (1 пробирка; 1,0 мл).
3.3. Отбор материала для исследования
3.3.1. При отборе образцов материала, а также при подготовке проб для исследования необходимо соблюдать как меры личной безопасности, так и меры, предупреждающие обсеменение объектов внешней среды, руководствуясь при этом соответствующими правилами и инструкциями.
3.3.2. Для исследования используют фекалии животных (свежие порции), мочу, содержимое кишечника, лимфатические узлы, кусочки паренхиматозных органов вынужденно убитых или погибших животных, кровь, молоко, корма, сточные воды.
3.3.3. Материалы доставляют в лабораторию в день взятия или на следующий день. Допускается хранение материала при минус 20 °С в течение 30 сут.
3.3.4. Все манипуляции, связанные с подготовкой проб, проводятся пипеточными дозаторами переменных объемов (типа "Ленпипет") с использованием одноразовых полипропиленовых пробирок вместимостью 1,5 мл и 10,0 мл (ПО "Ленполимер") и наконечников с аэрозольным барьером. Одноразовую пластиковую посуду (пробирки, наконечники) после использования необходимо сбрасывать в специальный контейнер, содержащий 10 %-ный раствор хлорной извести или 5 %-ный раствор хлорамина Б. После 24-часовой дезинфекции раствор выливают в канализацию, а отработанный пластик выбрасывают в мусорный контейнер.
3.3.5. Пробы фекалий массой 0,3 - 0,8 г тщательно суспендируют в 5,0 мл фосфатного буфера или физиологического раствора. Смесь центрифугируют при 1500 об./мин. в течение 5 мин. для осаждения крупных частиц. Надосадочную жидкость (супернатант) переносят в пробирку типа "эппендорф" и 0,1 мл его используют для выделения ДНК.
3.3.6. Пробы паренхиматозных органов размером 1 см3, а лимфоузлы целиком помещают в пробирки вместимостью 5 - 10 мл, тщательно растирают отдельными стеклянными палочками, тефлоновыми пестиками и т.п. (при необходимости пользуются стерильными фарфоровыми ступками с пестиками, стеклянными гомогенизаторами), добавляют по 1 мл фосфатного буфера (т.е. примерно равный объем) и тщательно перемешивают. Смесь отстаивают при температуре 20 - 25 °С. Через 30 мин. верхнюю фазу переносят в пробирки вместимостью 1,0 - 1,5 мл и используют для выделения ДНК.
3.3.7. Пробы молока и других жидкостей, кроме крови, в объеме 10 мл (при необходимости объем проб доводят до требуемого путем добавления физиологического раствора) центрифугируют при 10 тыс. об./мин. Если осадок практически не виден, то в эту же пробирку вносят еще 10 мл материала и повторяют центрифугирование. Надосадочную жидкость осторожно отбирают, оставив примерно 0,2 мл жидкости, которую смешивают с осадком и 0,1 мл суспензии используют для выделения ДНК.
3.3.8. Кровь в объеме 5 - 10 мл берут в пробирки, содержащие 3 %-ный раствор трилона Б (ЭДТА), из расчета 10:1 и используют для выделения ДНК без предварительной подготовки.
3.3.9. Корма в количестве 1 г помещают в пробирки вместимостью 5 - 10 мл, тщательно растирают отдельными стеклянными палочками, тефлоновыми пестиками и т.п. (при необходимости пользуются фарфоровыми ступками с пестиками, стеклянными гомогенизаторами), добавляют по 1 мл фосфатного буфера или физ. раствора (т.е. примерно равный объем) и тщательно перемешивают. Смесь отстаивают при 20 - 25 °С в течение 30 мин., затем верхнюю фазу переносят в пробирки вместимостью 1,0 - 1,5 мл, ее используют для выделения ДНК.
3.4. Проведение ПЦР-анализа
ПНР-анализ проводят в три этапа в отдельных комнатах (зонах).
3.4.1. ЗОНА 1 (для выделения ДНК из испытуемого материала)
Оборудование:
- настольный бокс с бактерицидной лампой типа "Циклотемп" (СП "РТС");
- термостат для пробирок типа "эппендорф" на 25 - 100 °С (например фирмы "Биоком");
- микроцентрифуга до (12 - 16)×103 об./мин. ("Elmi", "Hettish" или др.);
- центрифуга/вортекстипа "Micro-Spin", "Minigen" ("Биоком");
- отдельный набор автоматических пипеток переменного объема;
- одноразовые наконечники с аэрозольным барьером (например фирм "Биоком", "Хеликон");
- одноразовые полипропиленовые пробирки на 1,5 мл типа "эппендорф" (например "Хеликон");
- холодильник на 2 - 8 °С с морозильной камерой на минус 18 - 20 °С.
3.4.2. ЗОНА 2 (для проведения амплификации - ПЦР)
Оборудование:
- амплификатор (например фирм "ДНК-технология", "Perkin Elmer");
- ПЦР-бокстипа "Циклотемп" (СП "РТС") или отдельный стол с УФ-лампой;
- отдельный халат и одноразовые перчатки;
- отдельный набор автоматических пипеток переменного объема;
- одноразовые наконечники в штативах;
- одноразовые микропробирки для ПЦР на 0,5 мл (например "Хеликон");
- штативы для микропробирок на 0,5 мл;
- холодильник на 2 - 8 °С, морозильник на минус 18 - 20 °С для хранения выделенной ДНК;
- термостат для микропробирок с воском на 95 °С (например "Биоком").
3.4.3. ЗОНА 3 (для электрофоретического анализа продуктов ПЦР)
Оборудование:
- камера для горизонтального электрофореза на 50 проб (например фирм "Хеликон", "ДНК-технология");
- источник постоянного тока с напряжением 150 - 460 В (например "ДНК-технология");
- ультрафиолетовый трансиллюминатор для просмотра гелей (например фирмы "Биоком");
- фотоаппарат для фотографирования гелей или видеосистема с цифровой видеокамерой;
- фотопленка "Микрат-300", бачок для проявления пленки, проявитель, фиксаж;
- аквадистиллятор;
- отдельный халат и одноразовые резиновые перчатки;
- отдельная автоматическая пипетка 10 - 40 мкл и наконечники в штативе;
- мерный цилиндр вместимостью 1 л;
- колба коническая из термостойкого стекла для плавления агарозы;
- электроплитка или микроволновая печь для плавления агарозы;
- пластиковая емкость для дезактивации буфера и гелей, содержащих бромид этидия.
3.5. Порядок работы
3.5.1. ЭТАП 1 (зона № 1). Выделение ДНК из исследуемого материала
3.5.1.1. Подготовительная часть работы
Проверяют состояние сорбента: при отстаивании он должен занимать приблизительно половину объема суспензии.
Лизирующий раствор после хранения при 2 - 8 °С прогревают при 65 °С до полного растворения кристаллов.
Готовят контрольные пробы первого этапа анализа (контроли выделения ДНК). В две пробирки вместимостью 1,5 мл вносят по 100,0 мкл отрицательного контрольного образца (ОКО из набора контрольных образцов).
Если подготовка проб велась с использованием физиологического раствора, то готовят еще один отрицательный контроль (50 мкл физиологического раствора смешивают с 50 мкл ОКО).
3.5.1.2. Основная часть работы
В маркированные пробирки вместимостью 1,5 мл, установленные в штатив, вносят по 100,0 мкл исследуемых проб. Продолжая этот ряд, в штатив устанавливают пробирки контролей выделения ДНК. Во все пробирки добавляют по 300 мкл лизирующего раствора (в каждую пробу отдельным наконечником с аэрозольным барьером) и тщательно перемешивают на вортексе или пипетируют 5 - 10 раз до полного лизиса пробы, стараясь при этом не вспенивать раствор.
Прогревают пробирку 5 мин. при 65 °С, еще раз тщательно перемешивают на вортексе и центрифугируют на микроцентрифуге при 5000 об./мин. в течение 5 с для сброса капель с крышки пробирки. Если биологическая проба растворилась не полностью, пробирку необходимо центрифугировать на микроцентрифуге при (10 - 12)×103 об./мин. в течение 5 мин. и перенести надосадочную жидкость в новую пробирку.
Положительный контроль выделения ДНК ("ПК") получают путем добавления в одну из пробирок со 100 мкл лизированного ОКО 10 мкл ПКО ДНК Y. enterocolitica.
Оставшаяся пробирка с ОКО служит отрицательным контролем выделения ДНК ("ОК").
В каждую пробирку отдельным наконечником добавляют 20 мкл сорбента, ресуспендированного на вортексе, хорошо перемешивают содержимое пробирок на вортексе и оставляют в штативе на 2 мин. для осаждения сорбента, еще раз перемешивают и отстаивают 5 - 10 мин.
Осаждают сорбент на микроцентрифуге при 5000 об./мин. в течение 30 с, после чего удаляют надосадочную жидкость из каждой пробирки отдельным наконечником. Для этого удобно использовать вакуумный отсос с колбой-ловушкой для отбираемой жидкости.
В пробирку вносят по 300 мкл отмывочного раствора № 1. Содержимое пробирки перемешивают на вортексе до полного ресуспендирования сорбента. Если сорбент плохо разбивается, тогда его разбивают пипетированием, используя отдельный наконечник с аэрозольным барьером. Необходимо помнить, что во избежание перекрестной контаминации реакционной смеси открывать пробирку можно лишь "сбросив" капли с крышки кратковременным центрифугированием: 5 с при (5 - 10)×103 об./мин.
Осаждают сорбент на микроцентрифуге при 5000 об./мин. в течение 30 с и удаляют супернатант, как указано выше.
Вносят по 500 мкл отмывочного раствора № 2. Содержимое пробирки перемешивают на вортексе до полного ресуспендирования сорбента, осаждают сорбент на микроцентрифуге при 10000 об./мин. в течение 30 с, затем удаляют супернатант.
Повторяют процедуру отмывки раствором № 2, удаляют супернатант и высушивают осадок сорбента при открытых крышках пробирок в термостате при 65 °С в течение 5 - 7 мин.
В пробирки вносят по 50 мкл элюирующего буфера, ресуспендируют осадок, помещают в термостат при 65 °С на 5 - 6 мин., встряхивая каждую пробирку на вортексе через минуту. Центрифугируют смесь на микроцентрифуге при (10 - 12)×103 об./мин. в течение 1 мин. Супернатант содержит очищенную ДНК, которую используют в ПЦР.
3.5.2. ЭТАП 2 (зона № 2). Постановка ПЦР (амплификация участка ДНК)
3.5.2.1. Подготовительная часть работы
Пробирку с воском ставят в термостат при 95 °С до полного его расплавления.
В микропробирки для ПЦР вносят по 5,0 мкл ПЦР-смеси № 1, сверху наслаивают по 10,0 мкл расплавленного воска так, чтобы он полностью покрыл жидкость, закрывают крышки, на верхней части которых делают пометки "Y.е.". Если воск покрыл жидкость неровно или образовались пузырьки воздуха, то пробирки прогревают в амплификаторе в течение 2 мин. при 95 °С, после чего охлаждают. В таком виде пробирки хранят в морозильной камере холодильника в течение нескольких месяцев. Можно приготовить сразу 100 пробирок.
Готовят положительный контроль ПЦР (ПКО) - ДНК Y. enterocolitica. Для хранения ПКО ДНК Y. enterocolitica его разводят в 10 раз ДНК-буфером (см. паспорт к ПКО).
3.5.2.2. Основная часть работы
В штатив ставят ряд пробирок с ПЦР-смесью № 1 в соответствии с количеством испытуемых проб, включая контрольные из 1-го этапа анализа (контроли выделения ДНК), продолжая ряд, добавляют 2 пробирки для контролей второго этапа анализа (контроли ПЦР). Пробирки маркируют.
На поверхность застывшего воска вносят по 10,0 мкл ПЦР-смеси № 2, при этом она не должна проникать под воск и смешиваться с ПЦР-смесью № 1. В противном случае пробирку бракуют и утилизируют.
Сверху вносят по 1 капле минерального масла. Под масло вносят по 10 мкл испытуемых ДНК-проб и контролей выделения ДНК. В пробирку отрицательного контроля амплификации ("К-") вносят 10 мкл ДНК-буфера для разведения ДНК (набор контрольных образцов). В пробирку положительного контроля амплификации вносят 10 мкл приготовленного 10-кратного разведения ПКО ДНК ("К+").
Набирают на амплификаторе нужную программу (см. таблицу 5.1). Через 1 - 2 мин. после запуска программы, когда температура в ячейке амплификатора достигнет 95 °С, ставят программу на паузу, помещают пробирки в ячейки, закрывают крышку прибора, убирают паузу и ждут окончания реакции (2,5 часа на амплификаторе с регулированием температур по матрице и 1 час 40 мин. на амплификаторе с активным регулированием).
ПРОГРАММА ДЛЯ АМПЛИФИКАЦИИ ДНК Y. ENTEROCOLITICA В ЗАВИСИМОСТИ ОТ ТИПА АМПЛИФИКАТОРА
|
С регулированием температуры по матрице (скорость нагрева-охлаждения - не менее 1 °С/сек.) |
С активным регулированием температуры (по раствору в пробирке) |
||||
|
Например, "Ампли-3" (Биоком), "MiniCycler", "РТС-100" (MJ Research) или др. |
"GeneAmp PSR System 2400" (Perkin Elmer), "Терцик" (ДНК-технология) или др. |
||||
|
95 °С; 5 мин. |
1 цикл |
95 °С; 5 мин. |
1 цикл |
||
|
95 °С; 1 мин. |
|
42 цикла |
95 °С; 10 с |
|
42 цикла |
|
65 °С; 1 мин. |
65 °С; 10 с |
||||
|
72 °С; 1 мин. |
72 °С; 10 с |
||||
|
72 °С; 2 мин. |
1 цикл |
72 °С; 2 мин. |
1 цикл |
||
|
10 °С; 12 - 14 час. (хранение) |
10 °С; 12 - 14 час. (хранение) |
||||
Примечание: длина амплифицированного специфического фрагмента ДНК Y. enterocolitica - 270 п.н.
После окончания реакции (в тот же день или после хранения утром следующего дня) собирают пробирки в отдельный пакет (одноразовый штатив) и отправляют в комнату (зону 3) для анализа продуктов ПЦР, проводимого разделением фрагментов ДНК в агарозном геле.
3.5.3. ЭТАП 3 (зона № 3). Электрофоретический анализ продуктов ПЦР
Работа с амплифицированными ДНК должна проводиться в отдельной комнате лаборантом или сотрудником лаборатории, не производящим манипуляций в пре-ПЦР помещении ("Правила проведения работ в диагностических лабораториях, использующих метод полимеразной цепной реакции. Основные положения", утвержденные Департаментом ветеринарии МСХ РФ 27 января 1997 г. (№ 13-7-2/840)).
3.5.3.1. Подготовительная часть работы
В мерный цилиндр наливают 25,0 мл концентрированного буфера, объем доводят дистиллированной водой до 500,0 мл, закрывают цилиндр парафинированной пленкой ("PARAFILM") и перемешивают.
Агарозу из одной пробирки набора пересыпают в стеклянную колбу из термостойкого стекла объемом 250 мл, наливают 100 мл готового буфера и расплавляют на электроплитке или в микроволновой печи до полного растворения агарозы. Если используется электроплитка, содержимое колбы необходимо периодически перемешивать стеклянной палочкой, чтобы предотвратить пригорание агарозы.
После расплавления агарозы ее осторожно перемешивают, доводят до кипения и немного охлаждают, вращая колбу. Затем заливают агарозный гель в форму по размеру используемой камеры толщиной слоя 5 - 6 мм. Гребенки помещают на расстоянии не менее 3 см друг от друга. После полного застывания геля (примерно через 30 мин.) осторожно вынимают гребенки, не повредив лунки. Помещают пластину геля в электрофорезную камеру лунками в сторону отрицательного электрода (ДНК из лунок должна двигаться к положительному электроду). Наливают приготовленный буфер в таком объеме, чтобы он покрывал поверхность геля на 4 - 5 мм.
3.5.3.2. Основная часть работы
Пробирки с продуктами амплификации размещают в штативе последовательно. Из-под слоя масла отбирают 12,5 мкл амплификата и вносят его на дно лунки. Можно пользоваться одним наконечником, промывая его (пипетируя 1 - 2 раза) буфером из камеры после внесения каждой пробы.
Камеру подключают к источнику тока, соблюдая полярность. Если нет нарушения контактов, то при прохождении тока от электродов должны подниматься пузырьки. Электрофорез проводят в градиенте напряжения 10 В/см до того момента, пока краситель (ксиленцианол) не пройдет примерно половину длины геля. Затем выключают источник тока, переносят гель на трансиллюминатор, расположив его горизонтально лунками вверх. Просматривают расположение полос ДНК под ультрафиолетовым излучением. Глаза и лицо должны быть защищены специальной маской или стеклянной пластиной.
Электрофореграмму фотографируют, используя оранжевый светофильтр в проходящем ультрафиолете, на поляроидную пленку или "Микрат 300", указав порядок нанесения проб. Документирование результатов можно проводить с помощью других систем: Insta Doc I, Insta Doc II (фотографирующие), Gel Doc 1000 или Шатер ДВ (компьютерные).
После использования буфера и геля, содержащих бромид этидия, их необходимо дезактивировать. Для этого к одному объему буфера и геля добавляют равные объемы 0,5 М KMnO4 и 2,5 М HCl, выдерживают смесь 4 - 6 часов, затем добавляют один объем 2,5 М NaOH, осторожно перемешивают и сбрасывают нейтрализованные реактивы в канализацию.
3.6. Учет и интерпретация результатов
3.6.1. Учет результатов ПЦР-анализа следует начинать с результатов амплификации "контролей выделения ДНК" и "контролей ПЦР". В дорожке, соответствующей положительному контролю амплификации ПКО ДНК Y. enterocolitica (этап 2), должна быть яркая специфическая светящаяся полоса на уровне 270 п.н., такая же полоса должна присутствовать в дорожке, соответствующей положительному контролю выделения ДНК (этап 1). В дорожках, соответствующих отрицательным контролям, такая полоса отсутствует (см. таблицу 5.2). Положительными считаются образцы, которые содержат специфическую светящуюся полосу большей или меньшей интенсивности на том же уровне, что и полоса с ПКО ДНК Y. enterocolitica, т.е. 270 п.н.
УЧЕТ РЕЗУЛЬТАТОВ АМПЛИФИКАЦИИ КОНТРОЛЬНЫХ ОБРАЗЦОВ
|
Контроли |
Название реагента |
Наличие полосы 270 п.н. |
|
1-го этапа |
ОКО |
- |
|
|
ОКО + физиологический раствор |
- |
|
|
ОКО + ПКО ДНК Y. enterocolitica |
+ |
|
2-го этапа |
Буфер для элюции |
- |
|
|
ПКО ДНК Y. enterocolitica 1:10 |
+ |
Отрицательными считают пробы, в дорожках которых отсутствует специфическая полоса.
Кроме полос 270 п.н., могут наблюдаться нечеткие размытые полосы праймер-димеров, располагающиеся ниже уровня 100 п.н. (в нижней части дорожки).
Если результаты анализа контрольных образцов не совпадают с показателями, приведенными в таблице 5.2, то соответствующий этап анализа считают невыполненным и исследование повторяют. При несоблюдении температурного режима могут появляться слабые полосы на разных уровнях, отличающихся от 270 п.н. Если интерпретация результатов затруднена, необходимо провести повторную ПЦР с теми же ДНК-пробами.
Повторную ПЦР следует также провести при наличии специфической полосы очень низкой интенсивности (гораздо ниже интенсивности положительных контролей). Если первично полученный результат не повторяется, то его считают сомнительным. Для уточнения результата необходимо провести повторное исследование.
При работе с материалом, содержащим значительное количество клеток (кровь, лимфатические узлы, селезенка и пр.) в ПНР участвует большое количество неспецифической геномной ДНК. В таких случаях в дорожках геля появляются характерные шмеры, равномерно располагающиеся от лунки до самого низа дорожки или концентрирующиеся около лунки. На фоне шмера в положительном образце видна специфическая полоса. При наличии большого количества геномной ДНК может происходить ингибирование ПЦР (в дорожке отсутствует специфическая полоса 270 п.н.), в этом случае рекомендуется переставить амплификацию данной ДНК-пробы, разведя ее в 5 раз буфером для элюции (набор № 1).
3.6.2. Результаты анализа не учитываются, если в дорожке любого отрицательного контроля (выделения ДНК и (или) ПЦР) выявляется специфическая полоса, что может быть обусловлено контаминацией реактивов и проб положительной ДНК и (или) продуктами амплификации положительной ДНК в процессе работы. Для проверки реактивов необходимо поставить не менее трех отрицательных контролей на этапе выделения ДНК и столько же на этапе постановки ПЦР для выявления источника контаминации. Если результат повторяется, необходимо сменить реактивы.
3.7. Результаты молекулярно-генетического анализа формулируют следующим образом: при положительном результате - "В присланном материале (указать каком) обнаружена ДНК возбудителя иерсиниоза (указать вид бактерий)", при отрицательном результате - "В присланном материале (указать каком) ДНК возбудителя иерсиниоза не обнаружена".
***
С утверждением настоящих Методических указаний утрачивают действие "Методические указания по выявлению Yersinia enterocolitica и Yersinia pseudotuberculosis в пищевых продуктах животного происхождения", утвержденные Департаментом ветеринарии Минсельхозпрода РФ 23.09.1998.
Приложение
ГЛИЦЕРИНОВЫЙ РАСТВОР ДЛЯ КОНСЕРВИРОВАНИЯ ФЕКАЛИЙ
Состав:
- глицерин нейтральный, 300 мл;
- натрий хлористый, 5 г;
- вода дистиллированная, 700 мл.
Раствор стерилизуют при 1 атм. (121 °С) в течение 20 мин. или прогревают в водяной бане (100 °С) в течение 30 - 40 мин.
И-БУЛЬОН
Состав основы среды:
- пептон - 5 г;
- дрожжевой экстракт - 2,5 г;
- натрий хлористый - 10 г;
- вода дистиллированная - до 500 мл;
- коммерческая селективная добавка для иерсиний (в расчете на 500 мл среды).
Все компоненты, за исключением селективной добавки, растворяют в воде и устанавливают pH 7,2 - 7,4. После этого среду кипятят 10 - 15 мин., фильтруют в горячем состоянии через бумажный фильтр и стерилизуют при 1 атм. (121 °С) в течение 20 мин.
Коммерческую селективную добавку для иерсиний (например, FD034 компании HiMedia Laboratories Pvt. Limited) растворяют в 2 мл раствора этанола (1 мл 96° спирта-ректификата смешивают с 1 мл стерильной дистиллированной воды). Основу питательной среды охлаждают до 45 - 50 °С и стерильной пипеткой вносят в нее спиртовой раствор селективной добавки, тщательно размешивают и разливают по 4 - 5 мл в стерильные пробирки.
Коммерческая селективная добавка для иерсиний (состав в расчете на 500 мл основы питательной среды):
- цефсулодин - 7,5 мг;
- иргасан - 2,0 мг;
- новобиоцин - 1,25 мг.
И-АГАР (М843 - основа селективного агара для иерсиний)
Состав:
- пептон - 20 г;
- дрожжевой экстракт - 2 г;
- маннит - 20 г;
- натрия хлорид - 20 г;
- натрия пируват - 2 г;
- нейтральный красный - 0,03 г;
- кристаллический фиолетовый - 0,001 г;
- агар-агар - 12,5 г;
- иргасан (триклозан) - 0,004 г;
- вода дистиллированная - до 1000 мл.
Все компоненты, за исключением иргасана, растворяют в дистиллированной воде, устанавливают pH 7,2 - 7,4. После чего среду кипятят 10-15 мин., фильтруют в горячем состоянии через ватно-марлевый фильтр и стерилизуют при 0,5 атм. (121 °С) в течение 20 мин. Навеску иргасана, равную 4 мг, растворяют в 2 мл спиртово-водной смеси, которую готовят так же, как для селективной добавки И-бульона, и вносят в основу среды, расплавленную и охлажденную до 45 - 50 °С.
Среду тщательно размешивают и разливают в стерильные чашки Петри.
Примечание: Продажу основы среды (М843), селективной добавки (FD034) и иргасана (FD208) осуществляют представители компании HiMedia Laboratories Pvt. Limited по адресу: 124498, Москва, а/я 130. Контактные телефоны: (495) 940-33-12, 940-33-96, 940-33-97.
ПИТАТЕЛЬНАЯ СРЕДА ДЛЯ ВЫДЕЛЕНИЯ ИЕРСИНИЙ, СУХАЯ
Среду готовят согласно указанию на этикетке флакона. Заявки на приобретение среды направлять по адресу: 367025, Республика Дагестан, г. Махачкала, ул. Леваневского, 24, отделение НПО "Питательные среды". Контактные телефоны: (872) 2-62-82-30; 2-62-47-68.
СРЕДА С ЖЕЛЧЬЮ И БРОМТИМОЛОВЫМ СИНИМ (СБТС)
СБТС изготавливает НПО "Питательные среды" при Государственном научном центре прикладной микробиологии. Среду готовят согласно указанию на этикетке флакона. Заявки на приобретение среды направляют по адресу: 142279, Московская обл., Серпуховский р-н, пос. Оболенск, ГНЦПМ, отделение "Питательные среды". Контактные телефоны: (0967) 36-00-92, 36-00-99.
ТЕСТ НА КАТАЛАЗУ
Этот тест дает возможность определить наличие или отсутствие фермента каталазы, за счет которого разлагается перекись водорода с образованием молекулярного кислорода.
Тест проводят с односуточной агаровой культурой. На зону роста наносят несколько капель 3 %-ного раствора перекиси водорода. Для теста непригодны культуры, выращенные на средах с добавлением крови, так как каталаза крови может давать ложный положительный результат. Исследование культуры можно проводить на предметном стекле в капле реактива, суспендируя в нем исследуемую культуру запаянным концом пастеровской пипетки или стеклянной палочки. О положительном результате свидетельствует активное выделение пузырьков газа. Реактив хранят в стеклянной посуде из темного стекла в холодильнике (4 - 6 °С).
ТЕСТ НА ОКСИДАЗУ
Данный тест позволяет выявлять наличие фермента оксидазы. Определение оксидазной активности проводят у односуточной культуры бактерий, выращенной на скошенном МПА при 22 - 25 °С. Культуру снимают с поверхности агара платиновой петлей (петли из другого металла не используют, т.к. могут появиться ложные положительные результаты) или запаянным концом пастеровской пипетки и суспендируют в 1 %-ном водном растворе тетраметил-парафенилендиамина дигидрохлорида или диметил-парафенилендиамина гидрохлорида.
Навески тетраметил-парафенилендиамина дигидрохлорида или диметил-парафенилендиамина гидрохлорида по 100 мг вносят в пробирки с ватными пробками. Пробирки хранят в сосуде из темного стекла. На дно сосуда насыпают немного сернокислого кальция для поглощения влаги. Перед использованием к содержимому одной пробирки добавляют 10 мл дистиллированной воды, растворяют реактив и переливают раствор в небольшую капельницу. Водные растворы стабильны в течение одной недели при хранении в холодильнике (4 - 6 °С) или неограниченно долго в замороженном состоянии.
При наличии фермента оксидазы суспензия приобретает красный цвет (положительная реакция), указывающий, что выделенная культура не относится к семейству энтеробактерий.
Для определения оксидазы можно использовать оксидазную индикаторную бумагу (входит в состав СИБ, выпускаемых предприятием по производству бактерийных препаратов Нижегородского НИИЭМ), на которую наносят культуру стеклянной палочкой или платиновой петлей.
СРЕДА КЛАРКА (используется для реакций с метиловым красным и Фогеса-Проскауэра)
Состав:
- пептон - 5 г;
- глюкоза - 5 г;
- калия гидрофосфат (K2HPO4) - 5 г;
- вода дистиллированная - до 1000 мл.
Компоненты растворяют в воде, кипятят 2 - 3 мин., фильтруют через бумагу, устанавливают pH 6,9 - 7,0. Среду разливают в пробирки по 4 мл и стерилизуют 20 мин. при 112 °С или текучим паром три дня подряд по 20 мин.
ПРОБА С МЕТИЛОВЫМ КРАСНЫМ
Проба с метиловым красным позволяет определять способность бактерий образовывать стабильные кислые конечные продукты при сбраживании глюкозы. При расщеплении глюкозы, содержащейся в этой среде, происходит снижение pH среды, что улавливается при помощи индикатора метилового красного в диапазоне pH 4,4 - 6,0.
В среду Кларка, разлитую в пробирки по 4 мл, засевают бактериологической петлей испытуемую культуру и инкубируют при 22 - 25 °С в течение 2 сут.
Для проведения реакции в пробирку с выросшей культурой добавляют 5 - 6 капель спиртового раствора метилового красного. Изменение соломенного цвета среды на красно-малиновый свидетельствует о положительной реакции (pH 4,0 - 5,0); при отрицательном результате среда приобретает желтый цвет (pH 6,0 - 7,0); оранжевая окраска указывает на сомнительную реакцию.
Раствор метилового красного
Раствор метилового красного готовят путем добавления 0,01 г кристаллической краски к 30 мл 96° этилового спирта. После растворения красителя добавляют 20 мл дистиллированной воды. Хранят реактив при комнатной температуре. Срок хранения - 1 год в темном месте.
РЕАКЦИЯ ФОГЕСА-ПРОСКАУЭРА
Реакция Фогеса-Проскауэра позволяет определять способность микроорганизмов образовывать при сбраживании глюкозы ацетилметилкарбинол (ацетоин).
Испытуемую культуру выращивают 2 сут. в среде Кларка в двух пробирках. Одну пробирку инкубируют при 25 °С, другую при 37 °С. Из обеих пробирок переносят по 2 мл культуры в другие чистые пробирки и добавляют в каждую вначале по 1,0 мл 6 %-ного спиртового раствора а-нафтола, а затем 0,4 мл 40 %-ного водного раствора КОН. Содержимое пробирок встряхивают и проводят учет реакции через 15 - 30 мин. При положительной реакции (наличие ацетилметилкарбинола) культура окрашивается в розовый цвет; при отрицательной - в желтый; при сомнительной - в светло-оранжевый.
6 %-ный а-нафтол в 96° этиловом спирте хранят в темном месте при комнатной температуре не более 30 суток.
ОПРЕДЕЛЕНИЕ СЕРОВОДОРОДА
Источником образования сероводорода могут быть различные соединения серы: органические (цистеин, цистин, метионин) и неорганические (сульфат, сульфит, тиосульфат).
При наличии у микроорганизмов фермента тиосульфатредуктазы тиосульфат натрия восстанавливается в сульфит с выделением сероводорода. Сероводород взаимодействует с сернокислым железом, образуя сульфит железа черного цвета. Для обнаружения сероводорода используют следующие среды.
Среда для обнаружения сероводорода
Состав:
- железа (II) сульфат (FeSO4 7Н2О) - 0,2 г;
- натрия тиосульфат (Na2S2O3 5Н2О) - 0,3 г;
- лактоза -1 г;
- феноловый красный (0,2 %-ный водн.) - 12 мл;
- мясо-пептонный агар (МПА; 1,7 %-ный) - до 1000 мл.
В расплавленном стерильном МПА растворяют остальные компоненты, разливают в стерильные пробирки по 6 - 7 мл и стерилизуют текучим паром однократно в течение 20 мин. Готовая среда имеет бордово-красный цвет.
Перед употреблением среду скашивают так, чтобы столбик агара был не менее 2,5 - 3 см. Среду засевают агаровой культурой бактерий вначале на скошенную поверхность, а затем уколом в столбик. В случае образования сероводорода среда в столбике окрашивается в черный цвет. При отрицательном результате почернения среды не наступает.
Среда Клиглера
Состав:
- мясная вода - 1000 мл;
- пептон - 20 г;
- натрия хлорид - 5 г;
- натрия сульфат (Na2SO4) - 0,4 г;
- натрия тиосульфат (Na2S2O3 5Н2О) - 0,08 г;
- агар питательный сухой - 20 г;
- лактоза -10 г;
- сахароза -10 г;
- глюкоза -1 г;
- железа (II) сульфат (FeSO4 7Н2О) - 0,5 г;
- феноловый красный (0,2 %-ный раствор в 50 %-ном этаноле) - 12 мл.
В мясную воду добавляют пептон, соли натрия и агар. Смесь кипятят до растворения агара, устанавливают pH 7,2 - 7,4. Вновь кипятят, фильтруют через вату, добавляют растворенное в небольшом количестве воды сернокислое железо, лактозу, сахарозу, глюкозу и индикатор. Среду разливают по 6 - 7 мл в пробирки, автоклавируют 15 - 20 мин. при 0,5 атм. (112 °С). Готовая среда оранжево-красного цвета. При образовании сероводорода столбик среды чернеет.
Коммерческую сухую среду готовят в соответствии с указаниями на этикетке.
Трехсахарный агар с мочевиной по Олькеницкому
Эту среду применяют также для определения способности микроорганизмов сбраживать те или иные углеводы, добавленные в основную среду, с образованием или без образования газа.
Состав:
- агар питательный сухой - 25 г;
- лактоза -10 г;
- сахароза -10 г;
- глюкоза -1 г;
- железа (II) аммонийного сульфат [FeSO4 (NH4)2 SO4 6Н2О] - 0,2 г;
- натрия тиосульфат (Na2S2O3 5Н2О) - 0,3 г;
- мочевина -10 г;
- феноловый красный (0,4 %-ный водный раствор) - 4 мл;
- вода дистиллированная - до 1000 мл.
Соли растворяют в небольшом объеме дистиллированной воды. Углеводы и мочевину также растворяют в небольших объемах воды при подогревании в водяной бане. Сухой питательный агар расплавляют в оставшемся объеме воды при нагревании и помешивании. Затем все ингредиенты смешивают с расплавленным агаром, фильтруют через ватно-марлевый фильтр, устанавливают pH 7,2 - 7,4. После добавления индикатора среду хорошо перемешивают, разливают в пробирки по 6 - 7 мл.
Стерилизуют текучим паром 3 дня подряд по 20 мин. или при 0,5 атм. (112 °С) 15 мин. Среду скашивают, оставляя столбик не менее 2,5 - 3,0 см. Готовая среда бледно-розового цвета. Учет результатов проводят через 24 и 48 часов.
При образовании сероводорода происходит почернение среды в столбике. О ферментации лактозы и сахарозы в средах Клиглера и Олькеницкого судят по появлению желтой окраски в скошенной части агара. О ферментации глюкозы - по окрашиванию столбика в аналогичный цвет. В культурах, ферментирующих лактозу и сахарозу, вся среда (столбик и косяк) приобретает желтый цвет. Газообразование устанавливают по наличию пузырьков в среде, разрывов агара или его отслоению от дна и стенок пробирок.
В случае гидролиза мочевины происходит окрашивание столбика и косяка среды Олькеницкого в малиновый цвет.
ОПРЕДЕЛЕНИЕ СПОСОБНОСТИ К ФЕРМЕНТАЦИИ УГЛЕВОДОВ
Для изучения ферментации углеводов с образованием кислоты или кислоты и газа используют среды Гисса.
Состав:
- пептон - 10 г;
- натрия хлорид - 5 г;
- индикатор Андреде - 10 мл;
- углевод для теста - 10 г;
- вода дистиллированная - до 1000 мл.
Среду нагревают до полного растворения компонентов. Затем фильтруют через бумажный фильтр, устанавливают pH 7,0 - 7,2, добавляют углевод. Приготовленную среду разливают в пробирки со стеклянными поплавками по 5 мл и стерилизуют при 112 °С 15 мин.
Индикатор Андреде
Состав:
- фуксин кислый - 0,2 г;
- натрия гидроксид (1 N раствор NaOH) - 16 мл;
- дистиллированная вода - до 100 мл.
Индикатор стерилизуют автоклавированием при 121 °С в течение 20 мин. Фуксин растворяют в дистиллированной воде, затем добавляют NaOH. Раствор выдерживают в течение суток. Если фуксин недостаточно обесцветился (не бледно-желтого цвета), добавляют дополнительно 0,1 - 0,2 мл щелочи.
Для изучения ферментативных свойств бактерий можно использовать сухие питательные среды с углеводами и индикатором ВР (НПО "Питательные среды"), которые готовят согласно указанию на этикетке, или готовые бумажные тест-системы.
ГИДРОЛИЗ МОЧЕВИНЫ
Уреазоактивные бактерии гидролизуют мочевину с образованием аммиака и углекислоты. При этом pH среды сдвигается в щелочную сторону, что устанавливают при помощи индикатора фенолового красного.
Для определения способности бактерий расщеплять мочевину применяют среды с мочевиной по Кристенсену или по Преусу.
Среда Кристенсена
Состав:
- пептон - 1 г;
- натрия хлорид - 5 г;
- агар-агар - 20 г;
- калия дигидрофосфат (KH2PO4 ) - 2 г;
- глюкоза - 1 г;
- феноловый красный (0,2 %-ный раствор) - 6 мл;
- мочевина (20 %-ный водный раствор) - 100 мл;
- вода дистиллированная - 900 мл.
Все компоненты, кроме мочевины, растворяют в воде, устанавливают pH 6,9 - 7,0 и стерилизуют 15 - 20 мин. при 112 °С. Раствор мочевины, профильтрованный через фильтр Зейтца, добавляют в расплавленную и охлажденную до 50 °С стерильную среду и тщательно размешивают. Перед употреблением среду расплавляют, разливают в пробирки по 5 мл и скашивают. Готовая среда имеет бледно-розовый цвет.
Среда Преуса
Состав:
- бульон Хоттингера или мартеновский бульон - 1000 мл;
- агар-агар - 15 г;
- глюкоза - 5 г;
- мочевина (50 %-ный водный раствор) - 20 мл;
- бромтимоловый синий (0,2 %-ный раствор) - 12 мл.
К стерильному расплавленному агару в бульоне Хоттингера или мартеновском бульоне с pH 6,9 - 7,0 добавляют глюкозу, растворы мочевины и индикатор бромтимоловый синий. Расплавленную среду разливают в стерильные пробирки по 5 мл и стерилизуют однократно текучим паром 20 - 30 мин. или при 112 °С в течение 15 мин. Перед употреблением среду расплавляют и скашивают. Готовая среда имеет зеленовато-оливковый цвет.
Испытуемую культуру засевают на одну из сред с мочевиной частыми штрихами и инкубируют при 37 °С в течение 2 сут. При положительном результате (щелочение среды) среда Кристенсена окрашивается в красно-малиновый цвет, а среда Преуса - в синий; при отрицательном результате окраска этих сред не изменяется.
УТИЛИЗАЦИЯ ЦИТРАТА НАТРИЯ
Способность иерсиний утилизировать соли цитрата в качестве единственного источника углерода определяют путем посева на среду Симмонса.
Среда Симмонса
Состав:
- натрия хлорид - 5 г;
- магния сульфат (MgSO4 7Н2О) - 0,2 г;
- аммония дигидрофосфат (NH4Н2РО4) - 1 г;
- калия гидрофосфат (K2НРО4) - 1 г;
- натрия цитрат - 3 г;
- агар питательный сухой - 20 г;
- бромтимоловый синий - 0,08 г;
- дистиллированная вода - до 1000 мл.
В дистиллированной воде расплавляют агар. Соли растворяют отдельно в небольшом объеме воды и затем смешивают с расплавленным агаром, доводя объем до 1000 мл. Устанавливают pH 7,0 - 7,2, после чего добавляют 40 мл 0,2 %-ного водного раствора бромтимолового синего, компоненты перемешивают. Среду разливают по 5 - 7 мл в пробирки и стерилизуют 15 мин. при 121 °С. Перед употреблением среду скашивают. При положительной реакции отмечается рост культуры на среде и изменение зеленовато-оливкового цвета на синий. При отсутствии у бактерий способности усвоения цитратных солей роста культуры не наблюдается и цвет среды не изменяется.
ОПРЕДЕЛЕНИЕ ФЕНИЛАЛАНИНДЕЗАМИНАЗЫ
Метод основан на выявлении фенилпировиноградной кислоты, образующейся из фенилаланина. Культуру высевают на среду, содержащую фенилаланин.
Состав:
- дрожжевой экстракт (сухой) - 3 г;
- натрия хлорид - 5 г;
- L-фенилаланин - 1 г;
- натрия гидрофосфат (Na2НРО412Н2О) - 1 г;
- агар питательный сухой - 12 г;
- вода дистиллированная - до 1000 мл.
После растворения дрожжевого экстракта в воде среду нагревают, добавляют остальные компоненты и кипятят до расплавления агара. Устанавливают pH среды 7,0 - 7,2. Горячую среду фильтруют через ватно-марлевый фильтр, разливают в пробирки по 3 - 4 мл и стерилизуют при 112 °С 30 мин. Перед употреблением среду скашивают.
При использовании готовой сухой среды с фенилаланином ее готовят согласно указанию на этикетке флакона.
Среду с фенилаланином засевают суточной агаровой культурой штрихом по скосу агара и через 12 - 18 часов инкубирования пробирок на культуру наносят 5 - 6 капель 10 %-ного водного раствора хлористого железа (трехвалентного). Более длительное инкубирование может привести к ложноотрицательному результату при исследовании представителей семейства Enterobacteriaceae. Окрашивание культуры в зеленый цвет свидетельствует о дезаминировании фенилаланина, при отрицательном результате культура имеет желтый цвет.
ОПРЕДЕЛЕНИЕ ИНДОЛА
Исследуемую культуру бактерий культивируют в одной из жидких питательных сред (в МПБ, бульоне Хоттингера, 2 %-ной пептонной воде) в течение 2 сут., после чего, наклоняя пробирку, на ее стенку добавляют 0,3 - 0,5 мл реактива Эрлиха или Ковача и встряхивают культуру. Учет результатов проводят через 3 - 5 мин.
Реактив Эрлиха
Состав:
- пара-диметиламинобензоальдегид - 1 г;
- этиловый спирт (96°) - 95 мл;
- кислота соляная концентрированная - 20 мл.
В этиловом спирте растворяют пара-диметиламинобензоальдегид, затем медленно добавляют кислоту. Реактив готовят в небольшом количестве и хранят при температуре 4 - 6 °С не более 6 мес. При образовании индола на поверхности культуры появляется розовое окрашивание в виде диска. Окрашивание поверхности культуры в желтый цвет указывает на отсутствие индола.
Реактив Ковача
Состав:
- пара-диметиламинобензоальдегид - 5 г;
- спирт амиловый - 75 мл;
- соляная кислота концентрированная - 25 мл.
Приготовление, хранение и применение аналогичны реактиву Эрлиха. В случае образования индола за счет реактива Ковача верхний слой культуры окрашивается в красный цвет, при отрицательной реакции - в желтый.
Индикаторные бумажки для определения индола
Для приготовления индикаторных бумажек готовят реактив.
Состав:
- пара-диметиламинобензоальдегид - 5 г;
- ортофосфорная кислота концентрированная (Н3РО4) - 10 мл;
- спирт этиловый 96° - 50 мл.
Реактив переливают в эмалированный металлический кювет, в который помещают кусочки фильтровальной бумаги. Пропитанные реактивом бумажки высушивают на воздухе при комнатной температуре, затем нарезают полосками размером 0,7 - 0,8 × 10 - 12 см. Бумажки имеют желтый цвет. Хранят их в банке из темного стекла, закрытой резиновой или корковой пробкой.
Для приготовления индикаторных бумажек можно использовать реактив Эрлиха или Ковача.
Применение: после посева изучаемой культуры на любую из сред для определения индола в пробирку помещают полоску индикаторной бумажки, верхний конец которой прижимают ватно-марлевой пробкой. Нижний конец бумажки должен быть на расстоянии не менее 3 - 4 см от поверхности среды. Засеянные пробирки инкубируют в термостате в течение двух суток. При наличии индолообразования нижний конец индикаторной бумажки окрашивается в малиново-красный цвет, при отрицательной - цвет бумажки не изменяется.
СОДЕРЖАНИЕ
|
2. Бактериологическое исследование. 3 3. Молекулярно-генетическая диагностика иерсиниоза*. 11 Приложение. Глицериновый раствор для консервирования фекалий. 18
|