 | Информационная система |  |
Государственное санитарно-эпидемиологическое
нормирование
Российской Федерации
4.2. МЕТОДЫ КОНТРОЛЯ. БИОЛОГИЧЕСКИЕ
И МИКРОБИОЛОГИЧЕСКИЕ ФАКТОРЫ
Санитарно-бактериологические исследования
методом разделенного импеданса
Методические указания
МУК 4.2.2578-10
Москва 2010
1. Разработаны Федеральной службой по надзору в сфере защиты прав потребителей и благополучия человека (И.В. Брагина); ФГУЗ «Федеральный центр гигиены и эпидемиологии» Роспотребнадзора (А.И. Верещагин, М.В. Зароченцев, И.В. Новокшонова, М.А. Ярославцева); ФГУН ГНЦ МПБ Роспотребнадзора (М.В. Храмов, В.М. Храмов); ФГУЗ «Центр гигиены и эпидемиологии в г. Москве» (Н.Я. Салова); фирмой «SY-LAB Gerate GmbH», Австрия (М. Шинкингер, Е.Я. Слободецкая, М.Б. Беглов).
2. Рекомендованы к утверждению Комиссией по государственному санитарно-эпидемиологическому нормированию при Федеральной службе по надзору в сфере защиты прав потребителей и благополучия человека (протокол от 03.12.09 № 3).
3. Утверждены и введены в действие Главным государственным санитарным врачом Российской Федерации, Руководителем Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека Г.Г. Онищенко 19.02.10.
4. Введены взамен МУК 4.2.590-96 «Бактериологические исследования с использованием микробиологического экспресс-анализатора «БакТрак 4100» и методических указаний «Использование метода измерения электрического сопротивления (импеданса) для санитарно-бактериологического исследования объектов окружающей среды», 2005 г.
СОДЕРЖАНИЕ
|
УТВЕРЖДАЮ Руководитель
Федеральной службы ______________________ Г.Г. Онищенко 19 февраля 2010 г. Дата введения: с момента утверждения |
4.2.
МЕТОДЫ КОНТРОЛЯ. БИОЛОГИЧЕСКИЕ
И МИКРОБИОЛОГИЧЕСКИЕ ФАКТОРЫ
Санитарно-бактериологические исследования
методом разделенного импеданса
Методические указания
МУК 4.2.2578-10
1. Область применения
1.1. Настоящие методические указания предназначены для органов и организаций Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека, осуществляющих контроль качества и безопасности продовольственного сырья и пищевых продуктов, а также мониторинг их микробной загрязненности; лабораторий других организаций, аккредитованных в установленном порядке на проведение исследований продовольственного сырья и пищевых продуктов; организаций, независимо от форм собственности осуществляющих производственный контроль продовольственного сырья и пищевых продуктов в процессе промышленного производства и оборота продукции.
1.2. Методические указания представляют ускоренный метод качественного и количественного определения санитарно-показательных, условно-патогенных и патогенных микроорганизмов, регламентированных действующими документами (технические регламенты, СанПиН, ГОСТ, МУК, МУ и т.д.).
2. Нормативные ссылки
1. Федеральный закон «О санитарно-эпидемиологическом благополучии населения» от 30 марта 1999 г. № 52-ФЗ.
2. Федеральный закон «О качестве и безопасности пищевых продуктов» от 02 января 2000 г. № 29-ФЗ.
3. СанПиН 2.3.2.1078-01 «Гигиенические требования безопасности и пищевой ценности пищевых продуктов».
4. СанПиН 2.3.2.1280-03 «Дополнения и изменения 2 к СанПиН 2.3.2.1078-01 «Гигиенические требования безопасности и пищевой ценности пищевых продуктов».
5. ГОСТ 51446-99 (ИСО 7218-96) «Продукты пищевые. Общие правила микробиологических исследований».
6. ГОСТ 26669-85 «Продукты пищевые и вкусовые. Подготовка проб для микробиологического анализа».
7. СанПиН 1.2.681-97 «Производство и контроль парфюмерно-косметической продукции для обеспечения ее безопасности и качества».
3. Сущность импедансного метода
Методические указания содержат описание метода ускоренного микробиологического исследования продовольственного сырья, пищевых продуктов и других объектов внешней среды с использованием микробиологических экспресс-анализаторов, регистрирующих изменения электрического сопротивления (импеданса) питательной среды, происходящего под влиянием процессов роста и жизнедеятельности микроорганизмов в исследуемой пробе.
Классические методы микробиологических исследований, используемые в практике бактериологических лабораторий, требуют больших затрат труда и времени, достаточно длительны и позволяют получать результаты в течение нескольких дней.
Предлагаемый метод на основе метода разделенного импеданса позволяет получать быстрые (в течение нескольких часов) и надежные результаты для большого числа одновременно исследуемых образцов.
Импеданс - сопротивление потоку переменного тока через проводящий материал; является функцией активной проводимости, емкостного сопротивления и применяемой частоты.
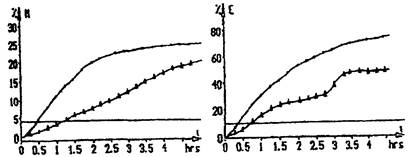
Приборы «БакТрак» серии 4000 на основе метода разделенного импеданса регистрируют 2 определенных показателя импеданса для каждого измерения. Эти величины показаны как М-величина (импеданс среды) и Е-величина (импеданс электрода). Измерения М-параметра представляет собой относительное изменение (уменьшение) импеданса среды, выраженное в процентах к начальному измерению. М-параметр в основном отображает ту часть импеданса, которая связана с активной проводимостью. На него непосредственное влияние оказывает ионный состав среды при росте микроорганизмов, а также используемый для анализа образец. В силу этих причин при высокой электропроводимости питательной среды данный параметр теряет значимость. На величину Е-параметра состав питательной среды влияет уже не в столь сильной мере, что весьма важно в случаях, когда используются среды с высоким содержанием солей (т.е. в них добавлены соли в качестве селективных компонентов, используемых для обнаружения патогенных микроорганизмов).
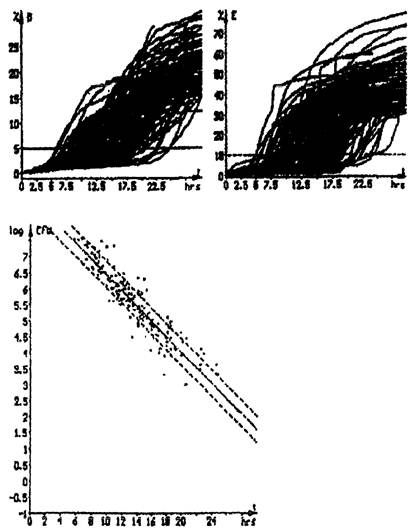
Импедансная микробиология является непрямым культуральным методом обнаружения микроорганизмов с использованием определения электрического импеданса. Изменения импеданса обычно происходят в питательной среде по мере того, как ее химический состав изменяется в результате роста и метаболической активности микроорганизмов. Под действием микроорганизмов заряженные конечные продукты метаболизма выделяются в ростовую среду. В основном незаряженные или слабо заряженные субстраты превращаются в сильно заряженные конечные продукты. Так, например, белки метаболизируются до аминокислот, углеводы и жиры - до органических кислот. Образующиеся метаболиты имеют меньший размер и, таким образом, более подвижны. Эти электрохимические изменения в ростовой среде приводят к существенным изменениям импеданса. Экспоненциальные изменения импедансного сигнала могут наблюдаться, когда количество микроорганизмов достигает порога около 106 - 107 клеток/мл.
Время, необходимое для достижения значимого изменения импеданса, называется временем определения импеданса (IDT). Значение IDT обратно пропорционально начальной концентрации микроорганизмов в исследуемой пробе. Ход кривых импедансного сигнала соответствует и отражает кривую роста микроорганизмов в исследуемой пробе.
Среди разработанных и применяющихся в настоящее время исследовательских микробиологических экспресс-анализаторов, предназначенных для ускоренного обнаружения микроорганизмов на основе импедансных технологий, наибольшее распространение получили приборы серии «Бак Трак 4000» производства фирмы «SY-LAB Gerate GmbH» (Австрия).
Прибор «БакТрак» является автоматизированной экспресс-системой для ускоренной количественной и качественной оценки степени микробной контаминации продовольственного сырья, пищевых продуктов, косметической и фармацевтической продукции, питьевой воды и других объектов внешней среды.
Приборы «БакТрак 4300», «БакТрак 4100» и «БиоТрак 4250» внесены в Реестр средств измерений как кондуктометрические анализаторы для микробиологических исследований. Метод, основанный на измерении импеданса, приборы «БакТрак 4300», «БакТрак 4100» и «БиоТрак 4250», внесены в Национальные стандарты ряда европейских стран: Германии - DIN 10115, 10120, 10121, Австрии - ONORM 10115, 10120, 10121, Франции - AFNOR NF V08-105 (Микробиология продуктов питания и кормов: указания по импедансному методу для микробиологических исследований), AFNOR NF V08-106 (Определение количества Е. coli в морепродуктах качественным методом, используя метод прямого импеданса).
Метод валидирован как альтернативный метод анализа в соответствии с ISO 16140:2003 Институтом стандартизации AFNOR, Франция.
4. Аппаратура, материалы, реактивы и питательные среды
4.1. Экспресс-анализатор «БакТрак 4300»
Экспресс-анализатор «БакТрак 4300» включает:
- 2 инкубаторных блока для одновременного анализа 64 образцов, каждый инкубаторный блок имеет независимую систему термостатирования;
- управляющий блок (персональный компьютер);
- программное обеспечение; программа позволяет подключать до 12 модулей «БакТрак 4300», обычная конфигурация: 1 - 3 «БакТрака» подключаются к управляющему блоку;
- измерительные ячейки:
• многоразовые измерительные ячейки (стеклянные) на 10 мл с 4 электродами (с зелеными, желтыми и красными крышками);
• многоразовые измерительные ячейки (стеклянные) на 10 мл с 4 электродами для анаэробов;
• одноразовые измерительные ячейки (пластиковые), стерильные на 20 мл;
• измерительные ячейки для определения дрожжей и плесеней с ограниченным сроком использования на 20 мл (для непрямого метода);
• одноразовые пластиковые стерильные внутренние пробирки для измерительных ячеек непрямого метода на 7 мл.
4.2. Экспресс-анализатор «БакТрак 4100»
Экспресс-анализатор «БакТрак 4100» включает:
- 1 инкубаторный блок, представляющий собой алюминиевую камеру на 40 образцов;
- управляющий блок (персональный компьютер);
- программное обеспечение. Можно одновременно использовать до 6 блоков, подключенных к одному персональному компьютеру;
- измерительные ячейки (те же самые, что и для «БакТрака 4300»).
4.3. Экспресс-анализатор «БиоТрак 4250»
Экспресс-анализатор «БиоТрак 4250» включает:
- 1 инкубаторный блок с возможностью одновременного анализа до 21 образца;
- управляющий блок (портативный компьютер);
- программное обеспечение;
- измерительные ячейки (те же самые, что и для «БакТрака 4300» за исключением измерительных ячеек для анаэробов).
Дополнительно для всех приборов имеются:
• температурные ячейки NTC 1000 Ом, 10 мл;
• набор для охлаждения прибора;
• набор для очистки прибора;
• набор измерительных ячеек для проверки прибора;
• ультразвуковая мойка для ячеек (рекомендуется);
• источник бесперебойного питания;
• набор сухих питательный сред (гл. 9).
Для работы с анализаторами серии «БакТрак 4000» в лаборатории должны быть в наличии:
• стерилизатор паровой;
• шкаф сушильно-стерилизационный;
• шкаф ламинарный (бокс биологической безопасности);
• термостаты;
• весы лабораторные;
• pH-метр;
• посуда лабораторная;
• пипетки и дозаторы.
5. Установка параметров измерения
при работе на приборах серии «БакТрак 4000»
5.1. Установка параметров измерения при работе
на приборе «БакТрак 4100»
1. Установить температуру измерения на инкубаторном блоке прибора «БакТрак 4100».
2. В основном меню программы выбрать подменю «Параметры блока» и установить следующие параметры:
|
Время исследования |
|
|
Интервал |
10 мин (20 мин) |
|
Время нагрева |
1 ч |
|
Масштаб измерений: |
|
|
М-параметр |
|
|
Е-параметр |
|
3. В основном меню программы выбрать подменю «Параметры ячейки» и ввести следующие параметры:
|
Текст |
Вид продукции или определяемого показателя |
|
Установить |
В случае использования калибровочного файла для проведения анализа выбрать соответствующий файл в данной директории «Параметры», тогда пороговые значения и временные интервалы вводятся автоматически |
|
Пороговые значения |
Установить параметры для учета результатов - «Порог М» и/или «Порог Е», ввести пороговые значения для М-параметра и Е-параметра |
|
Временные интервалы |
Ввести пороговые значения по времени - «Интервал 1» и «Интервал 2» |
4. Выбрать в основном меню программы подменю «Начать измерение».
5. После того как каждая позиция блока будет отмаркирована как свободная на экране монитора, установить для каждой позиции параметры измерения (с помощью клавиши F3 вызвать весь список исследований и выбрать соответствующий для данного типа анализа) и поместить измерительные ячейки в инкубаторный блок.
Измерение начнется автоматически через 1 ч после загрузки ячеек в прибор.
6. При пересечении заданных пороговых значений для М-параметра или Е-параметра проба оценивается по светофорной системе - красному, желтому, зеленому цветам (в случае если были заданы временные интервалы) и/или происходит автоматический подсчет микроорганизмов в исследуемом образце (в случае использования калибровочного файла).
Посредством клавиш F5, F6, F7 и F8 можно изменить тип индикации и получить полную информацию на каждое измерительное место.
Подробное описание программы и порядок действий при работе на приборе представлены в инструкции для пользователя.
5.2. Установка параметров измерения при работе
на приборе «БакТрак 4300»
Программное обеспечение для работы на микробиологическом анализаторе «БакТрак 4300» состоит из двух частей:
«БакМонитор» - программа, осуществляющая управление данными, контроль за ходом измерения и получения результатов анализа.
«БакЭвал» - программа для дальнейшей работы с результатами измерения.
1. В основном меню программы «БакМонитор» выбрать меню «Установка/Установка температуры и интервала» и установить следующие параметры измерения:
|
Температура измерения |
|
|
Интервал |
10 мин (20 мин) |
2. В основном меню программы «БакМонитор» выбрать меню «Настройка/Данные о пользователе» и ввести информацию.
3. В основном меню программы «БакМонитор» выбрать меню «Вид/Установка параметров измерения». Для создания и сохранения параметров измерения выбрать меню «Анализ/Создать новый» и ввести следующие параметры измерения:
|
Название |
Вид продукции или определяемого показателя |
|
Комментарий |
|
|
Температура |
|
|
Время нагрева |
1 ч |
|
Время исследования |
|
|
Тип оценки |
Установить параметры для учета результатов - «Порог М» и/или «Порог Е» |
|
Пороговые значения |
Ввести пороговые значения для М-параметра и Е-параметра |
|
Временные интервалы |
Ввести пороговые значения по времени - «Интервал 1» и «Интервал 2» |
|
Калибровочный файл |
В случае использования калибровочного файла при проведении анализа ввести название соответствующего файла |
Сохранить введенные параметры измерения. Созданный список исследований использовать в дальнейшем для задания параметров измерений.
4. Выбрать в основном меню программы подменю «Начало измерений».
5. После того как каждая позиция блока будет отмаркирована как свободная на экране монитора, установить для каждой позиции параметры измерения (нажав на F6 или выбрав окно «Установка параметров измерения», выбрать соответствующий анализ из списка исследований, имя пользователя) и поместить измерительные ячейки в инкубаторный блок. Измерение начнется автоматически через 1 ч после загрузки ячеек в прибор.
6. При пересечении заданных пороговых значений для М-параметра или Е-параметра проба оценивается по светофорной системе - красному, желтому, зеленому цветам (в случае если были заданы временные интервалы) и/или происходит автоматический подсчет микроорганизмов в исследуемом образце (в случае использования калибровочного файла).
Посредством клавиш F5, F6 и F7 можно изменить тип индикации и получить полную информацию на каждое измерительное место.
Подробное описание программы и порядок действий при работе на приборе представлены в инструкции для пользователя.
5.3. Установка параметров измерения при работе
на приборе «БиоТрак 4250»
1. Программное обеспечение для работы на микробиологическом анализаторе «БиоТрак 4250» состоит из двух частей:
«МикроТрак» - программа, осуществляющая управление данными, контроль за ходом измерения и получения результатов анализа.
«МикроАссист» - программа для дальнейшей работы с результатами измерения.
2. В основном меню программы «МикроТрак» установить температуру измерения.
3. В основном меню программы «МикроТрак» выбрать меню «Настройка/Интервал измерений» и установить интервал измерений:
|
Интервал |
10 мин (20 мин) |
4. В основном меню программы МикроТрак выбрать меню «Настройка/Данные о пользователе» и ввести информацию о пользователе.
5. В основном меню программы МикроТрак выбрать меню «Вид/Установка параметров измерения». Для создания и сохранения параметров измерения выбрать меню «Анализ/Создать новый» и ввести следующие параметры измерения:
|
Название |
Вид продукции или определяемого показателя |
|
Комментарий |
|
|
Температура |
|
|
Время нагрева |
1 ч |
|
Время исследования |
|
|
Тип оценки |
Установить параметры для учета результатов - «Порог М» |
|
Пороговые значения |
Ввести пороговые значения для М-параметра |
|
Временные интервалы |
Ввести пороговые значения по времени - «Интервал 1» и «Интервал 2» |
|
Калибровочный файл |
В случае использования калибровочного файла при проведении анализа ввести название соответствующего файла |
Сохранить введенные параметры измерения.
Созданный список исследований использовать в дальнейшем для задания параметров измерений.
6. После того как каждая позиция блока будет отмаркирована как свободная на экране монитора, установить для каждой позиции параметры измерения (нажав на F6 или выбрав окно «Установка параметров измерения», выбрать соответствующий анализ из списка исследований, имя пользователя) и поместить измерительные ячейки в инкубаторный блок.
Измерение начнется автоматически через 1 ч после загрузки ячеек в прибор.
7. При пересечении заданных пороговых значений для М-параметра происходит автоматический подсчет микроорганизмов в исследуемом образце (в случае использования калибровочного файла).
Посредством клавиш F5, F6 и F7 можно изменить тип индикации и получить полную информацию на каждое измерительное место.
Подробное описание программы и порядок действий при работе на приборе представлены в инструкции для пользователя.
6.
Методики определения санитарно-показательных,
условно-патогенных и патогенных микроорганизмов
6.1. Определение мезофильных аэробных и
факультативных
анаэробных микроорганизмов (КМАФАнМ)
1. Среда:
ВiMedia 001В (готовится в соответствии с инструкцией фирмы-изготовителя).
2. Установить температуру 30 °С на приборе «БакТрак».
3. В основном меню программы прибора установить следующие параметры для инкубаторного блока:
|
Время исследования |
24 ч |
|
Масштаб измерений: |
|
|
М-параметр |
- 5 - 50 % |
|
Е-параметр |
- 5 - 50 % |
|
Время нагрева |
1 ч |
|
Пороговые значения: |
|
|
М-параметр |
5 % |
|
Е-параметр |
10 % |
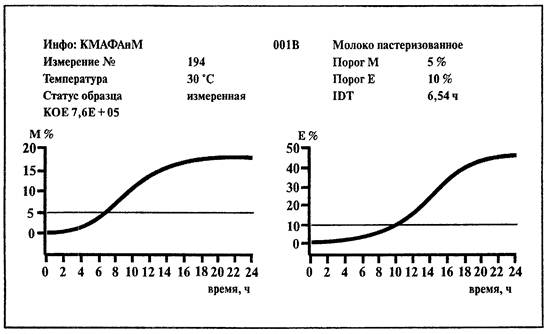
Учет результатов проводится по М-параметру.
При наличии калибровочного файла для исследуемого вида продукции параметры пороговых значений вносятся автоматически.
4. Внести в каждую измерительную ячейку по 9 мл среды.
5. Внести 1 мл предварительно подготовленного образца в соответствии с требованиями нормативной документации в измерительную ячейку с 9 мл среды (жидкие образцы могут быть внесены без разведений).
6. Тщательно перемешать содержимое ячейки, вращая ее между ладонями (не переворачивать ячейку!).
7. Для контроля питательной среды используйте одну измерительную ячейку с 10 мл питательной среды (без инокулята).
8. Выбрать в основном меню программы «Начало измерений» и начать измерение.
9. После того как каждая позиция инкубаторного блока будет отмаркирована как свободная на экране монитора, поместить измерительные ячейки в прибор.
Измерение начнется автоматически через 1 ч после загрузки ячеек в прибор.
Рост микроорганизмов и время определения изменения импеданса (IDT) будут записаны автоматически.
При пересечении порогового значения происходит автоматический подсчет численности микроорганизмов в исследуемом образце (при наличии калибровочного файла).
Учет результатов.
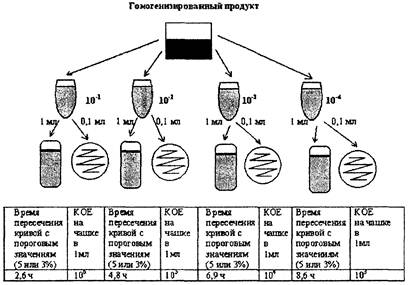
Результат определения КОЕ выдается автоматически в виде количества микроорганизмов в 1 мл исследуемого образца.
Если исследуется твердый продукт, то результат определения КОЕ необходимо умножить на степень разведения (×10) для получения значения КОЕ в 1 г исследуемого образца.
Примечание.
При исследовании образцов, содержащих консерванты, в питательную среду следует добавить Supplement I или инактивационную смесь следующего состава (г/л):
Твин-80 - 30,0 г;
лецитин - 3,0 г;
L-гистидин НСl - 1,0 г;
Na2S2O3⋅5Н2О - 5,0 г;
пептон - 1,0 г (соотношение «образец:раствор» - 1:10).
Основные этапы создания калибровочного файла рассмотрены в гл. 6 данных методических указаний.
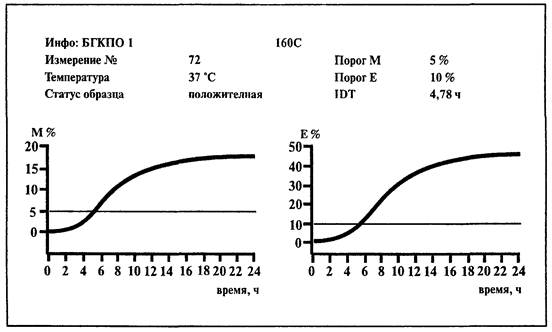
6.2. Определение колиформных бактерий
1. Среда:
BiMedia 160С (готовится в соответствии с инструкцией фирмы-изготовителя).
2. Установить температуру 37 °С на приборе «БакТрак».
3. В основном меню программы прибора установить следующие параметры для инкубаторного блока:
|
Время исследования |
24 ч |
|
Масштаб измерений: |
|
|
М-параметр |
- 5 - 50 % |
|
Е-параметр |
- 5 - 50 % |
|
Время нагрева |
1 ч |
|
Пороговые значения: |
|
|
М-параметр |
5 % |
|
Е-параметр |
10 % |
|
Временные интервалы: |
|
|
Интервал 1 |
12 ч |
|
Интервал 2 |
18 ч |
Проводить учет результатов по М-параметру.
4. Добавить в каждую измерительную ячейку по 9 мл среды BiMedia 160С.
5. Внести исследуемый образец из соответствующего разведения, в котором не допускается наличие колиформных бактерий, в объеме 1 мл.
6. При определении колиформных бактерий в 1 г продукта приготовить суспензию из 20 г продукта и 80 мл физраствора или пептонной воды. Внести в ячейку 5 мл среды 160С двойной концентрации и 5 мл ранее приготовленной суспензии анализируемого продукта.
7. Тщательно перемешать содержимое ячейки, вращая ее между ладонями (не переворачивать ячейку!).
8. Для контроля среды используйте одну измерительную ячейку с 10 мл питательной среды (без инокулята).
9. Выбрать в основном меню программы «Начало измерений» и начать измерения.
10. После того как каждая позиция в блоке будет отмаркирована как свободная на экране монитора, поместить измерительные ячейки в инкубаторный блок прибора.
Измерение начнется автоматически через 1 ч после загрузки ячеек в прибор. Рост микроорганизмов и время определения изменения импеданса (IDT) будут записаны автоматически.
Учет результатов.
Исследуемое количество пробы содержит единичные клетки колиформных бактерий и проба считается контаминированной, если изменение импеданса превышает 5 %-е пороговое значение по М-параметру и 10 %-е - по Е-параметру в течение 12 ч.
При положительном результате наблюдается изменение исходного пурпурного цвета среды на желтый, а также ее помутнение.
Примечание.
Если клетки колиформных бактерий находились в стрессовом состоянии (термическая обработка, замораживание, высушивание, влияние ингибиторов и т.д.), то может наблюдаться более медленный рост культуры с увеличением времени определения по М-параметру до 18 ч.
Если изменение импеданса превышает 5 %-е пороговое значение по М-параметру и 10 %-е - по Е-параметру в течение 18 ч, проба считается контаминированной.
При анализе кисло-молочных продуктов необходимо провести урегулирование pH, т.к. возможно получение ложноположительных результатов при низком значение pH.
При необходимости определения Е. coli в пробах, давших положительный результат, ставятся тесты с бета-глюкоронидазой и/или индольный тест непосредственно в измерительной ячейке, также возможен высев на чашки Петри со средой Эндо.
6.3. Определение колиформных бактерий в воде
1. Среда:
BiMedia 165А (готовится в соответствии с инструкцией фирмы-изготовителя).
2. Установить температуру 32 °С на приборе «БакТрак».
3. В основном меню программы прибора установить следующие параметры для инкубаторного блока:
|
Время исследования |
24 ч |
|
Масштаб измерений: |
|
|
М-параметр |
- 5 - 30 % |
|
Е-параметр |
- 5 - 50 % |
|
Время нагрева |
1 ч |
|
Пороговые значения: |
|
|
М-параметр |
3 % |
|
Е-параметр |
10 % |
|
Временной интервал: |
|
|
Интервал 1 |
18 ч |
Проводить учет результатов по М-параметру.
4. Добавить в каждую измерительную ячейку по 9 мл среды BiMedia 165А.
5. Внести исследуемый образец в объеме 1 мл.
6. Тщательно перемешать содержимое ячейки, вращая ее между ладонями (не переворачивать ячейку!).
7. Для контроля среды используйте одну измерительную ячейку с 10 мл питательной среды (без инокулята).
8. Выбрать в основном меню программы «Начало измерений» и начать измерения.
9. После того как каждая позиция в блоке будет отмаркирована как свободная на экране монитора, поместить измерительные ячейки в инкубаторный блок прибора.
Измерение начнется автоматически через 1 ч после загрузки ячеек в прибор. Рост микроорганизмов и время определения изменения импеданса (IDT) будут записаны автоматически.
Учет результатов.
Исследуемое количество пробы содержит единичные клетки колиформных бактерий и проба считается контаминированной, если изменение импеданса превышает 3 %-е пороговое значение по М-параметру и 10 %-е - по Е-параметру в течение 18 ч.
При положительном результате наблюдается изменение исходного пурпурного цвета среды на желтый, а также ее помутнение.
Примечание.
При анализе фекальных колиформных бактерий в воде, необходимо увеличить температуру до 44 °С.
При необходимости определения Е. coli в пробах, давших положительный результат, ставятся тесты с бета-глюкоронидазой и/или индольный тест непосредственно в измерительной ячейке, также возможен высев на чашки Петри со средой Эндо.
6.4. Определение Е. coli
1. Среда:
BiMedia 150В (готовится в соответствии с инструкцией фирмы-изготовителя).
2. Установить температуру 40 °С на приборе «БакТрак».
3. В основном меню программы прибора установить следующие параметры для инкубаторного блока:
|
Время исследования |
12 ч |
|
Масштаб измерений: |
|
|
М-параметр |
- 5 - 20 % |
|
Е-параметр |
- 5 - 50 % |
|
Время нагрева |
1 ч |
|
Пороговые значения: |
|
|
М-параметр |
5 % |
|
Е-параметр |
15 % |
|
Временной интервал: |
|
|
Интервал 1 |
12 ч |
Проводить учет результатов по М-параметру.
4. Добавить в каждую измерительную ячейку по 9 мл среды BiMedia 150В.
5. Внести исследуемый образец из соответствующего разведения, в котором не допускается наличие Е. coli, в объеме 1 мл.
6. Тщательно перемешать содержимое ячейки, вращая ее между ладонями (не переворачивать ячейку!).
7. Для контроля среды используйте одну измерительную ячейку с 10 мл питательной среды (без инокулята).
8. Выбрать в основном меню программы «Начало измерений» и начать измерения.
После того как каждая позиция в блоке будет отмаркирована как свободная на экране монитора, поместить ячейки в прибор.
Измерение начнется автоматически через 1 ч после загрузки ячеек в прибор. Рост микроорганизмов и время определения изменения импеданса (IDT) будут записаны автоматически.
Учет результатов.
Исследуемое количество пробы содержит клетки Е. coli и проба считается контаминированной, если изменение импеданса превышает 5 %-е пороговое значение по М-параметру и 15 %-е - по Е-параметру в течение 12 ч.
6.5. Определение энтеробактерий
1. Среда:
BiMedia 140А (готовится в соответствии с инструкцией фирмы-изготовителя).
2. Установить температуру 37 °С на приборе «БакТрак».
3. В основном меню программы прибора установить следующие параметры для инкубаторного блока:
|
Время исследования |
12 ч |
|
Масштаб измерений: |
|
|
М-параметр |
- 5 - 30 % |
|
Е-параметр |
- 5 - 50 % |
|
Время нагрева |
1 ч |
|
Пороговые значения: |
|
|
М-параметр |
5 % |
|
Е-параметр |
не учитывается |
|
Временной интервал: |
|
|
Интервал 1 |
12 ч |
Проводить учет результатов по М-параметру.
4. Добавить в каждую измерительную ячейку по 9 мл среды BiMedia 140А.
5. Внести исследуемый образец из соответствующего разведения, в котором не допускается наличие Энтеробактерий, в объеме 1 мл.
6. Тщательно перемешать содержимое ячейки, вращая ее между ладонями (не переворачивать ячейку!).
7. Для контроля среды используйте одну измерительную ячейку с 10 мл питательной среды (без инокулята).
8. Выбрать в основном меню программы «Начало измерений» и начать измерения.
9. После того как каждая позиция в блоке будет отмаркирована как свободная на экране монитора, поместить ячейки в измерительный блок прибора.
Измерение начнется автоматически через 1 ч после загрузки ячеек в прибор. Рост микроорганизмов и время определения изменения импеданса (IDT) будут записаны автоматически.
Учет результатов.
Исследуемое количество пробы содержит клетки энтеробактерий и проба считается контаминированной, если изменение импеданса превышает 5 %-е пороговое значение по М-параметру в течение 12 ч.
6.6. Определение Pseudomonas
1. Среда:
BiMedia 130А (готовится в соответствии с инструкцией фирмы-изготовителя).
2. Установить температуру 30 °С на приборе «БакТрак».
3. В основном меню программы прибора установить следующие параметры для инкубаторного блока:
|
Время исследования |
48 ч |
|
Масштаб измерений: |
|
|
М-параметр |
- 5 - 30 % |
|
Е-параметр |
- 5 - 50 % |
|
Время нагрева: |
1 ч |
|
Пороговые значения: |
|
|
М-параметр |
5 % |
|
Е-параметр |
не учитывается |
|
Временной интервал: |
|
|
Интервал 1 |
40 ч |
Проводить учет результатов по М-параметру.
4. Добавить в каждую измерительную ячейку по 9 мл среды BiMedia 130А.
Внести исследуемый образец из соответствующего разведения, в котором не допускается наличие Pseudomonas в объеме 1 мл.
5. Тщательно перемешать содержимое ячейки, вращая ее между ладонями (не переворачивать ячейку!).
Для контроля среды используйте одну измерительную ячейку с 10 мл питательной среды (без инокулята).
6. Выбрать в основном меню программы «Начало измерений» и начать измерения.
После того как каждая позиция в блоке будет отмаркирована как свободная на экране монитора, поместить ячейки в измерительный блок прибора.
7. Измерение начнется автоматически через 1 ч после загрузки ячеек в прибор. Рост микроорганизмов и время определения изменения импеданса (IDT) будут записаны автоматически.
Учет результатов.
Исследуемое количество пробы содержит клетки Pseudomonas и проба считается контаминированной, если изменение импеданса превышает 5 %-е пороговое значение по М-параметру в течение 40 ч.
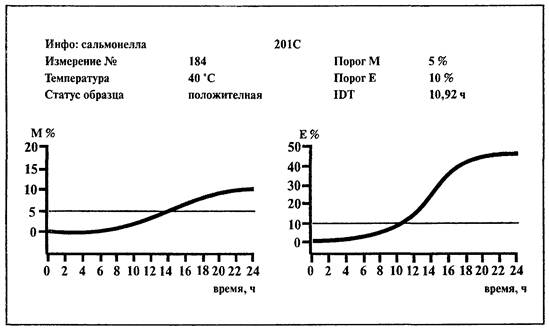
6.7. Определение сальмонелл
1. Среды:
BiMedia 201C (модифицированная среда Раппапорта-Вассилиадиса).
BiMedia 205А (модифицированная селенитовая среда).
Среды готовятся в соответствии с инструкцией фирмы-изготовителя. В соответствие с ГОСТ Р 52814-2007 и ИСО 6579:2002 для определения Salmonella необходимо параллельно использовать две среды BiMedia 201C и BiMedia 205С.
2. Стадия предобогащения.
Гомогенизировать необходимое количество исследуемой пробы (в которой НТД регламентируется отсутствие сальмонелл) и развести стерильной 1 % пептонной водой в соотношении 1:10.
Тщательно перемешать. Инкубировать в течение 16 - 18 ч при температуре 37 °С. Период предварительной инкубации для мясных, рыбных и молочных продуктов составляет 6 - 8 ч при 37 °С.
6.7.1. Определение сальмонелл на среде BiMedia 201С
1. Установить температуру 41,5 °С на приборе «БакТрак».
2. В основном меню программы прибора установить следующие параметры для инкубаторного блока:
|
Время исследования |
24 ч |
|
Масштаб измерений: |
|
|
М-параметр |
- 2 - 10% |
|
Е-параметр |
- 5 - 80 % |
|
Время нагрева |
1 ч |
|
Пороговые значения: |
|
|
М-параметр |
3 % |
|
Е-параметр |
10 % |
|
Временной интервал: |
|
|
Интервал 1 |
23 ч |
Проводить учет результатов по Е-параметру.
3. Добавить в каждую измерительную ячейку по 10 мл среды BiMedia 201С.
4. Внести по 0,1 мл предобогащенного образца в каждую измерительную ячейку; тщательно перемешать содержимое, вращая ячейку между ладонями (не переворачивать ячейку!).
5. Выбрать в основном меню программы прибора «Начало измерений» и начать измерение.
6. После того как каждая позиция в блоке будет отмаркирована как свободная на экране монитора, поместить измерительные ячейки в измерительный блок прибора.
Измерение начнется автоматически через 1 ч после загрузки ячеек в прибор.
Рост микроорганизмов и время определения изменения импеданса (IDT) будут записаны автоматически.
Учет результатов.
Образец контаминирован сальмонеллами, если измерение импеданса по Е-параметру превышает 10 %-е пороговое значение в течение 23 ч.
Подтверждение Salmonella - позитивных образцов.
В случае положительного результата на присутствие сальмонелл проводится подтверждение высевом на чашки Петри с селективными питательными средами в соответствии с требованиями нормативно-технической документации. Высев производится непосредственно из измерительной ячейки.
Примечание.
При исследовании мясных продуктов продолжительность измерения может быть сокращена до 21 ч 30 мин.
Возможно использование уже заполненных средой 201C одноразовых ячеек.
Рекомендуется использовать ячейки с зелеными крышками.
6.7.2. Определение сальмонелл на среде BiMedia 205А
1. Установить температуру 37 °С на приборе «БакТрак».
2. В основном меню программы прибора установить следующие параметры инкубаторного блока:
|
Время исследования |
24 ч |
|
Масштаб измерений: |
|
|
М-параметр |
- 5 - 30 % |
|
Е-параметр |
- 5 - 40 % |
|
Время нагрева |
1 ч |
|
Пороговые значения: |
|
|
М-параметр |
10 % |
|
Е-параметр |
не учитывается |
|
Временной интервал: |
|
|
Интервал 1 |
23 ч |
Проводить учет результатов по М-параметру.
3. Добавить в каждую измерительную ячейку по 10 мл среды BiMedia 205А.
4. Внести по 0,1 мл предобогащенного образца в ячейку; тщательно перемешать содержимое, вращая измерительную ячейку между ладонями (не переворачивая ячейку!).
5. Выбрать в основном меню программы прибора «Начало измерений» и начать измерение.
6. После того как каждая позиция в инкубаторном блоке будет отмаркирована как свободная на экране монитора, поместить измерительные ячейки в блок прибора.
Измерение начнется автоматически через 1 ч после загрузки ячеек в прибор.
Рост микроорганизмов и время определения изменения импеданса (IDT) будут записаны автоматически.
Учет результатов.
Образец контаминирован сальмонеллами, если измерение импеданса превышает 10 %-е пороговое значение по М-параметру в течение 23 ч.
Подтверждение Salmonella - позитивных образцов.
В случае положительного результата на присутствие сальмонелл проводится подтверждение с высевом на чашки Петри с селективными питательными средами в соответствии с требованиями нормативно-технической документации. Высев производится непосредственно из измерительной ячейки.
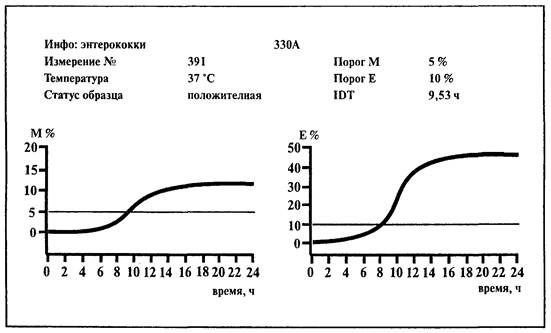
6.8. Определение энтерококков
1. Среда:
BiMedia 330А (готовится в соответствии с инструкцией фирмы-изготовителя).
2. Установить температуру 37 °С на приборе «БакТрак».
3. В основном меню программы прибора установить следующие параметры для инкубаторного блока:
|
Время исследования |
24 ч |
|
Масштаб измерений: |
|
|
М-параметр |
- 5 - 30 % |
|
Е-параметр |
- 5 - 50 % |
|
Время нагрева |
1 ч |
|
Пороговые значения: |
|
|
М-параметр |
5 % |
|
Е-параметр |
не учитывается |
|
Временной интервал: |
|
|
Интервал 1 |
23 ч |
Проводить учет результатов по М-параметру.
4. Добавить в каждую измерительную ячейку по 9 мл среды BiMedia 330А.
5. Внести по 1 мл исследуемого образца из соответствующего разведения, в котором не допускается наличие энтерококков.
6. Тщательно перемешать содержимое, вращая ячейку между ладонями (не переворачивать ячейку!).
7. Для контроля питательной среды использовать одну измерительную ячейку с 10 мл питательной среды (без инокулята).
8. Выбрать в основном меню прибора «Начало измерений» и начать измерения.
9. После того как каждая позиция в инкубаторном блоке будет отмаркирована как свободная на экране монитора, поместить измерительные ячейки в прибор.
Измерение начнется автоматически через 1 ч после загрузки ячеек в прибор. Рост микроорганизмов и время определения изменения импеданса (IDT) будут записаны автоматически.
Учет результатов.
Образец контаминирован энтерококками, если изменение импеданса превышает 5 %-е пороговое значение по М-параметру в течение 23 ч.
Примечание.
При анализе воды необходимо фильтр поместить в середину измерительной ячейки, так чтобы он был полностью покрыт средой.
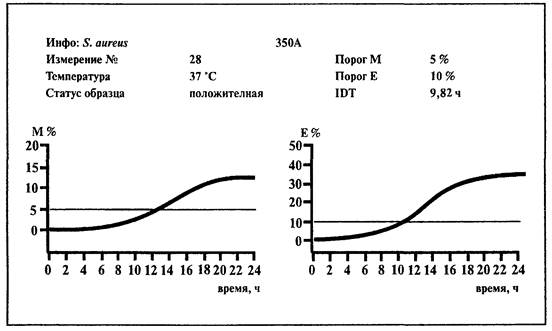
6.9. Определение Staphylococcus aureus
1. Среды:
BiMedia 350А и PreMedia 350А. Среды готовятся в соответствии с инструкцией фирмы-изготовителя.
2. Подготовка образца.
Смешать 10 г исследуемого образца со стерильной дистиллированной водой в соотношении 1:10, тщательно гомогенизировать.
3. Предварительное обогащение.
Добавить необходимое количество суспензии исследуемого образца, в котором регламентируется отсутствие Staphylococcus aureus (например, 10 мл суспензии, если Staphylococcus aureus определяется в 1 г, и 1 мл суспензии, если Staphylococcus aureus определяется в 0,1 г, к 90 мл или 9 мл среды PreMedia 350А соответственно). Инкубировать в течение 24 ч при температуре 37 °С.
Установить температуру 37 °С на приборе «БакТрак».
4. В основном меню программы прибора установить следующие параметры для инкубаторного блока:
|
Время исследования |
24 ч |
|
Масштаб измерений: |
|
|
М-параметр |
- 5 - 30 % |
|
Е-параметр |
- 5 - 80 % |
|
Время нагрева |
1 ч |
|
Пороговые значения: |
|
|
М-параметр |
не учитывается |
|
Е-параметр |
10 % |
|
Временной интервал: |
|
|
Интервал 1 |
23 ч |
Проводить учет результатов по Е-параметру.
5. Внести в каждую измерительную ячейку по 10 мл среды BiMedia 350А.
6. Добавить 0,1 мл предобогащенного образца в каждую ячейку; тщательно перемешать содержимое, вращая ячейку между ладонями (не переворачивая ячейку!).
7. Для контроля среды используйте одну измерительную ячейку с 10 мл питательной среды (без инокулята).
8. Выбрать в основном меню программы прибора «Начало измерений» и начать измерение.
9. После того как каждая позиция в блоке будет отмаркирована как свободная на экране монитора, поместить измерительные ячейки в измерительный блок прибора.
Примечание.
Время между внесением предобогащенных образцов в ячейки и загрузкой измерительных ячеек в инкубаторный блок не должно превышать 15 мин. В случае превышения данного интервала времени могут быть получены ложные результаты!
Измерение начнется автоматически через 1 ч после загрузки ячеек в прибор.
Рост микроорганизмов и время определения изменения импеданса (IDT) будут записаны автоматически.
Учет результатов.
Образец контаминирован Staphylococcus aureus, если измерение импеданса превышает 10 %-е пороговое значение по Е-параметру в течение 23 ч.
В случае положительного результата проводится подтверждение с высевом на чашки Петри с селективными питательными средами и постановкой идентификационных тестов в соответствии с регламентируемыми НТД.
Высев проводится непосредственно из измерительной ячейки.
6.10. Определение листерий
1. Среды:
Для предобогащения возможно использовать FDA бульон или UVM среду.
BiMedia 401А (селективная среда для Listeria).
Среды готовятся в соответствии с инструкцией фирм-изготовителей.
2. Предварительное обогащение.
Гомогенизировать необходимое количество исследуемой пробы (в котором регламентируется отсутствие листерий) и смешать его в соотношении 1:10 с FDA или ПБЛ бульоном.
3. Инкубировать образец в течение 24 ч при температуре 30 °С.
Установить температуру 37 °С на приборе «БакТрак».
4. В основном меню программы прибора установить следующие параметры:
|
Время исследования |
40 ч |
|
Масштаб измерений: |
|
|
М-параметр |
- 5 - 20 % |
|
Е-параметр |
- 5 - 80 % |
|
Время нагрева |
1 ч |
|
Пороговые значения: |
|
|
М-параметр |
не учитывается |
|
Е-параметр |
15 % |
|
Временной интервал: |
|
|
Интервал 1 |
36 ч |
Проводить учет результатов по Е-параметру.
5. Внести в каждую измерительную ячейку по 10 мл питательной среды BiMedia 401A.
6. Добавить в каждую ячейку по 0,1 мл предобогащенного образца; тщательно перемешать содержимое, вращая ячейку между ладонями (не переворачивать ячейку!).
7. Для контроля среды используйте одну измерительную ячейку с 10 мл питательной среды (без инокулята).
8. Выбрать в основном меню программы прибора «Начало измерений» и начать измерения.
9. После того как каждая позиция в блоке будет отмаркирована как свободная на экране монитора, поместить измерительные ячейки в инкубаторный блок прибора.
Измерение начнется автоматически через 1 ч после загрузки ячеек в прибор.
Рост микроорганизмов и время определения изменения импеданса (IDT) будут записаны автоматически.
Учет результатов.
Образец контаминирован листериями, если измерение импеданса превышает 15 %-е пороговое значение по Е-параметру в течение 36 ч.
В случае положительного результата производится подтверждение с высевом на чашки Петри с селективными питательными средами в соответствии с требованиями НТД. Высев производится непосредственно из измерительной ячейки.
6.11. Определение микроорганизмов
методом измерения «непрямого» импеданса
Измерительная система микробиологических экспресс-анализаторов серии «БакТрак 4000» способна использовать «метод непрямого импеданса» как альтернативу прямому измерению импеданса.
Измерение непрямого импеданса основывается на мониторинге образования СO2 как показателя микробного роста по поглощению метаболического СO2 раствором КОН:
|
СO2 + 2OН- = СО32- + Н2O, |
таким образом регистрируя количество СO2, продуцируемого микроорганизмами. Химическая реакция между СO2 и КОН вызывает снижение М-параметра, степень которого зависит от количества СO2, произведенного присутствующими в исследуемом образце микроорганизмами. Это снижение позволяет проводить количественную оценку образцов, контаминированных СO2 продуцирующими микроорганизмами.
Наиболее значительным преимуществом непрямой кондуктометрии над прямой является ее большая чувствительность, выражающаяся в низких значениях IDT и в более высокой скорости изменения проводимости. С помощью прямого метода можно определять бактериальные популяции с титром около 106 - 107 КОЕ/мл и популяции дрожжей с титром 105 - 106 КОЕ/мл. При использовании непрямого метода порог чувствительности составляет 104 - 105 клеток дрожжей.
Непрямое измерение импеданса предпочтительнее для определения дрожжей и плесеней, которые вызывают небольшие изменения проводимости большинства используемых сред.
Кроме того, этот метод имеет такое преимущество над обычной (прямой) кондуктометрией как сильное усиление электрического сигнала.
Характер тестируемой пробы может в некоторых случаях создавать проблемы для измерения прямого импеданса, а при использовании непрямого метода есть возможность применять питательные среды, не оптимизированные для электрического ответа и ранее рассматриваемые как неподходящие для измерения импеданса.
Преимущества непрямой кондуктометрии над прямой:
- использование обычных питательных сред;
- возможность использования сред с высокой концентрацией солей, т.к. измерительные электроды не контактируют с питательной средой;
- определение микроорганизмов, вызывающих небольшие или неопределяемые изменения проводимости при использовании прямого метода измерения импеданса;
- использование для тестирования исследуемых образцов, которые могут физически взаимодействовать с электродами в случае использования прямого метода измерения импеданса.
6.12. Определение дрожжей и плесневых грибов
Определение дрожжей и плесневых грибов основано на использовании непрямого метода определения импеданса питательной среды.
Для данного метода используются измерительные ячейки:
- измерительные неавтоклавируемые КОН-ячейки объемом 20 мл (стойкие к воздействию щелочи);
- одноразовые пластиковые неавтоклавируемые пробирки для исследуемых образцов объемом 7 мл.
1. Среда:
BiMedia 501В (готовится в соответствии с инструкцией фирмы-изготовителя).
2. Установить температуру 30 °С на приборе «БакТрак».
3. В основном меню программы прибора установить следующие параметры для инкубаторного блока:
|
Время исследования |
48 ч |
|
Масштаб измерений: |
|
|
М-параметр |
- 150 - 5 % |
|
Е-параметр |
- 150 - 5 % |
|
Время нагрева |
1 ч |
|
Пороговые значения: |
|
|
М-параметр |
- 25 % |
|
Е-параметр |
не учитывается |
|
Временной интервал: |
|
|
Интервал 1 |
48 ч |
Проводить учет результатов по М-параметру
При наличии калибровочного файла для исследуемого вида продукции параметр порогового значения вносится автоматически.
4. В измерительную КОН-ячейку внести 1 мл 0,2 %-го раствора КОН. Раствор КОН должен храниться тщательно закрытым в холодильнике. Срок хранения раствора КОН - 1 неделя.
5. Внести 5 мл среды BiMedia 501В в одноразовую пластиковую пробирку. Добавить 1 мл предварительно подготовленного в соответствии с требованиями нормативной документации исследуемого образца в пробирку с питательной средой.
Пробирку необходимо оставить открытой для того, чтобы создать возможность для выхода СO2 при его образовании и повышении давления в пробирке.
Для контроля среды используйте одну пробирку с питательной средой без инокулята.
6. Поместить внутреннюю пробирку в КОН-ячейку между электродами.
Тщательно закрыть КОН-ячейку.
7. Выбрать в основном меню программы прибора «Начало измерений» и начать измерение. После того, как каждая позиция в блоке будет отмаркирована как свободная на экране монитора, поместить измерительные ячейки в инкубаторный блок прибора.
Рост микроорганизмов и время определения изменения импеданса (IDT) будут записаны автоматически.
При наличии калибровочного файла происходит автоматический подсчет дрожжей и плесневых грибов в исследуемом образце при пересечении порогового значения.
Учет результатов.
Результат определения КОЕ выдается автоматически в виде количества микроорганизмов в 1 мл исследуемого образца.
Если исследуется твердый продукт, то результат определения КОЕ необходимо умножить на степень разведения (×10) для получения значения КОЕ в 1 г исследуемого образца.
Примечание.
При использовании ячеек с двумя электродами необходимо внести дополнительные установки. Для этого открыть окно «Установка параметров измерений» в графе «Тип оценки» выбрать измерение М2 (Cells with 2 pins).
6.13. Определение лактобацилл
1. Среда:
BiMedia 630А (готовится в соответствии с инструкцией фирмы-изготовителя).
2. Установить температуру 37 °С на приборе «БакТрак».
3. В основном меню программы прибора установить следующие параметры для инкубаторного блока:
|
Время исследования |
24 ч |
|
Масштаб измерений: |
|
|
М-параметр |
- 5 - 30 % |
|
Е-параметр |
- 5 - 60 % |
|
Время нагрева |
1 ч |
|
Пороговые значения: |
|
|
М-параметр |
5 % |
|
Е-параметр |
10 % |
|
Временной интервал: |
|
|
Интервал 1 |
23 ч |
Проводить учет результатов по М-параметру и Е-параметру.
4. Внести в каждую измерительную ячейку по 9 мл питательной среды BiMedia 630А.
5. Добавить в каждую ячейку исследуемый образец из соответствующего разведения продукта, в котором не допускается наличие лактобацилл. Тщательно перемешать содержимое, вращая ячейку между ладонями (не переворачивать ячейку!).
6. Для контроля среды используйте одну измерительную ячейку с 10 мл выбранной для исследования среды (без инокулята).
7. Выбрать в основном меню программы прибора «Начало измерений» и начать измерения. После того, как каждая позиция в блоке будет отмаркирована как свободная на экране монитора, поместить измерительные ячейки в инкубаторный блок прибора.
Измерение начнется автоматически через 1 ч после загрузки ячеек в прибор.
Рост микроорганизмов и время определения изменения импеданса (IDT) будут записаны автоматически.
Учет результатов.
Образец контаминирован лактобациллами, если измерение импеданса превышает 5 %-е пороговое значение по М-параметру и 10 %-е - по Е-параметру в течение 23 ч.
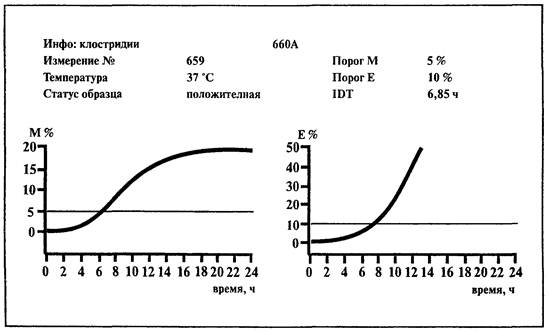
6.14. Определение сульфитредуцирующих клостридий
1. Среда:
BiMedia 660А(готовится в соответствии с инструкцией фирмы-изготовителя).
2. Установить температуру 37 °С на приборе «БакТрак».
3. В основном меню программы прибора установить следующие параметры для инкубаторного блока:
|
Время исследования |
24 ч |
|
Масштаб измерений: |
|
|
М-параметр |
- 5 - 40 % |
|
Е-параметр |
- 5 - 80 % |
|
Время нагрева |
1 ч |
|
Пороговые значения: |
|
|
М-параметр |
5 % |
|
Е-параметр |
10 % |
|
Временной интервал: |
|
|
Интервал 1 |
23 ч |
Проводить учет результатов по M-параметру и Е-параметру.
4. Определение сульфитредуцирующих клостридий необходимо проводить, используя измерительные ячейки для анаэробов.
5. Внести в каждую измерительную ячейку по 9 мл среды BiMedia 660А и автоклавировать ячейки с внесенной в них питательной средой (крышки должны быть приоткрыты!).
6. Приготовить соответствующие разведения исследуемого образца, в котором не допускается наличие сульфитредуцирующих клостридий.
7. Добавить 1 мл исследуемой пробы в измерительные ячейки сразу после автоклавирования, не дожидаясь снижения температуры (около 85 °С).
8. Добавить по 30,0 мкл раствора аддитива в каждую измерительную ячейку с 9 мл среды непосредственно перед использованием (температура среды должна достигнуть 45 - 50 °С).
9. Закрыть измерительные ячейки крышками. Тщательно перемешать содержимое, вращая ячейку между ладонями (не переворачивать ячейку!).
Для контроля среды используйте одну измерительную ячейку с 10 мл питательной среды (без инокулята).
10. Выбрать в основном меню программы прибора «Начало измерений» и начать измерения.
11. После того как каждая позиция в блоке будет отмаркирована как свободная на экране монитора, поместить измерительные ячейки в инкубаторный блок прибора.
Измерение начнется автоматически через 1 ч после загрузки ячеек в прибор.
Рост микроорганизмов и время определения изменения импеданса (IDT) будут записаны автоматически.
Учет результатов.
Образец контаминирован сульфитредуцирующими клостридиями, если измерение импеданса превышает 5 %-е пороговое значение по М-параметру и 10 %-е - по Е-параметру в течение 23 ч.
На стенках измерительной ячейки обнаруживается выпавший осадок черного цвета.
6.15. Определение Clostridium perfringes
1. Среда:
BiMedia 660А (готовится в соответствии с инструкцией фирмы-изготовителя).
2. Установить температуру 44 °С на приборе «БакТрак».
3. В основном меню программы прибора установить следующие параметры для инкубаторного блока:
|
Время исследования |
24 ч |
|
Масштаб измерений: |
|
|
М-параметр |
- 5 - 30 % |
|
Е-параметр |
- 5 - 80 % |
|
Время нагрева |
1 ч |
|
Пороговые значения: |
|
|
М-параметр |
5 % |
|
Е-параметр |
10 % |
|
Временной интервал: |
|
|
Интервал 1 |
23 ч |
Проводить учет результатов по М-параметру и Е-параметру.
Определение Clostridium petfringes необходимо проводить, используя измерительные ячейки для анаэробов.
4. Внести в каждую измерительную ячейку по 9 мл среды BiMedia 660А и автоклавировать ячейки с внесенной в них питательной средой (крышки должны быть приоткрыты!).
5. Приготовить соответствующие разведения исследуемого образца, в котором не допускается наличие Clostridium petfringes.
6. Добавить 1 мл исследуемой пробы в измерительные ячейки после автоклавирования, когда температура среды достигнет 45 - 50 °С.
7. Добавить в каждую измерительную ячейку 50 мкл раствора циклосерина (60 мг/мл) и 50 мкл раствора Na2N3 (10 мг/мл).
8. Закрыть измерительные ячейки крышками.
9. Тщательно перемешать содержимое, вращая ячейку между ладонями (не переворачивать ячейку!).
Для контроля среды используйте одну измерительную ячейку с 10 мл питательной среды (без инокулята).
10. Выбрать в основном меню программы прибора «Начало измерений» и начать измерения.
После того как каждая позиция в блоке будет отмаркирована как свободная на экране монитора, поместить измерительные ячейки в инкубаторный блок прибора.
Измерение начнется автоматически через 1 ч после загрузки ячеек в прибор.
Рост микроорганизмов и время определения изменения импеданса (IDT) будут записаны автоматически.
Учет результатов.
Образец контаминирован Clostridium petfringes, если измерение импеданса превышает 5 %-е пороговое значение по М-параметру и 10 %-е - по Е-параметру в течение 23 ч.
6.16. Определение Bacillus cereus
1. Среда:
BiMedia 610А (готовится в соответствии с инструкцией фирмы-изготовителя).
2. Установить температуру 30 °С на приборе «БакТрак».
3. В основном меню программы прибора установить следующие параметры для инкубаторного блока:
|
Время исследования |
24 ч |
|
Масштаб измерений: |
|
|
М-параметр |
- 5 - 30 % |
|
Е-параметр |
- 5 - 50 % |
|
Время нагрева |
1 ч |
|
Пороговые значения: |
|
|
М-параметр |
5 % |
|
Е-параметр |
10 % |
|
Временной интервал: |
|
|
Интервал 1 |
23 ч |
Проводить учет результатов по М-параметру.
4. Внести в каждую измерительную ячейку по 9 мл среды BiMedia 610A.
5. Добавить 1 мл исследуемой пробы из соответствующего разведения, в котором не допускается наличие Bacillus cereus.
6. Тщательно перемешать содержимое ячейки, вращая ее между ладонями (не переворачивать ячейку!).
7. Для контроля питательной среды использовать одну измерительную ячейку с 10 мл питательной среды (без инокулята).
8. Выбрать в основном меню программы прибора «Начало измерений» и начать измерения.
9. После того как каждая позиция в блоке будет отмаркирована как свободная на экране монитора, поместить измерительные ячейки в инкубаторный блок прибора.
Измерение начнется автоматически через 1 ч после загрузки ячеек в прибор.
Рост микроорганизмов и время определения изменения импеданса (IDT) будут записаны автоматически.
Учет результатов.
Исследуемый образец контаминирован Bacillus cereus, если измерение импеданса превышает 5 %-е пороговое значение по М-параметру в течение 23 ч.
6.17. Определение аэробных спорообразующих бактерий
1. Среда:
BiMedia 001В.
2. Установить температуру на приборе «БакТрак»: 10 - 20 °С - для психрофильных бактерий; 30 - 37 °С - для мезофильных бактерий; 55 °С - для термофильных бактерий.
3. В основном меню программы прибора установить следующие параметры для инкубаторного блока:
|
Время исследования |
24 ч для мезофильных и термофильных бактерий |
|
72 ч для психрофильных бактерий |
|
|
Масштаб измерений: |
|
|
М-параметр |
- 5 - 30 % |
|
Е-параметр |
- 5 - 80 % |
|
Время нагрева: |
1 ч |
|
Пороговые значения: |
|
|
М-параметр |
5 % |
|
Е-параметр |
10 % |
Учет результатов проводится по М-параметру.
При наличии калибровочного файла для исследуемого вида продукции параметры пороговых значений вносятся автоматически.
4. Внести в каждую измерительную ячейку по 9 мл среды.
5. В измерительную ячейку с 9 мл среды внести 1 мл предварительно подготовленного образца в соответствии с требованиями нормативной документации (рекомендуется прогревать пробы на водяной бане при 70 °С в течение 10 мин).
6. Тщательно перемешать содержимое ячейки, вращая ее между ладонями (не переворачивать ячейку!).
7. Для контроля среды используйте одну измерительную ячейку с 10 мл питательной среды (без инокулята).
8. Выбрать в основном меню программы «Начало измерений» и начать измерение.
9. После того как каждая позиция инкубаторного блока будет отмаркирована как свободная на экране монитора, поместить измерительные ячейки в прибор.
Измерение начнется автоматически через 1 ч после загрузки ячеек в прибор.
Рост микроорганизмов и время определения изменения импеданса (IDT) будут записаны автоматически.
При пересечении порогового значения происходит автоматический подсчет численности микроорганизмов в исследуемом образце (при наличии калибровочного файла).
Учет результатов.
Результат определения КОЕ выдается автоматически в виде количества микроорганизмов в 1 мл исследуемого образца.
Если исследуется твердый продукт, то результат определения КОЕ необходимо умножить на степень разведения (×10) для получения КОЕ в 1 г исследуемого образца.
Примечание.
Основные этапы создания калибровочного файла рассмотрены в гл. 7 данных методических указаний.
6.18. Определение микробного загрязнения
объектов внешней среды обитания методом смывов
1. Среды:
- BiMedia 001В (определение КМАФАнМ);
- BiMedia 140А (определение энтеробактерий);
- BiMedia 160С (определение колиформных бактерий). Питательные среды готовятся в соответствии с инструкцией фирмы-изготовителя.
2. Установить температуру на приборе «БакТрак»: 30 °С - для BiMedia 001В; 37 °С - для BiMedia 140А и BiMedia 160С.
3. В основном меню программы прибора установить следующие параметры для инкубаторного блока:
|
Время исследования |
11 ч |
|
Масштаб измерений: |
|
|
М-параметр |
- 5 - 30 % |
|
Е-параметр |
- 5 - 50 % |
|
Время нагрева: |
1 ч |
|
Пороговые значения: |
|
|
М-параметр |
5 % |
|
Е-параметр |
10 % |
|
Временной интервал: |
|
|
Интервал 1 |
11 ч |
Учет результатов производить по М- и Е-параметру
4. Внести в каждую измерительную ячейку по 9 мл питательной среды.
5. Смывы с поверхностей площадью 10×10 см проводят стерильным ватным тампоном.
6. Отрезанную стерильными ножницами верхушку ватного тампона для смывов погрузить в ячейку со средой. Тампон может касаться электродов. Это не оказывает никакого влияния на величину измеренного сигнала. Желательно, чтобы тампон был как можно меньше.
7. Тщательно перемешать содержимое ячейки, вращая ее между ладонями (не переворачивать ячейку!).
8. Для контроля питательной среды использовать одну измерительную ячейку с 10 мл используемой для посева среды (без инокулята).
9. После того как каждая позиция инкубаторного блока будет отмаркирована как свободная на экране монитора, поместить измерительные ячейки в прибор.
Измерение начнется автоматически через 1 ч после загрузки ячеек в прибор.
Рост микроорганизмов и время определения изменения импеданса (IDT) будут записаны автоматически.
Учет результатов.
- Для образцов с высокой степенью загрязнения изменение импеданса превышает 5 %-е пороговое значение по М-параметру и 10 %-е - по Е-параметру в течение 5 ч. Отсутствие значительных изменений в импедансе среды в течение 11 ч свидетельствует об отсутствии или низкой степени контаминации микроорганизмами исследуемого образца.
Примечание.
При исследовании смывов с поверхностей, подвергнутых дезинфекции, в питательную среду необходимо добавить Supplement I для инактивации ингибирующих веществ или инактивационную смесь следующего состава (г/л):
- Твин-80 - 30,0 г;
- лецитин - 3,0 г;
- L-гистидин HCl - 1,0 г;
- Na2S2O3⋅5H2О - 5,0 г;
- пептон - 1,0 г (соотношение «образец:раствор» - 1:10).
Для определения количества клеток на поверхности, необходимо использование калибровочного файла. Основные этапы создания калибровочного файла рассмотрены в гл. 7 данных указаний.
6.19. Определение общего количества ингибирующих
веществ
(в т.ч. антибиотиков) в пищевых продуктах
Импедансный метод определения общего количества ингибирующих веществ предназначен для скринингового выявления нестандартной животноводческой продукции с целью дальнейшего количественного определения антибиотиков классическим методом.
Использование импедансного метода для определения общего количества ингибирующих веществ в пищевых продуктах и производственном сырье основано на сравнении степени угнетения роста тест-культуры Streptococcus thermophylus ингибирующими веществами, содержащимися в исследуемом образце, с контрольной кривой роста.
1. Приготовление тест-культуры Streptococcus thermophylus проводится в соответствии с ГОСТ 23454-79 «Молоко. Методы определения ингибирующих веществ».
2. Подготовка проб к исследованию.
2.1. Подготовка проб к исследованию проводится по МУК 4.2.026-95 от 29.03.95 «Экспресс-метод определения антибиотиков в пищевых продуктах» (п. 3.1.1).
2.2. Определение ингибиторов проводится в объеме, регламентированном СанПиН 2.3.2.1078-01 «Гигиенические требования безопасности и пищевой ценности пищевых продуктов».
3. Среда: стерильное обезжиренное молоко, проверенное на отсутствие ингибирующих веществ.
4. Установить температуру 40 °С на приборе «БакТрак».
В основном меню программы прибора установить следующие параметры для инкубаторного блока:
|
Время исследования |
4 ч |
|
Масштаб измерений: |
|
|
М-параметр |
- 5 - 30 % |
|
Е-параметр |
- 5 - 50 % |
|
Время нагрева |
1 ч |
|
Пороговые значения: |
|
|
М-параметр |
4 % |
|
Е-параметр |
10 % |
|
Временной интервал: |
|
|
Интервал 1 |
1 ч |
Учет результатов проводится по М-параметру.
6. Внести в каждую измерительную ячейку по 9 мл стерильного обезжиренного молока.
7. Добавить 1 мл исследуемого образца из соответствующего разведения согласно нормативным документам.
Если количество ингибирующих веществ определяется в 1 г исследуемого образца, то необходимо приготовить суспензию в соотношении 1:2 (образец и физиологический раствор соответственно) и добавить в измерительную ячейку с 8 мл стерильного обезжиренного молока 2 мл приготовленной суспензии.
В контрольную ячейку вносится 2 мл физиологического раствора вместо образца.
8. Для контроля питательной среды используют одну измерительную ячейку с 9 мл стерильного обезжиренного молока (без инокулята) и 1 мл физиологического раствора.
9. Внести по 0,1 мл тест-культуры Streptococcus thermophilus в опытные и контрольные ячейки.
10. Тщательно перемешать содержимое ячейки, вращая ее между ладонями (не переворачивать ячейку!).
Рис. 1. Кривые импедансного сигнала при определении
общего количества ингибирующих веществ.
Контроль (тест-культура Streptococcus thermophylus);
молоко с 1,0 ЕД тетрациклина
11. Выбрать в основном меню программы «Начало измерений» и начать измерения.
12. После того как каждая позиция в блоке будет отмаркирована как свободная на экране монитора, поместить измерительные ячейки в инкубаторный блок прибора.
Измерение начнется автоматически через 1 ч после загрузки ячеек в прибор.
Рост микроорганизмов и время определения изменения импеданса (IDT) будут записаны автоматически.
Учет результатов.
Учет результатов основан на сравнении степени угнетения роста тест-культуры ингибирующими веществами, содержащимися в исследуемом образце, с ее ростом в контрольной ячейке (рис. 1).
Оценка проводится по двум параметрам:
- время пересечения 4 % порогового значения по М-параметру менее чем за 1 ч;
- диапазон изменения импеданса по М-параметру за 2,5 ч.
Если исследуемый образец содержит ингибиторы, то наблюдается увеличение времени пересечения порогового значения по М-параметру и уменьшение масштаба изменения импеданса по М-параметру в сравнении с контролем (тест-культура).
6.20. Контроль стерильности
Контроль стерильности основан на использовании непрямого метода определения импеданса питательной среды.
Метод основан на способности аэробных бактерий давать рост на питательной среде BiMedia 001В или 002А, а анаэробных бактерий - на тиогликолевой среде.
Питательные среды готовятся в соответствии с инструкцией фирмы-изготовителя.
Для данного метода используются измерительные ячейки двух типов:
- измерительные неавтоклавируемые КОН-ячейки объемом 20 мл (непрямой метод) в комплекте с одноразовыми пластиковыми неавтоклавируемыми ёмкостями для исследуемых образцов объемом 7 мл;
- измерительные ячейки для анаэробов с серой крышкой (прямой метод).
Для аэробных микроорганизмов
1. Среды: BiMedia 001В или 002А.
2. Установить температуру 37 °С на приборе «БакТрак».
3. В основном меню программы прибора установить следующие параметры для инкубаторного блока:
|
Время исследования |
72 ч |
|
Масштаб измерений: |
|
|
М-параметр |
- 150 - 5 % |
|
Е-параметр |
- 150 - 5 % |
|
Время нагрева |
1 ч |
|
Пороговые значения: |
|
|
М-параметр |
- 25 % |
|
Е-параметр |
не учитывается |
|
Временной интервал: |
|
|
Интервал 1 |
72 ч |
Проводить учет результатов по М-параметру.
4. В измерительную КОН-ячейку внести 1 мл 0,2 %-го раствора КОН. Раствор КОН должен храниться тщательно закрытым в холодильнике. Срок хранения раствора КОН - 1 неделя.
5. Внести 5 мл среды BiMedia 001В или 002А в одноразовые пластиковые пробирки.
6. Добавить 1 мл предварительно подготовленного в соответствии с требованиями нормативной документации исследуемого образца в пробирки с питательными средами (жидкие образцы могут быть внесены без разведений).
Пробирки необходимо оставить открытыми для того, чтобы создать возможность для выхода СO2 при его образовании.
Для контроля среды используйте пробирки с питательными средами без инокулята.
7. Поместить пробирки в КОН-ячейки между электродами. Тщательно закрыть КОН-ячейки.
8. Выбрать в основном меню программы прибора «Начало измерений» и начать измерение.
После того как каждая позиция в блоке будет отмаркирована как свободная на экране монитора, поместить измерительные ячейки в инкубаторный блок прибора.
Рост микроорганизмов и время определения изменения импеданса (IDT) будут записаны автоматически.
Учет результатов.
Образец считается стерильным, если измерение импеданса не превышает - 25 %-е пороговое значение по М-параметру в течение 72 ч.
Примечание.
При использовании ячеек с двумя электродами необходимо внести дополнительные установки. Для этого открыть окно «Установка параметров измерений», в графе «Тип оценки» выбрать измерение М2 (Cells with 2 pins).
Для анаэробных микроорганизмов
1. Установить температуру 35 °С на приборе «БакТрак».
2. В основном меню программы прибора установить следующие параметры для инкубаторного блока:
|
Время исследования |
120 ч |
|
Масштаб измерений: |
|
|
М-параметр |
- 3 - 30 % |
|
Е-параметр |
- 3 - 50 % |
|
Время нагрева |
1 ч |
|
Пороговые значения: |
|
|
М-параметр |
5 % |
|
Е-параметр |
10 % |
|
Временной интервал: |
120 ч |
|
Интервал 1 |
|
Проводить учет результатов по М- и Е-параметру.
Используйте измерительные ячейки для анаэробов.
3. Внести в каждую измерительную ячейку по 9 мл стерильной тиогликолевой среды.
4. Предварительно подготовить в соответствии с требованиями нормативной документации исследуемый образец, профильтровать раствор и поместить фильтр в пробирки с питательной средой.
5. Закрыть измерительные ячейки крышками.
6. Тщательно перемешать содержимое, вращая ячейку между ладонями (не переворачивать ячейку!).
7. Для контроля среды используйте одну измерительную ячейку с 10 мл питательной среды (без фильтра).
8. Выбрать в основном меню программы прибора «Начало измерений» и начать измерения.
9. После того как каждая позиция в блоке будет отмаркирована как свободная на экране монитора, поместить измерительные ячейки в инкубаторный блок прибора.
Измерение начнется автоматически через 1 ч после загрузки ячеек в прибор.
Рост микроорганизмов и время определения изменения импеданса (IDT) будут записаны автоматически.
Учет результатов.
Образец считается стерильным, если измерение импеданса не превышает 5 %-е пороговое значение по М-параметру и 10 %-е - по Е-параметру в течение 120 ч.
6.21. Контроль стерильности фармакологических препаратов
Метод основан на способности аэробных бактерий давать рост на питательной среде BiMedia 001В, а анаэробных бактерий - на тиогликолевой среде.
Среды:
- BiMedia 001В - для аэробных микроорганизмов;
- тиогликолевая среда - для анаэробных микроорганизмов.
Питательные среды готовятся в соответствии с инструкцией фирмы-изготовителя.
Для данного метода используются измерительные ячейки двух типов:
- измерительные неавтоклавируемые КОН-ячейки объемом 20 мл (непрямой метод) в комплекте с одноразовыми пластиковыми неавтоклавируемыми ёмкостями для исследуемых образцов объемами 7 мл;
- измерительные ячейки для анаэробов с серой крышкой (прямой метод).
Для аэробных микроорганизмов
1. Установить температуру 25 °С на приборе «БакТрак».
2. В основном меню программы прибора установить следующие параметры для инкубаторного блока:
|
Время исследования |
120 ч |
|
Масштаб измерений: |
|
|
М-параметр |
- 150 - 5 % |
|
Е-параметр |
- 150 - 5 % |
|
Время нагрева |
1 ч |
|
Пороговые значения: |
|
|
М-параметр |
- 40 % |
|
Е-параметр |
не учитывается |
|
Временной интервал: |
|
|
Интервал 1 |
120 ч |
Проводить учет результатов по М-параметру.
3. В измерительную КОН-ячейку внести 1 мл 0,2 %-го раствора КОН. Раствор КОН должен храниться тщательно закрытым в холодильнике. Срок хранения раствора КОН - 1 неделя.
Внести 5 мл BiMedia 001В в одноразовые пластиковые пробирки.
4. Предварительно подготовить в соответствии с требованиями нормативной документации исследуемый образец, профильтровать раствор и поместить фильтр в пробирки с питательной средой.
5. Пробирки необходимо оставить открытыми для того, чтобы создать возможность для выхода СO2 при его образовании.
6. Для контроля среды используйте пробирки с питательными средами без фильтра.
7. Поместить пробирки в КОН-ячейки между электродами.
8. Тщательно закрыть КОН-ячейки.
9. Выбрать в основном меню программы прибора «Начало измерений» и начать измерение.
10. После того как каждая позиция в блоке будет отмаркирована как свободная на экране монитора, поместить измерительные ячейки в инкубаторный блок прибора.
Рост микроорганизмов и время определения изменения импеданса будут записаны автоматически.
Учет результатов.
Образец считается стерильным, если измерение импеданса не превышает - 40 %-е пороговое значение по М-параметру в течение 120 ч.
Для анаэробных микроорганизмов
1. Установить температуру 35 °С на приборе «БакТрак».
2. В основном меню программы прибора установить следующие параметры для инкубаторного блока:
|
Время исследования |
120 ч |
|
Масштаб измерений: |
|
|
М-параметр |
- 3 - 30 % |
|
Е-параметр |
- 3 - 50 % |
|
Время нагрева |
1 ч |
|
Пороговые значения: |
|
|
М-параметр |
5 % |
|
Е-параметр |
10 % |
|
Временной интервал: |
|
|
Интервал 1 |
120 ч |
Проводить учет результатов по М- и Е-параметру.
Используйте измерительные ячейки для анаэробов.
3. Внести в каждую измерительную ячейку по 9 мл стерильной тиогликолевой среды.
4. Предварительно подготовить в соответствии с требованиями нормативной документации исследуемый образец, профильтровать раствор и поместить фильтр в пробирки с питательной средой.
5. Закрыть измерительные ячейки крышками.
6. Тщательно перемешать содержимое, вращая ячейку между ладонями (не переворачивать ячейку!).
7. Для контроля среды используйте одну измерительную ячейку с 10 мл питательной среды (без фильтра).
8. Выбрать в основном меню программы прибора «Начало измерений» и начать измерения.
9. После того как каждая позиция в блоке будет отмаркирована как свободная на экране монитора, поместить измерительные ячейки в инкубаторный блок прибора.
Измерение начнется автоматически через 1 ч после загрузки ячеек в прибор.
Рост микроорганизмов и время определения изменения импеданса (IDT) будут записаны автоматически.
Учет результатов.
Образец считается стерильным, если измерение импеданса не превышает 5 %-е пороговое значение по М-параметру и 10 %-е - по Е-параметру в течение 120 ч.
Примечание.
При использовании ячеек с двумя электродами необходимо внести дополнительные установки. Для этого открыть окно «Установка параметров измерений», в графе «Тип оценки» выбрать измерение М2 (Cells with 2 pins).
6.22. Определение мезофильных аэробных и
факультативных
анаэробных микроорганизмов в косметической продукции
1. Среда:
BiMedia 001В (готовится в соответствии с инструкцией фирмы-изготовителя).
2. Установить температуру 30 °С на приборе «БакТрак».
3. В основном меню программы прибора установить следующие параметры для инкубаторного блока:
|
Время исследования |
48 ч |
|
Масштаб измерений: |
|
|
М-параметр |
- 5 - 30 % |
|
Е-параметр |
- 5 - 50 % |
|
Время нагрева |
1 ч |
|
Пороговые значения: |
|
|
М-параметр |
5 % |
|
Е-параметр |
10 % |
|
Временной интервал: |
|
|
Интервал 1 |
48 ч |
Учет результатов проводится по М-параметру.
При наличии калибровочного файла для исследуемого вида продукции параметры пороговых значений вносятся автоматически.
4. Внести в каждую измерительную ячейку по 9 мл среды.
5. Внести 1 мл предварительно подготовленного образца в соответствии с требованиями нормативной документации в измерительную ячейку с 9 мл среды (жидкие образцы могут быть внесены без разведений).
6. Тщательно перемешать содержимое ячейки, вращая ее между ладонями (не переворачивать ячейку!).
7. Для контроля питательной среды используйте одну измерительную ячейку с 10 мл питательной среды (без инокулята).
8. Выбрать в основном меню программы «Начало измерений» и начать измерение.
9. После того как каждая позиция инкубаторного блока будет отмаркирована как свободная на экране монитора, поместить измерительные ячейки в прибор.
Измерение начнется автоматически через 1 ч после загрузки ячеек в прибор.
Рост микроорганизмов и время определения изменения импеданса (IDT) будут записаны автоматически.
При пересечении порогового значения происходит автоматический подсчет численности микроорганизмов в исследуемом образце (при наличии калибровочного файла).
Учет результатов.
Результат определения КОЕ выдается автоматически в виде количества микроорганизмов в 1 мл исследуемого образца.
Если исследуется твердый продукт, то результат определения КОЕ необходимо умножить на степень разведения (×10) для получения значения КОЕ в 1 г исследуемого образца.
Примечание.
Инактивационная смесь:
- Твин-80 - 30,0 г;
- лецитин - 3,0 г;
- L-гистидин HCl - 1,0 г;
- Na2S2O3⋅5Н2O - 5,0 г;
- пептон - 1,0 г (соотношение «образец:раствор» - 1:10).
6.23. Определение мезофильных аэробных и
факультативных
анаэробных микроорганизмов в косметической продукции,
используя непрямой метод
Для данного метода используются измерительные неавтоклавируемые КОН-ячейки объемом 10 мл (стойкие к воздействию щелочи) в комплекте с одноразовыми пластиковыми неавтоклавируемыми ёмкостями для исследуемых образцов объемом 7 мл.
1. Среда:
BiMedia 502В (готовится в соответствии с инструкцией фирмы-изготовителя) + Supplement I или инактивационную смесь.
2. Установить температуру 30 °С на приборе «БакТрак».
3. В основном меню программы прибора установить следующие параметры для инкубаторного блока:
|
Время исследования |
48 ч |
|
Масштаб измерений: |
|
|
М-параметр |
- 150 - 5 % |
|
Е-параметр |
- 150 - 5 % |
|
Время нагрева |
1 ч |
|
Пороговые значения: |
|
|
М-параметр |
- 25 % |
|
Е-параметр |
не учитывается |
|
Временной интервал: |
|
|
Интервал 1 |
48 ч |
Учет результатов проводить по М-параметру.
При наличии калибровочного файла для исследуемого вида продукции параметр порогового значения вносится автоматически.
4. В измерительную КОН-ячейку внести 1 мл 0,2 %-го раствора КОН. Раствор КОН должен храниться тщательно закрытым в холодильнике. Срок хранения раствора КОН - 1 неделя.
5. Внести 5 мл среды BiMedia 502В в одноразовую пластиковую пробирку.
6. Добавить 1 мл предварительно подготовленного в соответствии с требованиями нормативной документации исследуемого образца в пробирку с питательной средой.
7. Пробирку необходимо оставить открытой для того, чтобы создать возможность для выхода СO2 при его образовании.
8. Поместить внутреннюю пробирку в КОН-ячейку между электродами.
9. Тщательно закрыть КОН-ячейку.
10. Выбрать в основном меню программы прибора «Начало измерений» и начать измерение.
11. После того как каждая позиция в блоке будет отмаркирована как свободная на экране монитора, поместить измерительные ячейки в инкубаторный блок прибора.
Рост микроорганизмов и время определения изменения импеданса (IDT) будут записаны автоматически.
При наличии калибровочного файла происходит автоматический подсчет КОЕ в исследуемом образце при пересечении порогового значения.
Учет результатов.
Результат определения КОЕ выдается автоматически в виде количества микроорганизмов в 1 мл исследуемого образца.
Если исследуется твердый продукт, то результат определения КОЕ необходимо умножить на степень разведения (×10) для получения значения КОЕ в 1 г исследуемого образца.
Примечание.
Инактивационная смесь:
- Твин-80 - 30,0 г;
- лецитин - 3,0 г;
- L-гистидин HCl - 1,0 г;
- Na2S2O3⋅5Н2O - 5,0 г;
- пептон - 1,0 г (соотношение «образец:раствор» - 1:10).
При использовании ячеек с двумя электродами необходимо внести дополнительные установки. Для этого открыть окно «Установка параметров измерений», в графе «Тип оценки» выбрать измерение М2 (Cells with 2 pins).
7. Основные этапы создания калибровочного файла
Для создания калибровочного файла необходимо провести порядка 50 - 80 (минимум 30) параллельных исследований для одного типа продукции как классическим методом (подсчет КОЕ на чашках Петри), так и автоматически - с помощью прибора.
Выполнить следующие пункты методики определения КМАФАнМ.
1. Среда BiMedia 001В (готовится в соответствии с инструкцией, указанной в методических указаниях - гл. 9).
2. Установить следующие параметры:
|
Температура |
30 °С |
|
Время исследования |
24 ч |
|
Масштаб измерений: |
|
|
М-параметр |
- 5 - 30 % |
|
Е-параметр |
- 5 - 50 % |
|
Время нагрева |
1 ч |
|
Пороговые значения: |
|
|
М-параметр |
5 или 3 % (при низкой обсемененности продукта) |
|
Е-параметр |
не учитывается |
3. Добавить в каждую измерительную ячейку по 9 мл среды BiMedia 001В.
4. Произвести серию разведений. С каждого разведения посеять параллельно на чашку Петри и в ячейку для анализа на приборе «БакТрак» (рис. 2). Внести 1 мл суспензии исследуемого продукта в измерительную ячейку с 9 мл среды.
5. Тщательно перемешать содержимое, вращая ячейку между ладонями (не переворачивать ячейку!).
6. Для контроля среды используйте одну измерительную ячейку с 10 мл среды BiMedia 001В (без инокулята).
7. Выбрать в основном меню программы «Начать измерения».
8. После того как каждая позиция блока будет отмаркирована как свободная на экране монитора, поместить измерительные ячейки в прибор.
9. После окончания эксперимента произвести подсчет колоний на чашках Петри с перерасчетом на 1 мл и занести данные в соответствующий столбик в программе «Kalibrat-gb (CFU plate)». В столбик «Detection Time» вносим данные, полученные на «БакТраке» (время пересечения кривой с пороговым значением 5 или 3 %), так чтобы результаты, полученные на чашках и на «БакТраке» с одного разведения, стояли друг напротив друга.
10. После внесения результатов линейная регрессия и коэффициент корреляции вычисляются автоматически, коэффициент корреляции должен превышать значение (-0,85).
Рис. 2. Схема проведения эксперимента для создания
калибровочного файла
11. Для сохранения калибровочного файла в основном меню программы «BacMonitor» открыть окно «Вид/Установка параметров измерения», далее выбрать «Калибровочный файл/Создать новый».
12. Внести название, комментарии для детального описания калибровочного файла, а также коэффициенты полученные K1 и K0 полученного уравнения линейной регрессии y(log КОЕ) = K1х + K0.
7.1. Основные этапы создания калибровочного файла
при работе на приборе «БакТрак 4100»
В основном меню программы выбрать раздел «Работа с данными».
1. В меню «Работа с данными/Выбор файлов» выбрать соответствующие файлы исследований данного продукта.
2. Внести в меню «Работа с данными/Ввод данных» результаты, полученные классическим методом (КОЕ в 1 мл продукта) для соответствующих исследованных образцов продуктов.
4. В меню «Работа с данными/Выбор файлов» выбрать соответствующие файлы исследования данного продукта (значение КОЕ в 1 мл продукта должно быть внесено заранее (п. 3).
5. Открыть меню «Работа с данными/Корреляция».
6. Указать пороговые значения в разделе «Порог» для М- или Е-параметра, по которому будет проводиться построение калибровочной кривой. Как правило, для построения калибровочной кривой используется 5 % порог для М-параметра.
7. После задания порогового значения М-параметра необходимо вычислить линейную регрессию и коэффициент корреляции в разделе «Вычислить», коэффициент корреляции не должен превышать значение (-0,85).
8. Теперь данная калибровочная кривая может быть внесена в память программы в виде калибровочного файла в разделе «Диск/Файл».
9. Ввести дополнительную информацию на данный калибровочный файл в разделе «Комментарий» для более детального описания.
10. В основном меню программы в разделе «Параметры ячейки/Список исследований» сохранить полученный калибровочный файл.
7.2. Основные этапы создания калибровочного файла
при работе на приборе «БакТрак 4300»
1. В основном меню программы «БакЭвал» открыть окно «Выбор результатов измерений» в меню «Файл/Открыть».
2. В окне «Выбор результатов измерений» задать критерии выбора для результатов исследования данного продукта и закрыть окно.
3. Указать пороговые значения «Порог» для М- или Е-параметра, по которому будет проводиться построение калибровочной кривой. Как правило, для построения калибровочной кривой используется 5 %-й порог для М-параметра.
4. Выбранные данные измерений следует экспортировать в прилагаемый к программе файл «Calibrate.xlt» для расчета линейной регрессии.
5. В данный файл внести результаты, полученные классическим методом (КОЕ в 1 мл продукта) для соответствующих исследованных образцов продукта.
6. После внесения результатов линейная регрессия и коэффициент корреляции вычисляются автоматически, коэффициент корреляции должен превышать значение (-0,85).
7. Для сохранения калибровочного файла в основном меню программы «БакМонитор» открыть окно «Вид/Установка параметров измерения», далее выбрать меню «Калибровочный файл/Создать новый».
Рис. 3. Корреляция между логарифмом численности
микроорганизмов log КОЕ и временем определения импеданса t
для образцов молока с использованием среды BiMedia 001В
8. В основном меню программы «БакМонитор» открыть окно «Вид/Установка параметров измерения», выбрать меню «Анализ/Создать новый». Ввести название калибровочного файла в окне «Список анализов» для соответствующего типа исследования.
9. Если коэффициент корреляции не превышает значение (-0,85), то необходимо более детально проанализировать полученную зависимость. Как правило, прослеживается общая тенденция - большинство точек находится вблизи калибровочной кривой и имеются лишь отдельные «точки-выбросы», которые расположены вдали от калибровочной кривой. В этом случае необходимо «точки-выбросы» исключить. Это приведет к существенному повышению коэффициента корреляции.
7.3. Основные этапы создания калибровочного файла
при работе на приборе «БиоТрак 4250»
Процедура создания калибровочного файла подобна аналогичной процедуре на приборе «БакТрак4300» (п. 6.2).
Файл: RMTMA
Комментарий: Сырое молоко, BiMedia 001B, М 5 %.
Порог М равен 5 %
Порог Е равен 10 %
Учет результатов: М-параметр
Log (КОЕ) = -0,2431⋅t + 8,8501
Коэффициент корреляции: г = -0,9162
Дисперсия: Syx = 0,4087
8. Типичные кривые измерения импеданса
при определении санитарно-показательных,
условно-патогенных и патогенных микроорганизмов
Рис. 4. Типичная кривая импедансного сигнала при
определении
КМАФАнМ с использованием питательной среды BiMedia 001В
Рис. 5. Типичная кривая импедансного сигнала при
определении
бактерий группы кишечных палочек с использованием
питательной среды BiMedia 160С с»
Рис. 6. Типичная кривая импедансного сигнала при
определении
сальмонелл с использованием питательной среды BiMedia 201C
Рис. 7. Типичная кривая импедансного сигнала при
определении
энтерококков с использованием питательной среды BiMedia 330А
Рис. 8. Типичная кривая импедансного сигнала при
определении
S. aureus с использованием питательной среды BiMedia 350А
Рис. 9. Типичная кривая импедансного сигнала при
определении
клостридий с использованием питательной среды BiMedia 660А
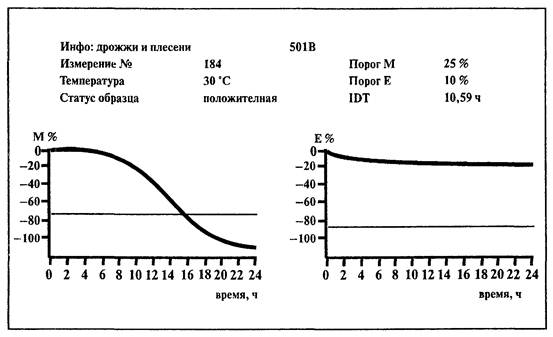
Рис. 10. Типичная кривая импедансного сигнала при
определении
дрожжей и плесеней с использованием питательной среды
BiMedia 501В
9. Питательные
среды.
Назначение, приготовление, использование
9.1. Назначение питательных сред
Импедансный метод является культуральным методом с использованием питательных сред. С анализаторами серии «БакТрак 4000» используются среды серии BiMedia, выпускаемые фирмой производителем анализаторов:
- BiMedia 001В - определение общей микробной численности;
- BiMedia 002А - определение общей микробной численности;
- BiMedia 101В - определение грамотрицательных бактерий;
- BiMedia 140А - определение энтеробактерий;
- BiMedia 150В - определение E.coli;
- BiMedia 155А - определение E.coli в моллюсках;
- BiMedia 155В - определение E.coli в воде;
- BiMedia 160С - определение БГКП (Колиформ);
- BiMedia 201С - определение Salmonella;
- BiMedia 205С - определение Salmonella;
- BiMedia 330А - определение энтерококков;
- BiMedia 350А - определение Staphylococcus aureus;
- BiMedia 401А - определение Listeria;
- BiMedia 501В - определение дрожжей и плесеней;
- BiMedia 502А - определение общей микробной численности, в т.ч. дрожжей и плесеней;
- BiMedia 610А - определение В. cereus;
- BiMedia 630А - определение лактобацилл;
- BiMedia 660А - определение сульфитредуцирующих клостридий;
- Supplement I - реагент для инактивации консервантов и ингибиторов;
- Supplement М - реагент для определения КМАФАнМ в сухой сыворотке.
9.2. Приготовление питательных сред
Для приготовления растворов используют дистиллированную воду. Необходимое значение pH растворов устанавливают с помощью растворов гидроокиси натрия NaOH и соляной кислоты НCl.
Питательные среды BiMedia 001В, 101В, 002А, 140А, 150В, 155А, 160С, 330А, 350А, 501В.
Растворить необходимое количество среды в воде (соотношение указано на упаковке).
Разделить приготовленную среду на порции и стерилизовать при 121 °С 15 мин.
Приготовление питательной среды BiMedia 101В.
Добавить на 1 л стерильной питательной среды BiMedia 001В 0,01 г бензалкониума хлорида (Aldrich 23, 442-7), растворенного в 2 мл стерильной дистиллированной воды.
Примечание.
Приготовленные среды должны храниться при 4 - 8 °С. Срок хранения - 3 недели.
Изменение режима стерилизации (более продолжительное автоклавирование) снижает качество сред!
9.3. Питательная среда BiMedia 130А
BiMedia 130А - определение бактерий рода Pseudomonas.
Растворить BiMedia 130А Base в воде из расчета 7,5 г на 500 мл воды.
Довести pH до 7,0 ± 0,2 (если необходимо).
Разделить приготовленную среду на порции и стерилизовать при 121 °С 15 мин.
В асептических условиях добавить 2 мл раствора этанола/стерильная дистиллированная вода (1:1) к флакону с добавкой CFC Selective Supplement.
Добавить содержимое флакона в асептических условиях к 500 мл основной среды (температура среды должна достигнуть 50 °С).
Примечание.
Добавку CFC Selective Supplement следует добавлять только непосредственно перед использованием среды.
Добавка CFC Selective Supplement должна храниться в темноте при 4 - 8 °С.
Приготовленная среда должна храниться в темноте при 4 - 8 °С.
Срок хранения питательной среды без добавки - 3 недели.
Срок хранения питательной среды с добавкой - 3 дня.
Срок хранения приготовленной добавки - 3 дня.
Длительное нагревание и обработка при температуре выше рекомендуемой снижают качество среды!
9.4. Питательная среда BiMedia 150А
BiMedia 150 А - определение Е. coli.
Растворить BiMedia 150А Base и Additive 150А в воде из расчета 40,0 г среды и 5,0 г аддитива в 500 мл воды.
Довести pH до 7,0 ± 0,2 (если необходимо).
Разделить приготовленную среду на порции и стерилизовать при 121 °С 15 мин.
Выдержать среду при комнатной температуре в течение 6 ч или в холодильнике (4 - 8 °С) в течение ночи перед использованием.
Примечание.
Цвет питательной среды должен быть темно-желтым. Если наблюдается изменение цвета на коричневый вследствие несоблюдения режима стерилизации, то питательная среда непригодна к использованию.
Приготовленная среда должна храниться в темноте при 4 - 8 °С.
Срок хранения питательной среды - 3 недели.
Длительное нагревание и обработка при температуре выше рекомендуемой снижают качество среды!
9.5. Питательная среда BiMedia 165А
BiMedia 165А - определение БГКП (колиформ) в воде.
Растворить BiMedia 165А Base в дистиллирован ной воде из расчета 38,0 г на 1,0 л воды. Добавить к раствору добавку Supplement 165А из расчета 10,0 г на 1,0 л воды (перед добавлением хорошо перемешать).
Довести pH среды до 6,9 ± 0,2 (если необходимо).
Разделить приготовленную среду на порции и стерилизовать при 121 °С 15 мин.
Выдержать среду при комнатной температуре в течение 6 ч или в холодильнике (4 - 8 °С) в течение ночи перед использованием.
Примечание.
Приготовленная среда должна храниться втемноте при 4 - 8 °С. Срок хранения питательной среды - 3 недели.
Длительное нагревание и обработка при температуре выше рекомендуемой снижают качество среды!
9.6. Питательная среда BiMedia 201C
BiMedia 201С (модификация среды Раппапорта-Вассилиадиса) - определение сальмонелл.
Растворить BiMedia 201С и Additive 201С в дистиллированной воде из расчета 8,3 г среды и 20,0 г добавки на 500 мл воды.
Довести pH среды до 6,5 ± 0,2 (если необходимо) медленно (по каплям) добавляя 1 М раствор NaOH при постоянном перемешивании на магнитной мешалке, избегая выпадения осадка.
Разлить приготовленную среду по флаконам и пастеризовать на водяной бане при 103 °С в течение 10 мин. Для контроля температуры использовать дополнительный флакон с 500 мл воды и помещенным в него термометром. По достижении температуры 103 °С в контрольном флаконе необходимо продолжить прогревание еще 10 мин.
Не стерилизовать среду автоклавированием!
Выдержать среду при комнатной температуре в течение 6 ч или в холодильнике (4 - 8 °С) в течение ночи перед использованием.
Supplement 201C. Перед использованием среды в нее необходимо добавить Supplement. Данный Supplement в комбинации с BiMedia 201С ингибирует рост Enterobacter ssp. без влияния на рост сальмонелл.
Для селективного подавления Enterobacter ssp. и Klebsiella ssp. альтернативно (вместо Supplement 201C) можно использовать антибиотик новобиоцин. Максимальная концентрация данного антибиотика при добавлении к питательной среде BiMedia 201С составляет 20,0 мг/л.
Добавить 8,0 мл Supplement 201С, растворенного в воде в асептических условиях, к 500 мл основной среды непосредственно перед использованием.
Примечание.
Supplement следует добавлять только непосредственно перед использованием среды!
Supplement должен храниться при 4 - 8 °С. Если во время хранения появилось желто-оранжевое окрашивание, то Supplement не пригоден к использованию.
Приготовленная среда должна храниться в темноте при 4 - 8 °С.
Срок хранения питательной среды без Supplement - 3 недели. При продолжительном сроке хранения рекомендуется заменить этап пастеризации среды стерилизацией с использованием метода мембранных фильтров.
Срок хранения питательной среды с Supplement - 3 дня.
Длительное нагревание и обработка при температуре выше рекомендуемой снижают качество среды!
Выпадение небольшого количества осадка, а также помутнение раствора среды в процессе хранения допускается.
9.7. Питательная среда BiMedia 205А
BiMedia 205А (модификация селенитовой среды) - определение сальмонелл.
Растворить BiMedia 205А Base и Additive 205А в воде из расчета 12,3 г среды и 2,8 г аддитива на 500 мл воды. Для приготовления среды используйте стерильные инструменты и посуду, избегайте контаминации оставшегося в упаковке порошка.
Разлить приготовленную среду по флаконам и пастеризовать на водяной бане при 60 °С в течение 10 мин. Для контроля температуры использовать дополнительный флакон с 500 мл воды и помещенным в него термометром.
Не стерилизовать среду автоклавированием!
Довести pH среды в стерильных условиях до 7,2 ± 0,1 (если необходимо).
Примечание.
Приготовленная среда должна храниться в темноте при 4 - 8 °С. Срок хранения - 1 неделя.
Для увеличения срока хранения (более 1 недели) рекомендуется провести стерилизацию среды фильтрованием.
Если во время хранения в среде образовался красный осадок, то среда не пригодна к использованию.
Длительное нагревание и обработка при температуре выше рекомендуемой снижают качество среды!
Возможно получение ложноотрицательных результатов при выявлении бактерий видов S. saintpaul и S. montevideo на питательной среде BiMedia 205А. В случаях, где ожидается присутствие данных видов, следует дополнительно использовать питательную среду BiMedia 201C.
9.8. Питательная среда PreMedia 350А
РrеMedia 350А - предобогащение S. aureus.
Растворить PreMedia 350А Base в стерильной воде из расчета 32,4 г на 500 мл воды.
Довести pH до 6,8 ± 0,2 (если необходимо).
Разделить приготовленную среду на порции и стерилизовать при 121 °С 15 мин.
Растворить аддитивы Additive 350А/1 и Additive 350А/2 в 2 - 4 мл стерильной воды каждый и добавить к 500 мл среды PreMedia 350А (температура среды должна достигнуть 50 °С).
Добавить 0,7 мл 3,5 %-го раствора теллурита калия к 500 мл среды PreMedia 350А.
Теперь среда PreMedia 350А готова к использованию.
Примечание.
Аддитивы Additive 350А/1 и Additive 350А/2 следует добавлять непосредственно перед использованием среды.
Аддитивы должны храниться при 4 - 8 °С в темноте.
Приготовленная среда должна храниться в темноте при 4 - 8 °С.
Срок хранения приготовленной среды без аддитивов - 3 недели.
Срок хранения приготовленной среды с аддитивами - 3 дня.
Срок хранения аддитивов после вскрытия - 1 неделя.
Длительное нагревание и обработка при температуре выше рекомендуемой снижают качество среды!
9.9. Питательная среда FDA-бульон и UVM среда
UVM среда - предварительное обогащение листерий (2 шага):
- внести 25 г образца в 225 мл UVM I среды (1,10824), провести инкубацию при 30 °С в течение 24 ч;
- внести 0,1 мл в 10 мл UVM II среды (1,10824 + 1,04039) и снова инкубировать при 30 °С в течение 24 ч.
FDA-бульон - предварительное обогащение листерий (1 шаг).
9.10. Питательная среда BiMedia 401А
BiMedia 401 А - определение листерий
Растворить BiMedia 401А Base и Additive 401А в воде из расчета 18,0 г среды и 7,5 г аддитива на 500 мл воды.
Довести pH до 7,0 ± 0,2 (если необходимо).
Разделить приготовленную среду на порции и стерилизовать при 121 °С 15 мин.
Выдержать среду при комнатной температуре в течение 6 ч или в холодильнике (4 - 8 °С) в течение ночи перед использованием.
Добавить 1 флакон добавки при анализе неферментированных продуктов или 2 флакона добавки при анализе ферментированных продуктов (PALCAM Listeria Selective Supplement - Merck, 12122), растворенного в 2 мл стерильной воды к 500 мл питательной среды.
Примечание.
Добавку PALCAM Listeria Selective Supplement следует добавлять непосредственно перед использованием среды.
Добавка должна храниться при 4 - 8 °С в темноте.
Приготовленная среда должна храниться в темноте при 4 - 8 °С.
Срок хранения приготовленной среды без добавки - 3 недели.
Срок хранения приготовленной среды с добавкой - 3 дня.
Срок хранения добавки после вскрытия - 3 дня.
Длительное нагревание и обработка при температуре выше рекомендуемой снижают качество среды!
9.11. Питательная среда BiMedia 610А
BiMedia 610А - определение В. cereus
Растворить BiMedia 610А в воде из расчета 7,5 г среды на 500 мл воды.
Довести pH до 7,0 ± 0,2 (если необходимо).
Разделить приготовленную среду на порции и стерилизовать при 121 °С 15 мин.
Добавить 1 флакон аддитива Additive 610А, растворенного в 2 - 4 мл стерильной воды, к 500 мл питательной среды.
Примечание.
Аддитив Additive 610А следует добавлять непосредственно перед использованием среды.
Аддитив должен храниться при 4 - 8 °С в темноте.
Приготовленная среда должна храниться в темноте при 4 - 8 °С.
Срок хранения приготовленной среды без аддитива - 3 недели.
Срок хранения приготовленной среды с аддитивом - 3 дня.
Срок хранения аддитива после вскрытия - 3 дня.
Длительное нагревание и обработка при температуре выше рекомендуемой снижают качество среды!
9.12. Питательная среда BiMedia 630А
BiMedia 630А - определение лактобацилл
Растворить BiMedia 630А в воде из расчета 19,8 г среды на 500 мл воды.
Разделить приготовленную среду на порции и стерилизовать при 118 °С 15 мин.
Выдержать среду при комнатной температуре в течение 6 ч или в холодильнике (4 - 8 °С) в течение ночи перед использованием.
Добавить в асептических условиях 5 мл добавки Supplement 630А к 500 мл питательной среды (температура среды должна достигнуть 30 °С).
Добавить в асептических условиях по 5 мл растворов антибиотиков гидрохлорид ванкомицина (5 мг/мл) и сульфат полимиксина В (4 мг/мл), стерилизованных фильтрованием.
Примечание.
Растворы антибиотиков следует добавлять непосредственно перед использованием среды.
Приготовленная среда должна храниться в темноте при 4 - 8 °С.
Срок хранения приготовленной среды без антибиотиков - 3 недели.
Длительное нагревание и обработка при температуре выше рекомендуемой снижают качество среды!
9.13. Питательная среда BiMedia 660А
BiMedia 660А - определение сульфитредуцирующих клостридий
Растворить BiMedia 660А в воде из расчета 13,75 г среды на 500 мл воды.
Довести pH до 7,1 ± 0,2 (если необходимо).
Внести по 9 мл среды в серые измерительные ячейки и стерилизовать при 121 °С 15 мин. Непосредственно после автоклавирования плотно закрыть крышки измерительных ячеек.
Добавить 1,5 мл стерильной воды к флакону с аддитивом Additive 660А.
Добавить по 30,0 мкл раствора аддитива в каждую измерительную ячейку с 9 мл среды непосредственно перед использованием (температура среды должна достигнуть 50 °С).
Для предотвращения образования воздушных пузырьков не погружать наконечник пипетки в питательную среду.
Примечание.
Аддитив Additive 660А следует добавлять непосредственно перед использованием среды.
Аддитив должен храниться при 4 - 8 °С в темноте.
Приготовленная среда должна быть использована в день приготовления.
Срок хранения аддитива после вскрытия - 3 дня.
Длительное нагревание и обработка при температуре выше рекомендуемой снижают качество среды!
BiMedia 660А - определение Cl. perfringes
Растворить BiMedia 660А в воде из расчета 13,75 г среды на 500 мл воды.
Довести pH до 7,1 ± 0,2 (если необходимо).
Внести по 9 мл среды в серые измерительные ячейки и стерилизовать при 121 °С 15 мин. Непосредственно после автоклавирования плотно закрыть крышки измерительных ячеек.
Добавить по 50,0 мкл растворов циклосерина (60 мг/мл), иазида натрия NaN3 (10 мг/мл), стерилизованных фильтрованием, в каждую измерительную ячейку с 9 мл среды непосредственно перед использованием. Для предотвращения образования воздушных пузырьков не погружать наконечник пипетки в питательную среду.
Примечание.
Растворы следует добавлять непосредственно перед использованием среды.
Растворы должны храниться при 4 - 8 °С в темноте.
Приготовленная среда должна быть использована в день приготовления.
Длительное нагревание и обработка при температуре выше рекомендуемой снижают качество среды!
9.14. Реагент для инактивации консервантов
и ингибиторов Supplement I
Растворить необходимое количество соответствующей питательной среды в воде (соотношение указано на упаковке).
Разделить приготовленную среду на порции по 500 мл и добавить содержимое 1 флакона реагента Supplement I.
Стерилизовать при 121 °С 15 мин.
Выдержать среду при комнатной температуре в течение 6 ч или в холодильнике (2 - 8 °С) в течение ночи перед использованием.
Примечание.
Приготовленная среда должна храниться при 4 - 8 °С.
Срок хранения - 3 недели.
Длительное нагревание и обработка при температуре выше рекомендуемой снижают качество среды!
9.15. Реагент для определения КМАФАнМ
в сухой сыворотке Supplement М
Растворить необходимое количество питательной среды BiMedia 001В в воде (соотношение указано на упаковке).
Разделить приготовленную среду на порции по 500 мл и добавить содержимое 1 флакона реагента Supplement М.
Стерилизовать при 121 °С 15 мин.
Выдержать среду при комнатной температуре в течение 6 ч или в холодильнике (4 - 8 °С) в течение ночи перед использованием.
Примечание.
Приготовленная среда должна храниться при 4 - 8 °С.
Срок хранения - 3 недели.
Длительное нагревание и обработка при температуре выше рекомендуемой снижают качество среды!
9.16. Инактивационная смесь
|
Химический состав |
Количество, г/л |
|
Твин-80 |
30,0 |
|
Лецитин |
3,0 |
|
L-гистидин HCl |
1,0 |
|
Na2SjO3⋅5Н2O |
5,0 |
|
Пептон |
1,0 |
Нагреть примерно 700 мл дистиллированной воды до кипения и добавить, перемешивая, подогретую смесь лецитина и L-гистидина.
Предварительно растворить Твин-80 с частью горячей смеси лецитин-гистидин, перемешать и добавить в раствор.
Дать прокипеть в течение нескольких минут и охладить.
Добавить пептон, перемешать до полного растворения. Раствор должен быть прозрачным.
Разделить приготовленный раствор на порции и стерилизовать при 121 °С 15 мин.
Примечание.
Приготовленная смесь должна храниться в темноте при 4 - 8 °С.
Срок хранения приготовленной смеси - 3 мес.
9.17. Тиогликолевая среда
Питательную среду готовят в соответствии с инструкцией фирмы-изготовителя или по следующей прописи:
|
Химический состав |
Количество, г/л |
|
Панкреатический гидролизат казеина |
15,0 |
|
Дрожжевой экстракт |
5,0 |
|
NaCl |
2,5 |
|
Глюкоза |
5,0 |
|
Цистеин (цистин) |
0,75 |
|
Тиогликолевая к-та или тиогликолят натрия |
0,5 |
|
Раствор резазурина натрия (1:1000) |
1,0 см3 |
|
Агар микробиологический |
0,75 |
Растворить все ингредиенты в воде, нагреть до полного растворения.
Профильтровать через ватно-марлевый фильтр.
Разлить по флаконам и стерилизовать при 121 °С 15 мин.
Примечание:
Приготовленная среда должна храниться в темноте при 10 - 25 °С. Срок хранения - 2 недели.
10. Методика тестирования
и подготовки измерительных ячеек и прибора
10.1. Методика тестирования измерительных
ячеек и прибора
Необходимо каждые несколько месяцев проводить тестирование используемых измерительных ячеек для контроля регистрируемых показателей изменения импеданса - М-параметра (импеданс среды) и Е-параметра (электродный импеданс). Для этого необходимо:
1. В стерильные измерительные ячейки внести 10 мл стерильного физиологического раствора.
2. В основном меню программы прибора установить следующие параметры для инкубаторного блока:
|
Время исследования |
24 ч |
|
Масштаб измерений: |
|
|
М-параметр |
- 5 - 30 % |
|
Е-параметр |
- 5 - 50 % |
|
Время нагрева |
1 ч |
|
Пороговые значения: |
|
|
М-параметр |
5 % |
|
Е-параметр |
не учитывается |
|
Временной интервал: |
|
|
Интервал 1 |
24 ч |
Проводить учет результатов по М-параметру.
3. Начать измерение.
4. После того как каждая позиция в блоке будет отмаркирована как свободная, поместить в инкубаторный блок измерительные ячейки с физиологическим раствором.
Учет результатов тестирования.
Если за время тестирования измерительных ячеек значения М-параметра не превысили 5 %, то ячейки пригодны для дальнейшего использования.
Если значение М-параметра превысило 5 %, то цвет ячейки на экране монитора изменится на красный. В этом случае необходимо повторно тестировать ячейку, предварительно поместив ее в любое другое место в инкубаторном блоке. При повторном получении аналогичных результатов (пересечение 5 %-го значения М-параметра) необходимо заменить измерительные ячейки на новые.
10.2. Методика обработки измерительных ячеек и прибора
10.2.1. Обработка измерительных ячеек и прибора после использования
Обрабатывать измерительные ячейки необходимо непосредственно после окончания хода исследования.
Приоткрыть пластмассовые крышки измерительных ячеек и поместить ячейки в металлический штатив.
Не автоклавировать плотно закрытые ячейки!
Стерилизовать измерительные ячейки при 1 атм. в течение 20 - 25 мин.
1. При наличии патогенных микроорганизмов следует использовать режимную стерилизацию.
2. После автоклавирования дать ячейкам остыть до комнатной температуры.
3. Открыть измерительные ячейки и промыть их дистиллированной водой.
4. Если исследуемый образец имел жирную консистенцию, необходимо выдержать ячейки в растворе с мягким нейтральным моющим средством (например, хозяйственное мыло) 30 мин.
5. При необходимости промыть измерительные ячейки мягким ершиком так, чтобы не повредить электроды.
6. Если на дне измерительной ячейки остался какой-то осадок, то его необходимо удалить.
7. Тщательно промыть измерительные ячейки 3 раза водопроводной водой и 2 раза дистиллированной водой.
8. Если между уплотнительными кольцами в донной крышке образовалась вода, необходимо разобрать ячейку и просушить в разобранном виде в сушильном шкафу при 50 °С в течение 40 мин.
9. Собрать ячейки, верхнюю крышку плотно не закрывать!
10. Измерительные ячейки автоклавировать при 1 атм. в течение 15 мин.
Теперь измерительные ячейки готовы к использованию.
Необходимо тщательно промывать ячейки, поскольку образование пленок на поверхности электродов может быть причиной построения нетипичных графиков.
Для удаления образовавшихся солей на поверхности электродов ячейки необходимо обработать 0,3 % раствором уксусной кислоты в течение 30 мин. После чего тщательно промыть водой.
Примечание.
При протекании питательной среды из измерительной ячейки с засеянной пробой продукта и попадания ее в измерительное гнездо прибора, следует обработать прибор средством «БИОПАН» в соответствии с инструкцией по применению. После обработки средством «БИОПАН» насухо вытереть измерительное гнездо прибора марлевым тампоном.
10.2.2. Стерилизация измерительных ячеек
1. Приоткрыть пластиковые крышки измерительных ячеек.
2. Поместить измерительные ячейки в металлический штатив.
3. Не автоклавировать плотно закрытые ячейки!
4. Разместить штатив с ячейками в верхней части автоклава для предотвращения попадания воды в ячейки.
5. Стерилизовать измерительные ячейки при 1 атм. в течение 20 мин.
Никогда не проводить стерилизацию в сухожаровом шкафу!
Достать измерительные ячейки из автоклава, как только станет возможным (~70 - 85 °С). Поместить их в термостат на 15 мин (~30 - 60 °С).
Возможно также высушить ячейки при комнатной температуре.
Если между уплотненными кольцами в данной крышке образовалась вода, то необходимо разобрать измерительные ячейки и высушить их в сушильном шкафу.
Убедитесь, что ячейки полностью высохли. При необходимости просушите измерительные ячейки еще раз.
Теперь измерительные ячейки готовы к использованию.
Примечание.
Возможна стерилизация измерительных ячеек с внесенной в них питательной средой.
Запрещается использование моющих средств, содержащих хлор, либо изменяющих поверхностное натяжение воды. Эти моющие средства приводят к образованию пленок на поверхности электродов и измерительных ячеек, что, в свою очередь, вызывает шумы при прохождении сигнала.
При помещении измерительных ячеек в инкубатор необходимо обратить внимание на то, что в ячейке прибора размещены два контакта, которые должны входить в отверстия измерительной ячейки. Нельзя прикладывать усилий, если измерительная ячейка не сразу становится на место. Достаточно повернуть ее вокруг оси. Это нужно делать во избежание продавливания электродов вовнутрь измерительной ячейки.
При необходимости снятия донышка с измерительной ячейки, надо положить ячейку в раствор теплой мыльной воды. Через некоторое время можно без усилий снять донышко.
Ячейки для непрямого метода (короткие электроды) не автоклавируют, их достаточно вымыть водой. Внутренние пробирки для непрямого метода являются стерильными и не автоклавируются (одноразовые).
Пробирки с серыми крышками предназначены для работы с анаэробами.
11. Ячейки, готовые к использованию
(предварительно заполненные средой)
|
BiMedia 001В |
определение КМАФАнМ |
9 мл |
|
BiMedia 001В |
определение КМАФАнМ в пастеризованном молоке |
5 мл |
|
BiMedia 001В + инактиватор |
определение КМАФАнМ |
9 мл |
|
BiMedia 002А |
определение КМАФАнМ |
9 мл |
|
BiMedia 140А |
определение энтеробактерий |
9 мл |
|
BiMedia 144А |
определение энтеробактерий, в т.ч. Enterobacter sakazakii |
9 мл |
|
BiMedia 155A |
определение Е. coli в моллюсках |
7,5 мл |
|
BiMedia 155B |
определение Е. coli в воде |
10 мл |
|
BiMedia 155A |
определение Е. coli |
9 мл |
|
BiMedia 160C |
определение БГКП (колиформ) |
9 мл |
|
BiMedia 330A |
определение энтерококков |
9 мл |
|
BiMedia 201C |
определение Salmonella RV |
9,9 мл |
|
BiMedia 205C |
определение Salmonella SC |
9,9 мл |
|
BiMedia 002A + Аддитив |
определение Bacillus cereus |
9 мл |
|
BiMedia 001B |
определение КМАФАнМ |
5 мл |
|
BiMedia 501B |
определение дрожжей и плесеней |
5 мл |
|
BiMedia 501B + Suplement I |
определение дрожжей и плесеней |
5 мл |
|
BiMedia 502A + Suplement I |
Определение общей микробной численности, в т.ч. дрожжей и плесеней |
5 мл |
Патогенные микроорганизмы, такие как Salmonella, Listeria, Е. coli могут быть подтверждены тестами, в т.ч. ИФА-тестами, GeneGen-тестами или RNAassay-тестами фирмы «Си-Лаб».
12. Питательные среды для экспресс-анализаторов
серии «БакТрак 4000», производимые
в Российской Федерации
BiMedia 001В - определение общей микробной численности.
BiMedia 160С - определение БГКП (колиформ).
BiMedia 501В - определение дрожжей и плесеней.
BiMedia 201C - определение сальмонелл.
BiMedia 205А - определение сальмонелл.
BiMedia 401А - определение листерий.
Питательные среды производятся Государственным научным центром прикладной микробиологии и биотехнологии (ГНЦ ПМБ), г. Оболенск Московской области, по рецептуре фирмы «Си-Лаб».
13. Оценка результатов измерения
для количественных анализов
13.1. Воспроизводимость результатов измерения:
SR = 0,15 log (кМАФАН в мясе)
SR = 0,15 log (Е. coli валидация)
13.2. Определение неопределенности измерения (НИ)
Определение НИ осуществлялось на примере анализа на Е. coli в морских деликатесах путем двух параллельных испытаний во всех вариациях эксперимента в соответствие с ИСО/ISO Technical Specification ISO/TS 19036, издание от 01.02.06.
Целью данного эксперимента являлась оценка влияния разных исследуемых материалов на компоненты неопределенности измерения (НИ). Исследуемый материал был разделен на порционные части, из которых были приготовлены суспензии в разных условиях.
Неопределенность измерения составила:
|
|
Syx - стандартная ошибка оценки для разных типов исследуемого материала от ±0,49 log10 unit до ±0,53 log10 unit.
14. Библиографические данные
1. Подунова Л.Г., Кривопалова Н.С., Сорокина Р.С., Колпакова И.Д., Скачков В.О., Гомбкото Я., Деннер Э., Юров С.В. Ускоренный метод обнаружения и идентификации микроорганизмов при исследовании пищевых продуктов и продовольственного сырья//Ж.: Эпидемиология и инфекционные болезни. 1996. № 1.
2. Лобковский А.Г., Попова Т.А., Корнеева Н.М., Сурначева А.Д. О преимуществе использования импедансного метода в практике лабораторных исследований пищевых продуктов по отдельным микробиологическим показателям//Ж.: ВНИСО. 1996. № 7/40. С. 9 - 11.
3. Пивоваров Ю.П., Королик В.В. Санитарно-значимые микроорганизмы (таксономическая характеристика и дифференциация). М., 2000.
4. Curda, L. Lactic and Other Bacteria: Encyclopedia of Food Microbiology, Academic Press, London, 1999. 580 - 588.
5. Futschik K., Pfutzner H. Electrode and Media Impedance for the Detection and Characterization of Microorganisms. Proceedings RC IEEE-EMBS and 14th BMESI, 1.75 - 1.76, 1995.
6. Futschik K., Pfutzner H., Nussaaum C Selective detection of microorganisms by use of electrode Impedance (IX International conference on electrical bio-impedance. September 26 - 30, 1995. Heidelberg, Germany. P. 79 - 82).
7. Jockel J. Einsatz der Impedanzmethode in der amtlichen Lebensmitteluberwachung. Fleischwirtschaft 76 (9), 945 - 950 (1996).
8. Schinkinger M. The BacTrac series 4000 Impedance Measuring System for the Rapid Detection of Microorganisms (BACTRAC Seminar. Moscow, May, 1998).
9. Kroyer G. Futschik, K. The Impedance - Splitting Metod for Microbiologic Analysis of Food Preservatives. An Evaluation. Biotech Lab International Vol. 2, % 2, 3 - 4, 8a - 10d, 1997.
10. Major P. Detection of Stafilococcus aureus within starter culture preparation containing Stafilococcus carnosus using the BacTrac 4100 impedance instrument. 4th World Congress Foodborne Infections and Intoxications, Berlin 1998 Abstract P-D11, 1998.
11. Fontana M., Busiello, S., Bisotti, S., Dallorto, G., Unger, G., Schwa-meis, G., Juterschnig, U., Unger, B., Masaniger, H., Schinkinger, M. Rapid enumeration of clostridial spores in raw milk samples using an impedimetric method: Journal of Rapid Methods and Automation in Microbiology 10, 107 - 116, 2002.