 | Информационная система |  |
Федеральная служба по надзору в сфере
защиты прав потребителей
и благополучия человека
1.3. ЭПИДЕМИОЛОГИЯ
Лабораторная диагностика
натуральной оспы
Методические указания
МУ 1.3.2970-11
1. Разработаны Федеральной службой по надзору в сфере защиты прав потребителей и благополучия человека (Ю.В. Демина, Е.Б. Ежлова, Н.В. Шеенков); ФБУН ГНЦ ВБ «Вектор» (С.С. Маренникова, С.Н. Щелкунов, Е.И. Рябчикова, М.П. Богрянцева, Е.В. Гаврилова, А.П. Агафонов, А.Н. Сергеев); ГУ НИИ вакцин и сывороток им. И.И. Мечникова РАМН (Г.Р. Мацевич, Н.Н. Янова); ГУ Институт полиомиелита и вирусных энцефалитов им. М.П. Чумакова РАМН (Э.Б. Гурвич).
2. Утверждены Руководителем Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека, Главным государственным санитарным врачом Российской Федерации Г.Г. Онищенко 14 декабря 2011 г.
3. Введены в действие 14 декабря 2011 г.
4. Введены взамен Инструкции по лабораторной диагностике натуральной оспы, утвержденной Заместителем министра здравоохранения СССР П.Н. Бургасовым 4.04.1972.
СОДЕРЖАНИЕ
|
УТВЕРЖДАЮ Руководитель Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека, Главный государственный санитарный врач Российской Федерации Г.Г. Онищенко 14 декабря 2011 г. Дата введения: 14 декабря 2011 г. |
1.3. ЭПИДЕМИОЛОГИЯ
Лабораторная диагностика натуральной оспы
Методические указания
МУ 1.3.2970-11
1. Область применения
1.1. Методические указания предназначены для специалистов органов и учреждений Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека, учреждений и структурных подразделений других федеральных органов исполнительной власти, выполняющих в установленном порядке работы по диагностике натуральной оспы и её дифференциации от клинически сходных заболеваний, а также осложнений после прививки оспенной вакцины.
1.2. Методические указания определяют правила организации и выполнения исследований при лабораторной диагностике натуральной оспы (далее оспы): взятие материала от заболевшего, подготовка проб для исследования, хранение, транспортирование проб, проведение диагностического исследования с помощью методов экспресс-диагностики и выделения возбудителя, учет и регистрация результатов.
1.3. Методические указания разработаны в соответствии с Федеральным законом от 31 марта 1999 г. «О санитарно-эпидемиологическом благополучии населения» № 52-ФЗ [1], Федеральным законом от 10 января 2002 г. «Об охране окружающей среды» № 7-ФЗ [2], постановлением Правительства Российской Федерации от 15 сентября 2005 г. № 569 «О положении об осуществлении государственного санитарно-эпидемиологического надзора в Российской Федерации» (Собрание законодательства Российской Федерации, 2005, № 39, ст. 3953) [3], требованиями Международных медико-санитарных правил (2005 г.) [4, 5].
2. Нормативные ссылки
1. Федеральный закон от 31.03.1999 № 52-ФЗ «О санитарно-эпидемиологическом благополучии населения».
2. Федеральный закон от 10.01.2002 № 7-ФЗ «Об охране окружающей среды».
4. Международные медико-санитарные правила (2005 г.).
5. Постановление Главного государственного санитарного врача РФ от 11.05.2007 № 27 «О реализации Международных медико-санитарных правил» (2005 г.).
8. СП 1.3.1285-03 «Безопасность работы с микроорганизмами I - II групп патогенности (опасности)».
9. СП 1.2.036-95 «Порядок учета, хранения, передачи и транспортирования микроорганизмов I - IV групп патогенности».
10. МУ 1.3.2569-09 «Организация работы лабораторий, использующих методы амплификации нуклеиновых кислот при работе с материалом, содержащим микроорганизмы I - IV групп патогенности».
11. МУ 3.3.1.2044-06 «Проведение вакцинопрофилактики натуральной оспы».
13. МУ 3.4.2552-09 «Организация и проведение первичных противоэпидемических мероприятий в случаях выявления больного (трупа), подозрительного на заболевания инфекционными болезнями, вызывающими чрезвычайные ситуации в области санитарно-эпидемиологического благополучия населения».
3. Общие положения
3.1. Натуральная оспа - острое инфекционное высококонтагиозное особо опасное заболевание вирусной этиологии, относящееся к карантинным инфекциям. Возбудитель - ДНК-содержащий вирус, принадлежащий к семейству Poxviridae, роду Orthopoxviruses.
3.2. Естественным резервуаром вируса является больной (а также умерший) человек. Заболевший натуральной оспой человек заразен от начала болезни до полного освобождения от корок. Заражение происходит воздушно-капельным, воздушно-пылевым или контактно-бытовым путями; вирус может также передаваться внутриутробно. Наиболее заразительным является период с 4 по 9 день болезни, когда во внешнюю среду при разговоре, кашле и чихании больного с отделяемым слизистых полости рта и зева выделяется большое количество вируса. В дальнейшем источником вируса является в основном содержимое кожных элементов и вируссодержащая пыль из отпавших и подсыхающих корок. Помимо этого заражение может произойти за счет контаминированных вирусом воздуха, белья больного и предметов.
3.3. В результате успешно проведенной под эгидой Всемирной организации здравоохранения (ВОЗ) международной программы (1958 - 1980 гг.) натуральная оспа была искоренена во всем мире. По рекомендации глобальной комиссии по сертификации ликвидации оспы вакцинация против этой инфекции была отменена в 1980 г.
По решению ВОЗ, коллекции штаммов этого возбудителя сохраняются для научных целей в двух Сотрудничающих центрах ВОЗ, регулярно контролируемых этой организацией:
• по диагностике ортопоксвирусных инфекций и музей штаммов и ДНК вируса оспы на базе ФБУН ГНЦ ВБ «Вектор» (Россия, Новосибирская область, р. п. Кольцово);
• по оспе и другим поксвирусным инфекциям на базе Центра контроля и предупреждения инфекционных заболеваний (США, Атланта).
3.4. В освобожденном от натуральной оспы мире при отсутствии природного резервуара возбудителя этой инфекции эпидемический процесс может возникнуть снова только при артифициальном заражении. В этом случае источником инфекции может служить вируссодержащий материал, привнесенный в окружающую среду в результате совершения акта биотерроризма или иных причин (внутрилабораторное инфицирование, вскрытие затерянных или забытых хранилищ вируса, а также захоронений умерших от оспы, в некоторых из которых благодаря особым условиям не исключено сохранение жизнеспособного вируса). В результате может возобновиться трансмиссия оспы с передачей инфекции от человека к человеку. При этом резкое падение коллективного иммунитета к оспе у населения и его полное отсутствие у лиц, родившихся после отмены оспопрививания, может привести к более агрессивному, чем ранее, распространению инфекции.
3.5. Опыт борьбы с завозными вспышками оспы в прошлом показал, что клинический диагноз у первых заболевших этой инфекцией в большинстве случаев оказывался неверным. На сегодняшний день эта ситуация усугубляется тем, что современное поколение инфекционистов не встречалось с оспой и знает о ней только по описанию в литературе. В этой связи лабораторная диагностика как никогда раньше становится важнейшим звеном в предупреждении распространения оспы.
3.6. Проведение диагностических исследований при подозрении на натуральную оспу осуществляется в ФБУН ГНЦ ВБ «Вектор», который является Референс-центром по мониторингу за ортопоксвирусными инфекциями [6], и имеет на своей базе Сотрудничающий центр ВОЗ по диагностике ортопоксвирусных инфекций и музей штаммов и ДНК вируса оспы (Россия, Новосибирская область, р. п. Кольцово) [7].
В случае чрезвычайной ситуации санитарно-эпидемиологического характера диагностические исследования без выделения возбудителя натуральной оспы (молекулярно-генетические и иммунологические) по поручению Главного государственного санитарного врача Российской Федерации могут осуществлять лаборатории, имеющие лицензии на проведение экспериментальных и диагностических видов работ с возбудителями инфекционных заболеваний 1 группы патогенности.
4. Взятие проб для исследования
Врач, выявивший на дому больного с подозрением на натуральную оспу, обязан незамедлительно организовать следующие первичные противоэпидемические мероприятия:
• изолировать больного, снабдив его бельем, посудой, приемником выделений, предметами ухода за больным, личной гигиены и прочими необходимыми вещами, закрыть окна и дверь;
• принять меры для исключения контактов больного с окружающими;
• организовать проведение текущей дезинфекции в помещении, где находится больной до момента его госпитализации;
• срочно известить доступными способами руководство своего учреждения о выявлении подозрительного на натуральную оспу больного;
• собрать предварительные сведения о возможном источнике заражения и круге контактировавших с больными лиц.
Далее информация о выявлении подозрительного на натуральную оспу больного должна быть незамедлительно передана в местные и вышестоящие органы и учреждения санитарно-эпидемиологического надзора по подчиненности, Федерального медико-биологического агентства, отделы и управления здравоохранением по подчиненности, территориальные органы власти и заинтересованные ведомства.
Указанные органы направляют в очаг по месту выявления (или госпитализации) больного группу в составе эпидемиолога, опытного инфекциониста и вирусолога для верификации диагноза и эпидемиологического расследования.
Порядок проведения противоэпидемических и дезинфекционных мероприятий, направленных на обеспечение общественной и личной безопасности граждан при локализации и ликвидации очага (очагов) натуральной оспы при ее появлении на территории Российской Федерации вследствие биотеррористических акций или иных обстоятельств определен в МУ 3.1/3.5.2497-09 «Организация и проведение противоэпидемических и дезинфекционных мероприятий при натуральной оспе» [12].
4.1. Взятие проб осуществляют врачи вирусологи, прошедшие специальную подготовку и имеющие недавнюю (в пределах 3 лет) успешную прививку против оспы. Если к взятию проб привлекается невакцинированный сотрудник, то это может быть только тот, который не имеет противопоказаний к вакцинации. Последняя может потребоваться при подтверждении диагноза оспы. Для взятия проб необходимо иметь с собой упаковку с соответствующими стерильными инструментами, одноразовой пластиковой лабораторной посудой и материалами, перечень которых см. в приложении 1. Процедура взятия проб должна выполняться в соответствии с правилами противоэпидемического режима: работа в защитной одежде, маске, очках и перчатках, соблюдение мер личной и общественной безопасности и др. (см. СП 1.3.1285-03 «Безопасность работы с микроорганизмами I - II групп патогенности (опасности)») [8].
4.2. В качестве проб для диагностического исследования используют:
• содержимое кожных поражений (в зависимости от стадии болезни - везикул, пустул, корочки, соскоб со дна пузырьков, макул или папул);
• мазки с задней стенки глотки и миндалин;
• в случае смерти - кусочки органов умерших.
4.2.1. Для вирусологического и других исследований содержимое везикул или пустул отсасывают туберкулиновым шприцем, прокалывая стенку пузырька у его основания; для этой цели может использоваться игла, конец которой помещают над открытой пробиркой и несколько наклоняют его вниз, что облегчает отток жидкости. При недостаточной наполненности пузырьков в периоде подсыхания пустул для получения пробы применяют два способа. После вскрытия пузырька скальпелем или другим острым инструментом сбор остатков жидкости производят небольшими ватными тампонами (на коротком стержне), которые помещают затем в сухую пробирку, отламывая при необходимости стержни. При затруднении в использовании вышеописанного способа скальпелем или маленькими ножницами срезают верхушки пузырьков и помещают их в отдельную пробирку. Корочки отделяют глазным пинцетом.
Собранный из 6 - 10 однородных кожных элементов больного материал, как уже указывалось, помещают в пластиковые пробирки или флаконы с герметически завинчивающимися крышками. Крышки дополнительно фиксируют - например, парафинизированным полиэтиленом (парафильмом), липкой лентой, расплавленным парафином [14].
Взятие пробы для электронноскопического исследования производят путем легкого прикосновения подготовленной электронноскопической сеточки к основанию вскрытого пузырька (везикулы или пустулы). Используя этот же прием, следует сделать отпечатки на не менее чем трех сеточках, каждый раз несколько меняя давление на основание пузырька. Материал на сеточках должен просохнуть на воздухе. Сетки помещают в специальную коробку или ячейку коробки и записывают, какая ячейка использовалась для данного образца. Коробку обертывают фольгой или адгезивной пленкой.
Помимо этого, на обезжиренных предметных стеклах делают мазки соскоба или содержимого пузырьков, а также мазки-отпечатки с основания кожных элементов и мест удаления плотно «сидящих» корочек (по 2 - 3 мазка). Мазки высушивают на воздухе в течение 20 мин. Затем стекла маркируют, складывают таким образом, чтобы они не соприкасались между собой той стороной, на которой сделан мазок, и помещают их в специальную пластиковую коробку для стекол. Коробку заворачивают в фольгу или обертывают адгезивной пленкой.
Внимание! Мазки на предметных стеклах и электронноскопических сеточках могут быть сделаны у постели больного только в том случае, если у берущего пробы вирусолога имеются соответствующие навыки.
В противном случае это делается в диагностической лаборатории, куда будут направлены пробы.
4.2.2. При отсутствии у больного кожных поражений, что может иметь место в ранней стадии болезни или при некоторых формах оспы (оспа без сыпи, ранняя геморрагическая оспа), берут мазки с задней стенки глотки и миндалин. Процедуру осуществляют с помощью ватных тампонов на стержне, который затем опускают в пластиковую пробирку или флакон, не добавляя жидкости, и герметически ее закрывают. Мазки из зева следует брать и при недостаточном количестве материала из кожных поражений.
4.2.3. Кровь для обнаружения вируса берут из локтевой вены в количестве 4,5 мл шприцем, в который предварительно набирают 0,5 мл стерильного антикоагулянта. Кровь выливают в пробирку, которую осторожно встряхивают, чтобы предотвратить свёртывание крови, и герметично закрывают. Одновременно берут кровь (5 - 10 мл) для получения сыворотки, необходимой для серологического исследования, и 1 мл для проведения МПЦР.
4.3. Сразу после взятия пробы пробирки маркируют, указывая фамилию и инициалы больного, возраст, день болезни, вид материала (например, кровь, корочки и т.д.) и дату его взятия. Остальные сведения о больном (предполагаемый диагноз, дату поступления, вакцинный статус и пр. указывают в сопроводительной карточке (см. ниже раздел 5).
4.4. В случае смерти больного с подозрением на оспу при аутопсии берут фрагменты кожи с поражениями, кусочки лимфатических узлов и внутренних органов (легких, печени, почек, селезёнки) предпочтительнее с макроскопически видимыми поражениями отдельно для вирусологического и патогистологического исследования. В последнем случае кусочки органов размером до 1´2´3 см помещают в пластиковые флаконы, используя отдельный флакон для каждого кусочка, и заливают 8 мл 4 %-го раствора параформальдегида. Фиксация образцов в параформальдегиде обеспечивает их обеззараживание в течение 48 ч. Порядок обращения с образцами для вирусологического исследования аналогичен описанному в пп. 4.2, 4.3 и разделе 5.
4.5. После завершения сбора образцов от больного (больных) все инструменты и подсобные материалы, а также использованные средства индивидуальной защиты (перчатки, халат и пр.) дезинфицируют согласно требованиям СП 1.3.1285-03 «Безопасность работы с микроорганизмами I - II групп патогенности (опасности)» [8].
5. Упаковка и транспортирование проб для исследования
Упаковку и транспортировку проб для исследования осуществляют в соответствии с требованиями СП 1.2.036-95 «Порядок учета, хранения, передачи и транспортирования микроорганизмов I - IV групп патогенности» [9], МУ 3.4.2552-09 «Организация и проведение первичных противоэпидемических мероприятий в случаях выявления больного (трупа), подозрительного на заболевания инфекционными болезнями, вызывающими чрезвычайные ситуации в области санитарно-эпидемиологического благополучия населения» [13] и WHO/HSE/EPR/2008.10 «Рекомендации по правилам перевозки инфекционных материалов» [14].
Маркированные и герметично закрытые пробирки, флаконы с пробами и коробку с мазками от каждого больного помещают отдельно, перекладывая адсорбирующим материалом (например, ватой) в двойной пластиковый пакет, который затем заклеивают или запаивают. Количество адсорбирующего материала должно быть достаточным для того, чтобы поглотить всю жидкость в случае повреждения упаковки. Не допускается упаковка образцов материалов от разных людей в один и тот же пакет.
Заклеенные пакеты с образцами помещают в закрывающийся (с возможностью опломбирования) металлический или пластиковый контейнер, на дне которого размещают адсорбирующий материал (марлевая салфетка, ткань, вата и пр.), смоченный раствором дезинфицирующего средства.
Контейнер с материалом подписывают (фамилия, имя, отчество больного (больных), дата взятия и вид материала), опечатывают, помещают в специальный переносной термоизолирующий контейнер, укомплектованный охлаждающими элементами, и транспортируют в лаборатории, указанные выше (см. п. 3.6). Транспортирование осуществляется нарочным, информированным о правилах доставки материала.
Сопроводительные документы составляют в двух экземплярах: один отправляют вместе с пробами в лабораторию, второй (копия) остается у лица, направляющего пробы на исследование. В сопроводительном документе указывают фамилию, имя, отчество, возраст больного, диагноз, даты начала заболевания, появления сыпи, взятия материала, характера материала для исследования, фамилию врача, взявшего пробы. Указывают, был ли привит заболевший против оспы и примерную дату вакцинации, отмечают наличие или отсутствие рубцов после вакцинации, характер контакта с предполагаемым источником инфекции. Указывают адрес места назначения, адрес, фамилию и телефон отправителя. Делается надпись: «Инфекционный материал». Перед транспортированием срочно извещают специализированную лабораторию, в которую направляется материал.
6. Порядок исследования
Все работы по проведению исследования материала проводят с соблюдением требований СП 1.3.1285-03 «Безопасность работы с микроорганизмами I - II групп патогенности (опасности)» [8].
Схема проведения лабораторного исследования приведена на рис. 3 (прилож. 8).
6.1. Учитывая, что фактор времени при появлении оспы имеет огромное значение для эффективности противоэпидемических мероприятий, обработка и исследование взятых у больных (или подозреваемых на заболевание) проб должны начинаться немедленно после поступления материала в лабораторию. В ФБУН ГНЦ ВБ «Вектор» исследование начинают одновременно методами ускоренной диагностики, включая электронную микроскопию, и путем выделения возбудителя. В других лабораториях, имеющих соответствующую лицензию, используют молекулярно-генетические и иммунологические методы ускоренной диагностики.
К методам ускоренной диагностики относятся:
• электронная микроскопия содержимого кожных поражений и мазков из глотки;
• обнаружение ортопоксвирусного антигена в обработанных пробах с помощью соответствующей тест-системы ИФА;
• выявления антител к ортопоксвирусам в сыворотке крови в соответствующей тест-системе ИФА;
• полимеразно-цепная реакция (ПЦР), в т.ч. мультиплексная полимеразная цепная реакция (МПЦР).
Проведение исследования с помощью электронной микроскопии и иммуноферментного анализа позволяет дать ответ в течение 2 - 4 ч после начала исследования. (Если используется набор реагентов для ИФА с планшетами, требующими предварительной сенсибилизации, то время проведения ИФА увеличивается до 22 - 26 ч). Эти методы не позволяют дифференцировать вирус оспы от других патогенных для человека ортопоксвирусов (вирусов вакцины, оспы обезьян и оспы коров). МПЦР обеспечивает не только идентификацию ДНК вируса оспы, но и ее дифференциацию от близкородственных патогенных для человека ортопоксвирусов. Время проведения теста 5 - 6 ч.
6.2. Обнаружение при электронной микроскопии вирионов группы герпеса при отсутствии вирионов оспенной группы и ортопоксвирусного антигена позволяет дать заключение о герпетической природе заболевания. При наличии в исследуемом материале ортопоксвирусных вирионов и/или ортопоксвирусного антигена внутривидовая дифференциация осуществляется с помощью МПЦР.
6.3. Для подтверждения диагноза и всесторонней характеристики возбудителя проводят выделение возбудителя на куриных эмбрионах или в культуре клеток.
6.4. При необходимости установления диагноза при отсутствии соответствующих тест-систем ИФА и невозможности исследовать пробу с помощью МПЦР можно использовать вспомогательные методы, описанные в разделе 10.
7. Подготовка для исследований взятых у больных проб
При подготовке проб следует учесть необходимость сохранить часть материала для контрольных и повторных исследований.
7.1. Для электронной микроскопии везикулярную и пустулезную жидкости исследуют неразведенными и в разведении 1:5 (на дистиллированной воде). При исследовании корок, их (в количестве 1 - 2) растирают в маленькой фарфоровой ступке или помещают на часовое стекло, покрывают 1 - 2 каплями дистиллированной воды, через 5 - 10 мин измельчают скальпелем и слегка растирают. Жидкая фракция представляет собой материал для исследования.
Мазки-отпечатки или мазки соскобов со дня пузырьков, макул или папул смывают 1 - 2 каплями дистиллированной воды и полученную взвесь используют для приготовления препаратов для электронноскопического исследования (негативное контрастирование). Последние готовят следующим образом. На покрытое парафином предметное стекло помещают последовательно три капли: 1) исследуемого материала; 2) дистиллированной воды и 3) 2 %-го раствора фосфорно-вольфрамовой кислоты с рН 7,0. Заранее подготовленную (покрытую формваром или парлодием и напыленную углем) сетку для адсорбции вируса опускают на 30 - 60 с в каплю исследуемого материала, затем (для промывки) на 3 с в каплю дистиллированной воды и для контрастирования препарата на 30 - 40 с в каплю фосфорно-вольфрамовой кислоты. После каждого погружения сетку просушивают лёгким прикосновением её края к фильтрованной бумаге*.
______________
* Обычно используют сетки, предназначенные для исследований взвесей. Их приготовление описано в прилож. 2.
Электронноскопические сетки, на которые была нанесена проба у постели больного, следует обрабатывать, начиная с промывки*.
______________
* Для негативного контрастирования может быть использован также насыщенный водный или спиртовый раствор уранилацетата.
Если в зоне повышенной безопасности нет электронного микроскопа, то перед выносом сеток для просмотра их обеззараживают парами 37 %-го формальдегида и ультрафиолетовым облучением. Один из способов описан ниже. В 60 мм чашку Петри, содержащую приготовленные сетки, помещают небольшой пластиковый контейнер (15 мм в диаметре) с 10 каплями концентрированного (37 %-го) раствора формальдегида. Чашку Петри закрывают и ставят в большую (150 мм) чашку Петри без крышки, куда налит тонкий слой 5 %-го раствора хлорамина. Все помещается в предназначенное окно под ультрафиолетовые лучи. Источник облучения 15W ультрафиолетовая лампа, расстояние до объекта 5 см, время облучения 30 мин.
7.2. Для выявления ортопоксвирусного антигена в ИФА используют корки, жидкость из пузырьков, соскобы с кожных элементов, кровь, мазки из зева, кусочки органов умерших: корки, соскобы и кусочки органов гомогенизируют и добавляют физиологический раствор или фосфатно-цитратный буфер Мак-Ильвейна (рН 7,2; см. прилож. 3) в количестве, необходимом для получения суспензий в разведении примерно 1:5 - 1:50. Везикулярную и пустулезную жидкости используют цельными или, в зависимости от количества материала, разведенными 1:5 - 1:50.
Взятую для выделения вируса кровь (со стерильным антикоагулянтом) центрифугируют при 450 g; плазму и светлый (лейкоцитарный) слой отсасывают раздельно, каждую фракцию разводят 1:2 буферным раствором Мак-Ильвейна (рН 7,2) и исследуют по отдельности.
Тампоны с отделяемым зева смывают 1,0 мл физиологического раствора или фосфатно-солевого буфера и исследуют.
7.3. Эти же подготовленные материалы используют для молекулярно-биологического исследования, изоляции вируса в клеточной культуре или куриных эмбрионов и других тестов (см. далее).
Перед заражением эмбрионов или культуры клеток в исследуемые материалы добавляют антибиотики (пенициллин, гентамицин или другие) в везикулярную жидкость и кровь - в расчете 200 ед./мл, в остальные материалы - по 500 ед./мл.
7.4. Для выявления антител к ортопоксвирусам из взятой для этой цели порции крови отсасывается сыворотка, которая исследуется в соответствующей тест-системе ИФА.
8. Лабораторное исследование
8.1. Методы ускоренной диагностики
8.1.1. Электронная микроскопия (метод негативного контрастирования)
Просмотр подготовленных сеток проводят при увеличении 15000 - 20000. Обнаружение ортопоксвирусов осуществляется по характерной форме, структуре и размеру вирионов. Форма ортопоксвирусов может быть кирпичеобразной, либо овальной, размер 200´300 нм. Следует иметь в виду, что иногда вирионы адсорбируются на сетку меньшей плоскостью (торцом), и тогда они имеют вид округлых частиц диаметром около 150 нм.
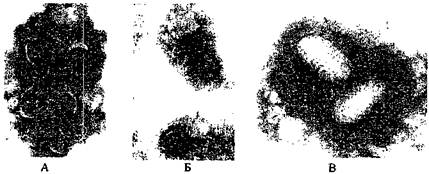
Как правило, у большинства вирионов внутренняя структура не выявляется. Вместе с тем, у некоторых обнаруживается двухслойная наружная мембрана, разделённая электроннооптически плотным пространством, заполненным фосфорно-вольфрамовой кислотой, у других - на поверхности видны характерные удлиненные трубчатые структуры. Во внутренней полости вириона находится нуклеоид, который выявляется как структура низкой электроннооптической плотности (светлое образование двояковогнутой формы на тёмном фоне перенуклеоидного пространства, заполненного фосфорно-вольфрамовой кислотой). Вирионы могут располагаться по одиночкам или группами. Главными критериями (кроме формы и размеров), облегчающими идентификацию ортопоксвирусов, являются наличие поверхностных трубочек и нуклео-ида характерной двояковогнутой формы (рис. 1).
При проведении диагностических электронноскопических исследований могут быть выявлены возбудители заболеваний, протекающих с кожными поражениями. К их числу относятся вирусы группы герпеса (ветряной оспы, простого герпеса) и парапоксвирусы (рис. 2). Первые имеют меньшие размеры (110 - 120 нм), округлую форму и сферический нуклеоид. Неповреждённые вирионы группы герпеса окружены внешней оболочкой, имеющей неправильную форму с выступами (рис. 2). Вирионы парапоксвируса имеют не кирпичеобразную, а овоидную форму, меньшие размеры и отличаются от ортопоксвирусов характером поверхностного рельефа. При обнаружении вирионов их детальное изучение проводят при увеличении 50000 и более.
На рис. 1 приведен вид ортопоксвирусов при негативном контрастировании.
Рис. 1. Вирионы ортопоксвирусов
Рис. 2. Вирионы вируса ветряной оспы (А и Б) и вирионы парапоксвируса (В)
А - вирус ветряной оспы с наружной оболочкой-конвертом при увеличении 100000;
Б - тот же вирус без наружной оболочки при увеличении 168000;
В - вирионы парапоксвирусов (паравакцины)
Заключение о результатах исследования основывается на данных просмотра не менее 2 сеток от больного. Обнаружение 3 и более вирионов с характерной для ортопоксвирусов морфологией считается достаточным для заключения о наличии в материале ортопоксвирусов. Для отрицательного заключения в каждой из двух сеток просматривают не менее 1/4 ячеек в течение 30 мин.
Иммунная электронная микроскопия
Эффективность выявления возбудителей вирусных инфекций многократно возрастает при обработке материала специфической сывороткой - использовании так называемой иммунной электронной микроскопии (ИЭМ). Метод позволяет увеличить количество выявляемых вирионов, обнаруживать их уже на первых минутах просмотра, а также выявлять вирус в препаратах с низкой его концентрацией. Приготовление препаратов для иммунной электронной микроскопии производится следующим образом. Готовят 4 %-й агар «Difco» на физиологическом растворе или фосфатно-солевом буфере (рН 7,2) путём нагревания флакона в кипящей водяной бане. Агар растапливают и охлаждают до 56 °С, затем смешивают с равным объёмом сыворотки кролика, гипериммунизированного вирусом вакцины, в разведении 1:12 и 1:24 (разведения делают на фосфатно-солевом буфере - рН 7,2). Полученные смеси после тщательного перемешивания разливают в лунки полистироловых пластин (до края лунки) и маркируют. После застывания агара на его поверхность наносится по 25 - 30 мкл исследуемого материала.
На каплю помещается две - три электронноскопических сеточки, покрытые формваровой подложкой, стабилизированной углеродом. В таком виде материал оставляют на 25 - 30 мин при комнатной температуре. Затем сеточки снимают, излишек жидкости удаляют фильтровальной бумагой и помещают в каплю раствора 2 %-й фосфорно-вольфрамовой кислоты (рН 7,0) на 1 - 2 мин.
Обычно при ортопоксвирусных инфекциях в первые 10 мин просмотра обнаруживаются скопления вирионов ортопоксвируса. Условия для отрицательного заключения те же (см. п. 8.1.1).
8.1.2. Иммуноферментный анализ (ИФА) для выявления антигена ортопоксвирусов
Иммуноферментный анализ (ИФА) основан на специфическом взаимодействии антигена и антитела с предварительной иммобилизацией (фиксацией) одного из компонентов реакции (антигена или антител) на твердофазном носителе (в лунках полистироловых планшетов, стрипов и др.) и выявления образовавшегося комплекса антиген-антитело посредством ферментной метки (конъюгата). Выявление образовавшегося комплекса осуществляется по изменению интенсивности окраски (оптической плотности) субстратной смеси, содержащей вещество, с которым реагирует фермент, и индикатор, изменяющий цвет под действием продуктов реакции фермент-субстрат.
Для детекции антигена ортопоксвирусов в материалах от больных используют иммуноферментные тест-системы для выявления антигена ортопоксвирусов, зарегистрированные в Российской Федерации в установленном порядке. Эти наборы реагентов предназначены для выявления антигена ортопоксвирусов (натуральной оспы, оспы обезьян, оспы коров, вакцины и др.) в везикулярной и пустулёзной жидкостях, суспензии корок и других материалах, полученных от людей и животных, в культуральной жидкости инфицированных клеточных культур. Детальное описание постановки ИФА, учёта и оценки результатов приводится в соответствующей инструкции по применению наборов реагентов.
8.1.3. Иммуноферментный анализ (ИФА) для выявления антител к ортопоксвирусам
Этот тест, основанный на выявлении IgG антител, может оказаться полезным, начиная с 4 - 5 дня болезни. Обнаружение у ранее невакцинированных против оспы лиц даже невысоких титров антител (80 - 160) указывает на наличие ортопоксвирусной инфекции. У вакцинированных в прошлом только высокие титры антител (640 и выше) могут свидетельствовать о свежей ортопоксвирусной инфекции. Для подтверждения наличия свежей инфекции в неясных случаях проводят повторное исследование сыворотки, взятой спустя несколько дней после первой пробы. При этом 2 - 4-кратное нарастание титра антител подтверждает диагноз.
Осуществление данного исследования производится в соответствии с инструкциями по применению иммуноферментных тест-систем для определения антител к ортопоксвирусам, зарегистрированных в Российской Федерации в установленном порядке.
Для целей возможно более ранней серологической диагностики ортопоксвирусных инфекций используют выявление в ИФА IgM антител (так называемых «ранних»), появление которых в сыворотке крови предшествует IgG антителам.
8.1.4. Выявление (индикация) вируса натуральной оспы и других патогенных для человека ортопоксвирусов методом полимеразной цепной реакции (ПЦР)
ПЦР применима для ускоренной диагностики при исследовании клинических образцов на наличие ДНК вируса натуральной оспы и для идентификации культуры выделенного вируса.
В данных МУ приведена методика, которая позволяет идентифицировать ДНК вируса оспы в клинических образцах и дифференцировать её от таковой близкородственных патогенных для человека ортопоксвирусов: оспы обезьян, оспы коров и вакцины с помощью набора реагентов для выявления ДНК вирусов натуральной оспы, оспы обезьян, оспы коров, осповакцины методом мультиплексной полимеразной цепной реакции.
Методика мультиплексной полимеразной цепной реакции (МПЦР) является вариантом классической ПЦР с анализом продуктов амплификации с помощью гель-электрофореза в агарозном геле, однако позволяет в одном анализе идентифицировать ДНК четырех видов ортопоксвирусов, в том числе ДНК вируса оспы в клинических образцах и дифференцировать её от таковой близкородственных патогенных для человека ортопоксвирусов: оспы обезьян, оспы коров и вакцины. Мультипраймерная система состоит из пяти пар праймеров, один из которых является родоспецифичным. Остальные пары праймеров являются видоспецифичными и при амплификации дают продукты длины, характерной для вирусов натуральной оспы, оспы обезьян, оспы коров, осповакцины.
Требования к организации работ при проведении исследований с использованием МПЦР приведены в МУ 1.3.2569-09 «Организация работы лабораторий, использующих методы амплификации нуклеиновых кислот при работе с материалом, содержащим микроорганизмы I - IV групп патогенности» [10] и СП 1.3.1285-03 «Безопасность работы с микроорганизмами I - II групп патогенности (опасности)» [8].
Сотрудники, выполняющие МПЦР с материалом, подозрительным на зараженность вирусом оспы, также как и другие, работающие с этим вирусом, подлежат обязательной вакцинации в соответствии с МУ 3.3.1.2044-06 «Вакцинопрофилактика натуральной оспы» [11].
Проведение анализа
Выявление ДНК ортопоксвирусов с помощью МПЦР включает три стадии. На первой стадии после первичной подготовки проб проводят выделение ДНК из клинических образцов методом фенольной экстракции после разрушения клеток и вирусных частиц протеиназой К. Работа по выполнению этой стадии проводится в помещениях «заразной» зоны при соблюдении условий, указанных в СП 1.3.1285-03 [8] и МУ 1.3.2569-09 [10]. На второй стадии проводят реакцию МПЦР с выделенной ДНК. На третьей стадии проводят детекцию амплифицированной ДНК после гель-электрофореза в агарозном геле с визуализацией полос в УФ-свете после окраски геля бромистым этидием. Обе последние стадии могут проводиться за пределами «заразной» зоны в ПЦР-боксе в защитном костюме IV типа, дополненном резиновыми перчатками, с соблюдением правил выноса предметов из «заразной» зоны (внешняя обработка контейнера).
МПЦР представляет собой многократно повторяющиеся циклы синтеза (амплификацию) специфичной области ДНК-мишени в присутствии термостабильной ДНК-полимеразы, дезоксинуклеозидтрифосфатов (дНТФ), соответствующего солевого буфера и олигонуклеотидных затравок-праймеров, определяющих границы амплифицируемого участка ДНК. В ходе МПЦР происходит амплификация только с помощью той пары праймеров, которая видоспецифична к ДНК-мишени, присутствующей в клиническом образце. Одна пара праймеров в смеси обеспечивает родоспецифичную амплификацию фрагмента размером 294 п.н. на ДНК любых видов ортопоксвирусов (дополнительный внутренний контроль).
Каждый цикл состоит из трех стадий с различными температурными режимами. На первой стадии при 93 °С происходит разделение цепей ДНК, затем при 62 °С - присоединение (отжиг) праймеров к гомологичным последовательностям на ДНК-мишени, на третьей стадии при температуре 72 °С - синтез новых цепей ДНК путем удлинения праймеров в направлении 3 конца. В каждом цикле происходит удвоение числа копий амплифицируемого участка, ограниченного парой выбранных праймеров, что позволяет за 30 циклов наработать ДНК в количестве, достаточном для ее детекции с помощью электрофореза.
Выделение ДНК, постановка МПЦР, оценка результатов
Выделение ДНК, постановку МПЦР и оценку результатов проводят по соответствующей инструкции по применению диагностической тест-системы для проведения МПЦР, зарегистрированной в Российской Федерации установленным порядком.
Список рекомендованного оборудования для проведения МПЦР приведен в прилож. 4. После выделения ДНК материал передают для проведения МПЦР. Передача материала осуществляется с соблюдением правил выноса предметов из «заразной» зоны (внешняя обработка контейнера) согласно СП 1.3.1285-03 «Безопасность работы с микроорганизмами I - II групп патогенности (опасности)» [8].
Для анализа результатов используют трансиллюминатор. Фрагменты анализируемой ДНК должны проявиться в виде светящихся оранжево-красных полос.
1. Положительный контроль (К+) - должны выявляться специфичные полосы размером 832, 581,492, 421, 294, 200 пар нуклеотидов:
|
Длина продукта амплификации, пар нуклеотидов (п.н.) |
Видовая идентификация |
|
832 (ЦА)** |
Вирус оспы обезьян (Monkeypox virus) |
|
581 (ЗА)* |
|
|
492 |
Вирус вакцины (Vaccinia virus) |
|
421 |
Вирус оспы коров (Cowpox virus) |
|
294 |
Родоспецифичный фрагмент (Orthopoxvirus) |
|
200 |
Вирус натуральной оспы (Variola virus) |
|
* ЗА - Западноафриканский вариант вируса оспы обезьян ** ЦА - Центральноафриканский вариант вируса оспы обезьян |
|
2. Отрицательный контроль (К*) - полосы должны отсутствовать.
3. Анализируемые пробы - отсутствие полос строго на уровне положительного контроля свидетельствует об отрицательном ответе. Наличие полосы, соответствующей по размеру специфичному фрагменту в положительном контроле для какого-либо вида ортопоксвируса, свидетельствует о наличии в пробе ДНК данного вида ортопоксвируса. Внимание! Наличие полос ампликонов, располагающихся выше или ниже контрольных полос, является неспецифичным ответом и результат реакции оценивается как отрицательный.
Результаты анализа не подлежат учету:
• если в положительном контроле отсутствуют специфичные полосы (ошибка в постановке ПЦР, неправильное хранение или загрязнение реактивов в процессе работы, сбой программы амплификатора). Требуется повторная постановка реакции!
• если в отрицательном контроле выявляются специфичные полосы на уровне положительного контроля (контаминация реактивов пробположительной ДНК или продуктами амплификации). Необходимо использовать дополнительные отрицательные контроли при повторной постановке ПЦР. Если результат повторяется - необходимо сменить реактивы!
Действия при возникновении ДНК-контаминации
При проведении ПЦР-анализа в случаях несоблюдения вышеуказанных требований возможно получение ложноположительных результатов. К их появлению ведет ДНК-контаминация - попадание в реакционную смесь положительно реагирующих в ПЦР нуклеиновых кислот (из исследуемых образцов, положительных контролей, продуктов амплификации - ампликонов). Ампликоны могут накапливаться на лабораторном оборудовании, одежде, поверхности кожи сотрудников и легко переноситься аэрозольным путем. О наличии контаминации свидетельствует положительный ответ в отрицательном контроле. В этом случае необходимо повторить анализ, начиная с этапа выделения ДНК.
В случаях повторных положительных ответов в отрицательном контроле производят замену всех используемых для данного анализа реактивов, как на этапе подготовки проб, так и при проведении ПЦР, обрабатывают рабочие поверхности столов, приборов, штативов, автоматических пипеток 1N раствором соляной кислоты; облучают помещение УФ в течение 1,5 л. Заменяют рабочую одежду, набор инвентаря для уборки и приостанавливают работу в данном помещении до проведения указанных мер.
Режимы обеззараживания различных объектов при лабораторной диагностике натуральной оспы методом МПЦР приведены в СП 1.3.1285-03 «Безопасность работы с микроорганизмами I - II групп патогенности (опасности)» [8] и МУ 1.3.2569-09 «Организация работы лабораторий, использующих методы амплификации нуклеиновых кислот при работе с материалом, содержащим микроорганизмы I - IV групп патогенности» [10].
8.2. Выделение возбудителя
Может осуществляться на куриных эмбрионах или в культуре клеток.
8.2.1. Выделение вируса на куриных эмбрионах
Используют хорошо развитые эмбрионы 12-дневного возраста. Эмбрионы готовят к заражению следующим образом. Во время просмотра (осуществляется в затемнённой комнате, пучок света должен падать сверху на тупой конец яйца) делают отметку простым карандашом в центре воздушного мешка. Затем поворачивают яйцо острым концом вверх и замечают место, где белок занимает наибольшее пространство. На противоположной этому месту стороне делают отметку для пропиливания, выбирая участок между двумя сосудами и их ответвлениями. Метку ставят между ветвями соседних вен, но не на самих сосудах.
Пропиливание осуществляется сепарационным вулканитовым диском бормашины, а при её отсутствии - любым инструментом типа маленького напильника. Одно отверстие пропиливают в центре воздушного мешка, второе - очень осторожно во избежание кровоизлияний - по отметке и боковой стороне яйца. Необходимо следить, чтобы была пропилена скорлупа и не затронута подскорлупная оболочка. Величина отверстий: длина - 3 - 4 мм, ширина - 1,5 мм. После пропиливания отверстий яйца укладывают на бок таким образом, чтобы отверстие на боковой поверхности было обращено вверх.
Подскорлупную оболочку в отверстии в центре воздушного мешка прорывают изогнутой хирургической иглой. Затем на боковое отверстие наносят 0,1 мл буферного раствора, подогретого (в водяной бане) до 50° и той же иглой очень осторожно расслаивают (продавливают) подскорлупную оболочку для образования маленькой щели, через которую под подскорлупную оболочку проходит капля буферного раствора. Последняя частично отслаивает хориоаллантоисную оболочку (ХАО). Полное её опускание происходит после отсасывания воздуха с помощью резиновой груши через отверстие в центре естественного воздушного мешка. Для контроля наличия и величины искусственных воздушных мешков яйца снова просвечивают и отбрасывают все, имеющие кровоизлияния и с воздушным мешком под ХАО и без искусственных воздушных мешков.
Подготовленные яйца (с опущенной ХАО) должны находиться до заражения в термостате в течение 2 ч. Для заражения используют материал от больного в исходном разведении, а также в разведениях 10-2 - 10-5.
После введения инокулята материал равномерно распределяют по оболочке осторожным круговым вращением яйца.
Отверстие на боковой стороне яйца заклеивают липким пластырем с таким расчетом, чтобы оставалась как бы склеенная петля, за которую можно было бы держать яйцо при вскрытии. Яйца укладывают на бок (вверх заклеенным отверстием).
Заражение производят с соблюдением правил асептики. На каждый материал, предварительно обработанный антибиотиками, используют по 2 - 3 эмбриона на разведение. Инкубацию зараженных эмбрионов проводят при температуре 34,5 - 35,0 °С в течение 72 ч.
Вскрытие производят над посудой с высокими краями на четверть заполненную 5 %-м раствором хлорамина. Одной рукой берут яйцо за петлю липкого пластыря, которым заклеено отверстие над искусственным воздушным мешком. В другую руку берут прямые глазные ножницы. Браншу ножниц вставляют в отверстие над воздушным мешком и осторожно удаляют половину скорлупы, противоположную месту инокуляции, а также все содержимое яйца, за исключением части ХАО, принадлежащей к искусственному мешку (место инокуляции). Последнюю отделяют пинцетом, промывают физиологическим раствором и просматривают в чашке Петри на наличие поражений (на чёрном фоне), отмечают также состояние эмбриона (живой или погибший).
При наличии вируса оспы на ХАО обнаруживаются мелкие (размером около 1 мм в диаметре к 72 ч) белые точечные резко ограниченные возвышающиеся оспины. Их своеобразный характер существенно отличается от поражений, вызываемых другими патогенными для человека ортопоксвирусами. Так, вирус вакцины образует более плоские поражения, имеющие большие размеры (до 3 - 4 мм в диаметре к 72 ч инкубации). Вирус оспы коров образует поражения, сходные с вакцинными, но отличающиеся резко геморрагическим характером («красные» оспины). Вирус оспы обезьян вызывает поражения, по размерам напоминающие оспенные, но имеющие геморрагии в центре. Кроме того, среди основной массы типичных для вирусов оспы коров и оспы обезьян поражений встречается около 1 % более крупных белых оспин без геморрагии.
Вирусы вакцины, оспы коров и оспы обезьян также более патогенны для куриных эмбрионов, чем вирус натуральной оспы: при введении на ХАО 106 - 107 ООЕ/0,1 мл этих вирусов они, как правило, вызывают гибель куриных эмбрионов. При отсутствии бактериального загрязнения зараженные вирусом оспы эмбрионы, как правило, не погибают. Если в качестве исследуемых проб используют материал из кожных поражений в указанных выше разведениях, положительный результат получают через 72 ч после заражения без проведения пассажа. Пассаж делают при малом количестве материала для исследования и отсутствии поражений на ХАО при первичном заражении. Для этого извлечённые ХАО измельчают и приготовляют суспензию на физиологическом или буферном растворе из расчёта 1:3 - 1:5. Суспензию центрифугируют 10 мин при 2000 об./мин, надосадочную жидкость используют для заражения куриных эмбрионов.
При отсутствии специфических поражений результат выделения признают отрицательным.
Вирус оспы может быть также выделен из лейкоцитарной фракции или плазмы крови (особенно при тяжёлом течении) в первые дни болезни. В отделяемом зева он обнаруживается в первые 1 - 2 дня болезни до появления сыпи нерегулярно и в последующем выделяется с момента появления до исчезновения элементов на слизистой. Выделение вируса оспы из крови и отделяемого зева при отсутствии кожных поражений чаше имеет место при проведении пассажа. Отрицательный результат выделения вируса из этих материалов не исключает заболевания.
8.2.2. Выделение вируса в однослойной культуре клеток
Для выделения вируса оспы могут быть использованы первичные и перевиваемые клеточные культуры различного происхождения: полученные от человека (фибробласты эмбриона человека, почки, амниотическая ткань), обезьяны, свиньи и др. Предпочтительнее использовать первичные клеточные культуры эпителиального характера, медленнее дегенерирующие и с более наглядной картиной цитопатического действия вируса (ЦПД). Обработанный антибиотиками исследуемый материал вносят (по 0,1 мл) в 4 - 6 пробирок с образовавшимся клеточным монослоем, в том числе желательно в 2 - 3 пробирки со стеклянными пластинками* (для возможно более раннего выявления ортопоксвирусного антигена с помощью МФА). Часть пробирок с незараженной культурой оставляют в качестве контроля. Пробирки инкубируют при температуре 36 °С и ежедневно оценивают состояние монослоя при малом увеличении микроскопа.
______________
* Метод обработки стеклянных пластин указан в прилож. 5.
При достаточной концентрации вируса оспы ЦПД в первичной культуре клеток отмечается, как правило, уже в первые сутки после заражения культуры. В сплошном клеточном монослое появляются очаги округлых клеток с чёткими границами и зеркальной поверхностью (сильно преломляют лучи света); такие клетки часто увеличены в размере («гигантские»). В последующем скопления округлых клеток увеличиваются, клетки обособляются, прорывая монослой; постепенно клеточный пласт превращается в скопления очагов округлых клеток при наличии участков неизмененных клеток монослоя между ними вплоть до полного поражения клеток всего пласта.
Клеточные культуры перевиваемых линий реагируют на заражение вирусом оспы пролиферативным типом поражений - вирус вызывает усиленное размножение клеток, что проявляется в образовании гиперпластических фокусов, участков многослойного роста. Они выглядят как компактные клеточные нагромождения, усиленно преломляющие свет («зеркальные»). Размеры пролиферативных очагов и их количество постепенно увеличиваются, округлые дегенеративные клетки становятся зернистыми, нарушается целостность монослоя и затем происходит деструкция всего пласта.
При нечётко выраженных цитопатических изменениях проводят пассаж - вторую партию клеточных культур заражают взвесью клеток в культуральной жидкости (после проведения трёхкратного цикла замораживания и оттаивания культур). Однако, длительное (до 7 дней) наблюдение за зараженной культурой более эффективно, чем проведение «слепых» пассажей.
ЦПД вируса оспы и вируса вакцины имеет специфические особенности, что позволяет дифференцировать их в клеточной культуре. Для вируса вакцины характерен ускоренный темп развития клеточных поражений при отсутствии очаговости (за исключением начальной стадии ЦПД при малых дозах заражения), с распространением ЦПД на весь клеточный пласт и быстрым наступлением тотальной дегенерации культуры (через 1 - 2 дня). Наблюдается стертость клеточных границ, образование симпластов, сохранение цитоплазматических мостиков и др.
Для подтверждения специфичности ЦПД (для ортопоксвирусов), а также дифференциации от ЦПД вируса герпеса, можно использовать реакцию гемадсорбции. Для этого надо удалить культуральную жидкость из части заражённых и контрольных пробирок (по 2 пробирки, которые после постановки реакции уничтожаются) и добавить к клеткам по 0,2 мл 0,5 % взвеси куриных эритроцитов*. Пробирки выдерживают в горизонтальном положении 10 мин, после чего их просматривают при малом увеличении микроскопа. При положительном феномене гемадсорбции наблюдаются скопления адсорбированных клетками эритроцитов («ожерелья» из эритроцитов по контурам и на поверхности клеток), которые не удаляются при промывании клеточного пласта физиологическим раствором хлористого натрия (1 мл). Феномен гемадсорбции отрицателен (отсутствие ортопоксвирусов), если эритроциты не оседают на клетках, а свободно перемещаются в поле зрения микроскопа и удаляются при промывании. Клеточный пласт в контрольной (незараженной) культуре клеток должен оставаться свободным от скоплений адсорбированных эритроцитов. Феномен гемадсорбции обычно опережает видимое ЦПД вируса оспы (в культурах человеческого происхождения и почек обезьян). Вирус герпеса не даёт феномена гемадсорбции. При отсутствии ЦПД в течение 7 дней наблюдения и отрицательной реакции гемадсорбции результат выделения вируса считается отрицательным.
______________
* Для постановки этой и других реакций следует использовать петухов-доноров, эритроциты которых чувствительны к воздействию ортопоксвирусов.
Для быстрого обнаружения вируса в культуре клеток и его серологической идентификации используют метод флюоресцирующих антител (МФА). С этой целью стеклянные пластинки вынимают через 12 - 24 ч после заражения культуры, отмывают от среды фосфатно-буферным раствором и после заключительного промывания в дистиллированной воде производят их фиксацию и окраску противооспенным люминесцирующим иммуноглобулином, как это описано в разделе 10.
При этом контролем служит: 1) незараженная культура клеток, окрашенная смесью гомологичного конъюгата и бычьего альбумина и 2) зараженная культура клеток, окрашенная смесью гетерологичного конъюгата и бычьего альбумина.
Препараты просматривают в люминесцентном микроскопе с использованием объектива ´40 и ´90.
Положительный ответ дают на основании обнаружения в клеточном пласте, окрашенном в оранжево-коричневатый цвет, клеток с ярко-зеленой, перинуклеарной флюоресценцией в цитоплазме, обусловленной наличием антигена ортопоксвирусов. В контрольных препаратах зелёное свечение должно отсутствовать.
При выделении в культуре клеток дифференцировать ортопоксвирусы возможно при использовании дополнительных приёмов дифференциации (см. ниже). Отрицательный ответ дают при отсутствии специфического свечения в культурах при первичном заражении и пассаже.
9. Критерии дифференциации вируса оспы от вирусов, вызывающих заболевания, сопровождающиеся кожными проявлениями
9.1. Дифференциация от вирусов группы герпеса (вируса ветряной оспы и вируса простого герпеса)
Осуществляется при электронной микроскопии по характерной форме и размеру вирусных частиц. Кроме того, вирусы группы герпеса дают отрицательный результат в ИФА при выявлении антигена ортопоксвирусов. При наличии вирусов герпеса отсутствует ярко-зелёная флюоресценция при окраске препаратов противооспенным люминесцирующим иммуноглобулином.
При выделении на куриных эмбрионах вирус ветряной оспы не вызывает поражений на ХАО. Некоторые штаммы вируса герпеса простого вызывают поражения, трудно отличимые от оспенных. Дифференциация вирусов в таких случаях проводится на основании исследования суспензии пораженной оболочки в ИФА.
При выделении вируса в культуре клеток дифференциацию ортопоксвирусов от вирусов герпеса проводят на основе отсутствия гемадсорбции и/или свечения при использовании МФА с противооспенным люминесцирующим иммуноглобулином.
9.2. Дифференциация вируса натуральной оспы от других патогенных для человека ортопоксвирусов (вакцины, оспы коров, оспы обезьян)
Основным методом дифференциации (кроме МПЦР) является характер поражений (оспин) на ХАО куриных эмбрионов (см. выше п. 8.2.1).
При выделении вируса в культуре клеток или в случаях, когда характер поражений на ХАО куриных эмбрионов не позволяет решить вопрос, каким ортопоксвирусом они вызваны, прибегают к дополнительному приёму дифференциации. С этой целью выделенную культуру вируса исследуют на способность вызывать реакцию на коже кроликов (заражение на скарифицированный участок).
Заражение кроликов на скарифицированную кожу
Нанесение вируса оспы на скарифицированный участок выстриженной кожи кролика (размер участка 2,5´2,5 см, объём инокулюма - 0,2 мл) не приводит к развитию специфических элементов. На месте нанесения вируса к 3 - 5 дню после заражения остаются лишь сухие бледные царапины (след от скарификации кожи). В противоположность этому вирус вакцины вызывает образование сочных характерных специфических элементов (папул, пустул), зачастую сливающихся между собой и образующих к 3 - 5 дню после заражения как бы «подушку», выступающую над поверхностью незараженной кожи. Вирус оспы коров и оспы обезьян образует элементы, аналогичные вакцинным, но отличающиеся выраженным геморрагическим характером.
10. Вспомогательные методы
Речь идет о диагностических приемах, которые могут быть использованы при отсутствии ряда описанных выше приборов и реагентов.
10.1. Метод флюоресцирующих антител (МФА)
Метод флюоресцирующих антител для выявления возбудителя непосредственно в материале от больных.
Метод используют для быстрого обнаружения антигена ортопоксвирусов на ранних стадиях заболевания (до появления пустул!). Содержимое кожных элементов - мазки соскобов или отпечатки со дна везикул, макул, папул, мазки везикулярной жидкости на предметных стеклах фиксируют в охлаждённом ацетоне (х.ч.) в течение 10 мин. После 5-минутного просушивания их окрашивают смесью равных объёмов люминесцирующего оспенного иммуноглобулина и бычьего альбумина, меченого фторидом сульфородамина (прилож. 6), разведенных предварительно до «рабочего» разведения (см. соответствующую инструкцию по применению).
Обнаружение многочисленных мелких, округлой формы образований, дающих ярко-зелёную флюоресценцию и расположенных на оранжево-коричневом фоне при отсутствии зелёной флюоресценции в контроле свидетельствует о наличии в материале ортопоксвируса.
Внеклеточный вирус может образовывать цепочки, скопления и располагаться попарно. В ряде случаев специфический антиген может обнаруживаться в цитоплазме попавших в мазок клеток спущенного эпителия.
Исследование осуществляется в соответствии с инструкцией по применению препарата люминесцирующего оспенного иммуноглобулина, зарегистрированного в Российской Федерации установленным порядком.
Метод неприменим для исследования материала от больного в стадии пустул из-за наличия аутофлюоресценции элементов белой крови.
10.2. Реакция микропреципитации в агаре (РМПА)
В качестве дополнительного метода быстрого обнаружения в материале от больного антигена ортопоксвирусов может быть использована РМПА.
В водяной бане растапливают 1 %-й агар на фосфатно-солевом буфере (см. прилож. 7), затем охлаждают до 60 °С и прибавляют подогретый до этой же температуры мертиолят (0,01 %). Агар наносят тонким слоем на предметное стекло (2 мл агара на предметное стекло размером 2,6´7,6 см). После застывания агара полой металлической трубочкой в нём прорезывают 4 круглых лунки диаметром 4 мм, центры которых находятся друг от друга на расстоянии 5 - 6 мм. Лунки располагают по углам ромба. В одну из боковых лунок наливают диагностическую оспенную сыворотку, в другую - нормальную кроличью сыворотку. В качестве известного антигена используют сухой оспенный диагностикум, который наливают в верхнюю лунку. Испытуемый антиген (везикулярная, пустулезная жидкость, суспензия корок, органов и т.д.) закапывают в нижнюю лунку.
Стекло с налитыми в лунки реагентами помещают во влажную камеру, в качестве которой может быть использована чашка Петри с влажной фильтровальной бумагой. Камеру оставляют при комнатной температуре. Просмотр стёкол производят через 2 - 5 и 24 часа в проходящем свете.
Реакция считается положительной в случае появления полосы преципитации между лунками с известным антигеном и диагностической противооспенной сывороткой при одновременном появлении такой же полосы между испытуемым антигеном и этой сывороткой и отсутствии их между антигенами и нормальной сывороткой. Положительный результат исследования свидетельствует о наличии в исследуемом материале антигена ортопоксвирусов. Отрицательный результат не исключает заболевания.
10.3. Реакция торможения гемагглютинации
Этот простой и доступный метод, дающий ответ в пределах 1,5 - 2,0 ч, основан на подавлении специфическими антителами феномена агглютинации чувствительных эритроцитов кур, вызываемого рядом ортопоксвирусов. Установлено, что у заболевших оспой обнаруживаются высокие титры антигемагглютининов (АГА), значительно превосходящие таковые у вакцинированных против оспы лиц. Максимальные титры АГА наблюдаются к 10 - 15 дню, после чего постепенно снижаются. Следует отметить, что у отдельных больных оспой титры АГА остаются невысокими (20 - 40), поэтому наличие низких титров АГА не позволяет исключить диагноз оспы. Реакцию обычно ставят с 4 и 2 АЕ (агглютинирующими единицами).
11. Заключение по лабораторному исследованию
Обнаружение при электронной микроскопии ортопоксвирусных вирионов и/или ортопоксвирусного антигена в ИФА свидетельствует о наличии инфекции, вызванной представителем рода ортопоксвирусов. Дальнейшая идентификация возбудителя проводится по результатам МПЦР. При наличии в исследуемом материале ДНК вируса натуральной оспы ставится диагноз «натуральная оспа».
Серологическое исследование с большой долей определенности дает ответ в отношении невакцинированных против оспы людей. В этом случае наличие даже невысоких (80 - 160) титров антител свидетельствует об ортопоксвирусной природе болезни.
Окончательный диагноз «натуральная оспа» ставится после выделения и идентификации возбудителя.
Приложение 1
Одежда, инструментарий и материалы для взятия проб (из расчета на одного больного)
1. Противочумный костюм II-го типа с защитным респиратором ШБ-1 (РБ) «Лепесток-200» или их аналогами отечественного или зарубежного производства.
2. Набор стерильных инструментов в упаковке:
скальпель глазной;
ножницы глазные;
пинцет глазной;
пинцеты для электронноскопических сеток;
щприц туберкулиновый;
иглы.
3. Пробирки пластиковые с завинчивающимися пробками вместимостью 1,5 - 3,0 мл.
4. Пробирки пластиковые с завинчивающимися пробками вместимостью 5 и 10 мл.
5. Обезжиренные предметные стекла (2 - 4 шт.).
6. Подготовленные для взятия проб электронноскопические сетки.
7. Коробка для сеток.
8. Пленка Parafilm.
9. Штатив для пробирок.
10. Маркер для стекол, пробирок.
11. Пластиковые флаконы вместимостью 10 мл с завинчивающейся крышкой.
12. Ватные тампоны на стержне (4 - 6 шт.).
13. Полиэтиленовые пакеты типа Zip-lock.
14. Упаковочные материалы.
15. Спирт этиловый 70 %.
16. Вата.
17. Дезинфицирующие средства, разрешенные к применению в установленном порядке.
18. Фольга.
Приложение 2
Приготовление пленок для электронной микроскопии
Для приготовления опорных пленок используется 0,25 - 0,3 %-й раствор формвара на дихлорэтане, который хранят в холодильнике. Дихлорэтан должен храниться в холодильнике в плотно закрывающейся посуде и иметь квалификацию «хч» или «чда». Для приготовления пленок раствор нагревают до комнатной температуры и в него опускают чистое обезжиренное предметное стекло на 3/4 высоты на 20 - 30 с. Затем стекло просушивают и острым скальпелем или лезвием бритвы вырезают формваровую пленку, отступя от края стекла на 2 - 3 мм. Для отделения пленки стекло медленно погружают под углом 60° в сосуд с дистиллированной водой. На поверхность пленки выкладывают сетки. Затем пленку с сетками накрывают полоской газетной бумаги (без краски) или плотной фильтровальной бумаги. Бумагу вместе с сетками, покрытыми пленкой, вынимают из воды и укладывают в чашку Петри для просушивания.
Для приготовления опорных пленок может использоваться 1 %-й раствор парлодия в амилацетате. При этом каплю раствора наносят на поверхность дистиллированной воды. Через 10 - 15 с, после испарения амилацетата, на поверхность образовавшейся пленки укладывают сетки, которые затем снимают на бумагу, аналогично формваровым.
После просушки сетки, покрытые формваровой или парлодиевой пленкой, напыляют углем в вакуумной напылительной установке при давлении 10-4 - 10-5 мм ртутного столба. Визуально напыление контролируют по появлению на бумаге с сетками первых признаков видимого слоя угля светло-серого цвета. Формваровые пленки можно использовать без напыления.
Приготовление смолы для заливки образцов, предназначенных для исследования методом ультратонких срезов
Использование смеси эпоксидных смол эпона и аралдита позволяет получить заливочную среду, обеспечивающую хорошее пропитывание образца, оптимальную для резки твердость блоков и хорошее контрастирование срезов.
Исходный раствор готовится с использованием смол:
25 мл эпона-812
55 мл эпона DDSA
15 мл аралдита М
Смолы сливаются в стеклянный сосуд и тщательно перемешиваются до получения гомогенной смеси. Смесь хранится при комнатной температуре в плотно закрытой посуде неограниченное время и используется для пропитки образцов и полимеризации.
Приложение 3
Состав фосфатно-цитратного буферного раствора Мак-Ильвейна 0,004 М
Раствор № 1 - 0,84 г лимонной кислоты растворяют в 1 л очищенной воды.
Раствор № 2 - 0,712 г Na2HPO4×2Н2O растворяют в 1 л очищенной воды.
Для получения буферного раствора с рН - 7,2 следует смешать 130 мл раствора № 1 и 870 мл раствора № 2.
Состав фосфатно-буферного раствора (0,15 М, рН = 7,2 - 7,4), используемого для промывания препаратов, исследуемых МФА.
Раствор № 3 - 10,21 г КН2РO4 растворяют в 500 мл воды очищенной.
Раствор № 4 - 26,85 г Na2HPO4×2Н2O растворяют в 500 мл воды очищенной.
Для получения буферного раствора требуемой молярности и рН следует к 200 мл физиологического раствора добавить 172,0 мл раствора № 4 и 47,8 мл раствора № 3.
Приложение 4
(рекомендуемое)
Список рекомендуемого оборудования для постановки МПЦР
|
Наименование, тип и шифр средств испытаний |
Кол-во |
Основные характеристики |
|
1. рН-метр типа РВ-11 Sartorius |
Предел измерения (1 - 14) ед. рН |
|
|
2. Холодильник бытовой типа ГОСТ 16317-87 |
Температура в холодильной камере от 0 до 10 °С |
|
|
3. Малогабаритная высокоскоростная лабораторная микроцентрифуга типа «ЦиклоТемп-201» |
16000 об./мин, со сменными роторами для микропробирок - 0,5/0,6 мл и 1,5/2,0 мл |
|
|
4. Микроцентрифуга/встряхиватель типа ТЭТА 2 |
Скорость вращения гнезда до 2500 об./мин |
|
|
5. Программируемый твердотельный термостат типа Т-2415 |
Диапазон рабочих температур от 20 до 120 °С |
|
|
6. Морозильная камера типа «Kelvinator» |
Температура в морозильной камере от -20 до -70 °С |
|
|
7. Автоматические пипетки типа «Ленпипет» 1 - 10, 5 - 40, 20 - 200, 200 - 1000 мкл |
3 |
|
|
8. Термостат программируемый четырехканальный типа ТП 4-ПЦР-01-«Терцик» |
1 |
4 независимо управляемых блока, емкость каждого термоблока 10´0,5 мл, диапазон от 4 до 99 °С, скорость нагревания/охлаждения блока 2 °С/с |
|
9. УФ-бокс |
||
|
10. Весы технические |
Предел взвешивания 15 кг, погрешность 5 г |
|
|
11. Секундомер СДС пр-26-2 |
Диапазон измерений от 0,2 до 60 мин. Класс точности 0,2 |
|
|
12. Электроплита |
||
|
13. Набор для горизонтального электрофореза типа «Sub Cell GT» |
Размер геля 15´10 см, заливочный столик |
|
|
14. Источник тока типа «PowerPac Basic (300)» |
Выход на 4 камеры, до 300 В и 400 мА |
|
|
15. Трансиллюминатор типа «ТСР-20МС» |
Длина волны 312 нм и 254 нм, экран 20´20 см, 6 ламп для каждой длины волны |
Примечание. Могут использоваться средства измерения и контроля, имеющие характеристики не хуже приведенных.
Приложение 5
Обработка стеклянных пластинок для выращивания ткани
Нарезанные из предметных стёкол пластинки (2,5´0,8 см) в сухом виде погружают в хромпик на 24 ч (на 1 л концентрированной серной кислоты 250 г двухромовокислого калия). Раствор хромпика используют через 24 ч. Стёкла после хромпика промывают сутки в проточной воде, после чего ополаскивают дистиллированной водой, вытирают и опускают в смесь Никифорова (спирт-эфир 1:1) на 6 - 24 ч. Затем каждое стекло протирают чистой марлей и пинцетом погружают в пробирки. Пробирки со стёклами подвергают стерилизации.
Приложение 6
Титрование альбумина, меченого фторидом сульфородамина
Готовят двукратные разведения альбумина на физиологическом растворе. На фиксированные препараты (по два на каждое разведение) наслаивают различные разведения альбумина. Последующую обработку препаратов проводят по методике, описанной в разделе 10.1. Яркость люминесценции оценивают по 3-крестовой шкале:
3+ - отчётливо выраженная люминесценция оранжево-красного цвета;
2+ - отчетливая люминесценция оранжево-коричневого цвета;
+ - заметная флюоресценция серовато-жёлтого цвета;
- - флюоресценция отсутствует.
За «красящий» титр бычьего альбумина принимают его максимальное разведение, которое обусловливает оранжево-красноватое или оранжево-коричневатое свечение фона препарата на 2 - 3 креста. При правильно выбранных «рабочих» разведениях смесь люминесцирующего оспенного иммуноглобулина и меченого альбумина должна обеспечить при окраске препаратов, инфицированных вирусом вакцины, изумрудно-зелёное специфическое свечение на 3 - 4 креста внутриклеточно и внеклеточно расположенного вируса, чётко контрастируемое на фоне оранжево-красной или коричневатой флюоресценции окружающих клеток, клеточного дебриза или прочих гетерологичных частиц.
Приложение 7
Приготовление агара для реакции микропреципитации
Берётся 1 весовая часть агара и 50 весовых частей воды. Агар в горячем состоянии осаждают 0,5 %-м раствором хлористого кальция (хлористый кальций добавляют из расчёта 5 г на 1 л агара) и тут же фильтруют через слой ваты. Затем затвердевший агар нарезают на куски и промывают в проточной воде в течение 72 ч. Агар опять расплавляют и добавляют в буфер из расчёта 10 г на литр буферного раствора. Состав фосфатно-солевого буфера (рН 7,2): Na2HPO4 M/15 - 70 мл, КН2РO4 М/15 - 30 мл.
Приложение 8
Схема лабораторного исследования с помощью основных методов диагностики
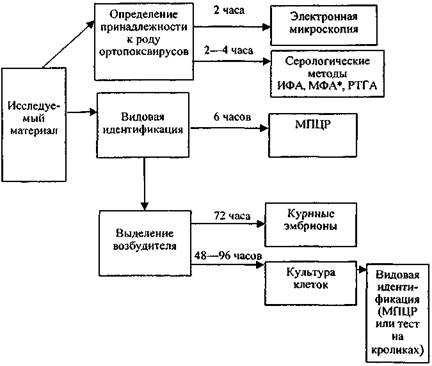
______________
* Выявление ортопоксвируса непосредственно в материале от больного в ранние стадии болезни (до появления пустул).