 | Информационная система |  |
Государственное
санитарно-эпидемиологическое нормирование
Российской Федерации
Осуществление надзора за производством
и оборотом пищевых продуктов,
содержащих ГМО
Сборник методических указаний
Часть 1
1. Разработаны: ГУ НИИ питания РАМН (В.А. Тутельян, Е.Ю. Сорокина, О.Н. Чернышева, О.В. Анисимова, Н.А. Кашина); Федеральной службой по надзору в сфере защиты прав потребителей и благополучия человека (Г.Г. Онищенко, Л.П. Гульченко, Г.Е. Иванов); ФГУЗ «Федеральный центр гигиены и эпидемиологии» Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека (И.В Брагина, Т.В. Воронцова, Т.Н. Потапова, Т.Ф. Авдеенко, С.Ю. Терехова, М.В. Зароченцев); ТУ Роспотребнадзора по г. Москве (Н.Н. Филатов, И.И. Пискарева, Н.Я. Салова, Е.В. Сизых); Московской медицинской академией им. И.М. Сеченова Минздравсоцразвития России (Б.П. Суханов); ФГУЗ Центральный НИИ эпидемиологии Роспотребнадзора (Г.А Шипулин, С.Б. Яцышина); ГУ Всероссийский научно-исследовательский институт сельскохозяйственной биотехнологии РАСХП (А.В. Кузубов, Я.И. Алексеев, Д.А. Варламов, С.В. Боровская); Центром «Биоинженерия» РАН (К.Г. Скрябин, Б.Б. Кузнецов); ГОУВ Московским государственным университетом прикладной биотехнологии Минобрнауки России (И.А. Рогов, Н.Г. Кроха, А.Ф. Валихов); Инновационной корпорацией «Биозащита» (И.В. Панкин).
2. Утверждены постановлением Главного государственного санитарного врача Российской Федерации Г.Г. Онищенко 30.11.2007 № 80. Зарегистрирован в Министерстве юстиции Российской Федерации 06 февраля 2008 года, регистрационный номер 11117.
3. Введены в действие с 30.11.2007.
4. Введены взамен МУК 4.2.1902-04 «Определение генетически модифицированных источников (ГМИ) растительного происхождения методом полимеразной цепной реакции»; МУК 4.2.1913-04 «Методы количественного определения генетически модифицированных источников (ГМИ) растительного происхождения в продуктах питания».
СОДЕРЖАНИЕ
![]()
ГЛАВНЫЙ ГОСУДАРСТВЕННЫЙ САНИТАРНЫЙ
ВРАЧ РОССИЙСКОЙ ФЕДЕРАЦИИ
|
30.11.2007 |
Москва |
№ 80 |
О надзоре за оборотом
пищевых продуктов,
содержащих ГМО*
____________
* Зарегистрировано в Министерстве юстиции Российской Федерации 06 февраля 2008 г., регистрационный номер 11117.
Я, Главный государственный санитарный врач Российской Федерации Г.Г. Онищенко, проанализировав материалы государственного надзора за выполнением обязательных требований при обороте пищевых продуктов, содержащих компоненты, полученные с применением генно-инженерно-модифицированных организмов (далее - ГМО), отмечаю.
В Российской Федерации с 1996 г. разработана и функционирует законодательная, нормативная и методическая база, позволяющая осуществлять оценку безопасности, и организован мониторинг за оборотом пищевой продукции, полученной из ГМО. Действующая система в значительной степени гармонизирована с требованиями Международных организаций и Европейского союза.
За период с 1996 по 2007 гг. в мире площади посевов генетически модифицированных культур возросли в 60 раз, достигнув более 110 млн. га. В настоящее время разрешено к применению в разных странах более 120 видов трансгенных растений, в том числе 86 - в Европе.
В Российской Федерации за эти годы прошли полный цикл исследований 17 видов генетически модифицированных культур. На 30.11.2007 на территории Российской Федерации действуют санитарно-эпидемиологические заключения и свидетельства о государственной регистрации на 12 видов пищевой продукции растительного происхождения, полученных с применением трансгенных технологий: 6 сортов кукурузы, 4 сорта картофеля, 1 сорт риса и 1 сорт сахарной свеклы.
В мире существуют разные подходы к этикетированию пищевых продуктов, полученных из ГМО. В США, Канаде, Аргентине данные продукты не этикетируются, в странах ЕЭС принят 0,9 %-й пороговый уровень, в странах Японии, Австралии - 5 %-й. При этом введение порогового уровня содержания ГМО, при котором необходимо этикетировать пищевые продукты, не связано с вопросом их безопасности, а преследует цели информирования населения об использовании технологии получения пищевых продуктов.
С 12 декабря 2007 г. вступает в силу Федеральный закон от 25.10.2007 № 234-ФЗ «О внесении изменений в Закон Российской Федерации «О защите прав потребителей» и часть вторую Гражданского кодекса Российской Федерации» (Собрание законодательства Российской Федерации, 2007, № 44, ст. 5282), в котором подпунктом а) пункта 3 статьи 1 в абзац третий пункта 2 статьи 10 Закона Российской Федерации от 07.02.1992 № 2300-I «О защите прав потребителей» (Собрание законодательства Российской Федерации, 1996, № 3, ст. 140) внесено дополнение об обязательном наличии в отношении продуктов питания информации о наличии в них компонентов, полученных с ГМО, в случае, если содержание указанных организмов в таком компоненте составляет более 0,9 %.
Таким образом, с учетом объективной необходимости определения порядка соответствующего этикетирования пищевых продуктов, полученных из ГМО, как формы реализации права потребителя на своевременное получение необходимой и достоверной информации о составе пищевых продуктов, обеспечивающей возможность их правильного выбора, Закон Российской Федерации от 07.02.1992 № 2300-I «О защите прав потребителей» (Собрание законодательства Российской Федерации, 1996, № 3, ст. 140) был гармонизирован с требованиями Европейского Союза по этикетированию пищевых продуктов, полученных из ГМО, установленными Директивой Европейского Парламента и Совета от 22.09.2003 № 1829/2003 о генетически модифицированной пище и кормах, которая с апреля 2004 г. ввела в странах Европейского Союза 0,9 %-й пороговый уровень для этикетирования пищевых продуктов, полученных из ГМО.
Ранее, аналогичный показатель был закреплен санитарно-эпидемиологическими правилами СанПиН 2.3.2.2227-07 «Дополнения и изменения 5 к санитарно-эпидемиологическим правилам СанПиН 2.3.2.1078-01 «Гигиенические требования безопасности и пищевой ценности пищевых продуктов» (зарегистрированы в Минюсте России 16.06.2007, регистрационный номер 9852), установившими с 01.09.2007, что содержание в пищевых продуктах 0,9 % и менее компонентов, полученных с применением ГМО, является случайной или технически неустранимой примесью, и пищевые продукты, содержащие указанное количество таких компонентов, не относятся к категории пищевых продуктов, содержащих компоненты, полученные с применением ГМО.
Система оценки безопасности пищевых продуктов, полученных из ГМО, включает проведение пострегистрационного мониторинга за ее оборотом, для осуществления которого разработаны методы идентификации ГМО в пищевых продуктах.
В системе Роспотребнадзора в субъектах Российской Федерации имеется лабораторная база по исследованию пищевых продуктов на наличие ГМО. Постановлением Главного государственного санитарного врача Российской Федерации от 31.12.2004 № 13 «Об усилении надзора за пищевыми продуктами, полученными из ГМО» (по заключению Минюста России от 18.02.2005 № 01/1203-ВЯ данное постановление не нуждается в государственной регистрации) определены головные центры по количественному исследованию пищевых продуктов на наличие ГМО в каждом федеральном округе.
За 9 месяцев 2007 г. учреждениями Роспотребнадзора на наличие компонентов, полученных с применением ГМО, исследовано 29816 проб (2006 г. - 37879, 2005 г. - 18872, 2004 г. - 12956, 2003 г. - 4300) продовольственного сырья и пищевых продуктов. Из них компоненты ГМО содержали 652 пробы (2006 г. - 1452, 2005 г. - 1443, 2004 г. - 1552, 2003 г. - 511), что составило 2,2 % (2006 г. - 2,7 %, 2005 г. - 7,6 %, 2004 г. - 12,0 %, 2003 г. - 11,9 %). Наиболее часто ГМО встречаются в мясных продуктах - 3,8 % (2006 г. - 6,6 %, 2005 г. - 15,8 %, 2004 г. - 20,5 %, 2003 г. - 14,8 %), птицеводческих продуктах - 5,6 % (2006 г. - 3,8 %, 2005 г. - 9,1 %, 2004 г. - 15,43 %, 2003 г. - 29,5 %), группе продуктов «прочие» (в основном растительные белки) - 3,3 % (2006 г. - 3,9 %, 2005 г. - 10,8 %, 2004 г. - 16,7 %, 2003 г. - 16,4 %). В 2007 г. увеличилась доля содержания компонентов ГМО в молочных продуктах (9 месяцев 2007 г. - 5,1 %, 2006 г. - 1,3 %).
Учреждениями Роспотребнадзора при исследовании пищевых продуктов количественным методом определения ГМО по предварительным данным выявлено, что оборот пищевых продуктов, содержащих компоненты ГМО более 0,9 %, составляет менее 1,0 % от оборота всех пищевых продуктов, однако 90,0 % из них не имеют обязательной информации о наличии ГМО.
В связи с вышеизложенным, с целью усиления Госсанэпиднадзора за пищевыми продуктами и в соответствии с Федеральным законом от 30.03.1999 № 52-ФЗ «О санитарно-эпидемиологическом благополучии населения» (Собрание законодательства Российской Федерации, 1999, № 14, ст. 1650; 2002, № 1 (ч. 1), ст. 1; 2003, № 2, ст. 167; № 27 (ч. 1), ст. 2700; 2004, № 35, ст. 3607; 2005, № 19, ст. 1752; 2006, № 1, ст. 10; 2006, № 52 (ч. 1), ст. 5498; 2007, № 1 (ч. 1), ст. 21; 2007, № 1 (1 ч.), ст. 29; 2007, № 27, ст. 3213; 2007, № 46, ст. 5554) и Федеральным законом от 01.01.2000 № 29-ФЗ «О качестве и безопасности пищевых продуктов» (Собрание законодательства Российской Федерации, 2000, № 2, ст. 150; 2002, № 1 (ч. 1), ст. 2; 2003, № 2, ст. 167, № 27 (ч. 1), ст. 2700; 2004, № 35, ст. 3607; 2005, № 19, ст. 1752, № 50, ст. 5242; 2006, № 1, ст. 10, № 14, ст. 1458)
ПОСТАНОВЛЯЮ:
1. Организациям, осуществляющим ввоз, производство и оборот пищевых продуктов, принять меры по обязательному доведению до потребителя информации о наличии в продуктах питания компонентов, полученных с применением ГМО, в случае если их содержание составляет более 0,9 %.
2. Утвердить методические указания:
2.1. МУ 2.3.2.2306-07 «Медико-биологическая оценка безопасности генно-инженерно-модифицированных организмов растительного происхождения» (приложение 1).
2.2. МУК 4.2.2304-07 «Методы идентификации и количественного определения генно-инженерно-модифицированных организмов растительного происхождения» (приложение 2).
2.3. МУК 4.2.2305-07 «Определение генетически модифицированных микроорганизмов и микроорганизмов, имеющих генетически модифицированные аналоги, в пищевых продуктах методами полимеразной цепной реакции (ПЦР) в реальном времени и ПЦР с электрофоретической детекцией» (приложение 3).
3. Управлениям Роспотребнадзора по субъектам Российской Федерации и по железнодорожному транспорту:
3.1. Считать осуществление надзора за пищевыми продуктами, полученными из ГМО, приоритетным направлением деятельности на 2008 г.
3.2. Усилить государственный надзор за производством и оборотом пищевых продуктов, содержащих ГМО.
3.3. Обеспечить выполнение необходимых лабораторных исследований по исследованию пищевых продуктов, содержащих ГМО.
3.4. Осуществлять в средствах массовой информации и среди населения разъяснительную работу по вопросам безопасности пищевых продуктов, полученных из ГМО, и прав потребителей на получение полной и достоверной информации.
3.5. Доложить о проделанной работе до 01.04.2008.
4. Управлениям Роспотребнадзора по г.г. Москве, Санкт-Петербургу, Ростовской, Нижегородской, Свердловской, Новосибирской областям, Хабаровскому краю активизировать работу головных центров по количественному исследованию пищевых продуктов на наличие ГМО в федеральных округах.
5. ФГУЗ «Центры гигиены и эпидемиологии» принять меры по дооснащению лабораторных подразделений аналитическим оборудованием по исследованию количественного состава ГМО.
6. ФГУЗ «Федеральный центр гигиены и эпидемиологии» Роспотребнадзора до 01.03.2008 представить в Роспотребнадзор информацию о наличии в ФГУЗ «Центры гигиены и эпидемиологии» в субъектах Российской Федерации аналитического оборудования по качественному и количественному методам определения ГМО в пищевых продуктах и подготовке врачей-лаборантов.
7. Просить научно-исследовательские учреждения РАМН, РАН, РАСХН совместно с научно-исследовательскими учреждениями Роспотребнадзора уделять приоритетное внимание совершенствованию методов оценки безопасности и контроля за пищевой продукцией, содержащей ГМО.
8. Контроль за исполнением настоящего постановления возложить на заместителя Главного государственного санитарного врача Российской Федерации Л.П. Гульченко.
Г.Г. Онищенко
Зарегистрировано в Министерстве юстиции Российской Федерации от 6 февраля 2008 г., регистрационный номер 11117.
|
УТВЕРЖДЕНО Постановлением Главного государственного санитарного врача Российской Федерации от 30 ноября 2007 г. № 80 |
4.2. МЕТОДЫ КОНТРОЛЯ.
БИОЛОГИЧЕСКИЕ И МИКРОБИОЛОГИЧЕСКИЕ ФАКТОРЫ
Методические
указания
МУК 4.2.2304-07
1. Область применения
1.1. Настоящие методические указания устанавливают методы идентификации и количественного определения генно-инженерно-модифицированных организмов (ГМО) растительного происхождения в пищевых продуктах.
1.2. Представлены скрининговые методы, направленные на выявление и количественное определение рекомбинантной ДНК: промотора 35S из вируса мозаики цветной капусты, терминатора NOS из Agrobacterium tumefaciens и маркерных генов, позволяющие проводить предварительную проверку пищевой продукции.
1.3. Представлены методы, направленные на идентификацию и количественное определение рекомбинантной ДНК, характерной для генетических конструкций и уникальных трансформационных событий, для осуществления окончательной идентификации линии ГМО растительного происхождения.
2. Аппаратура, инструменты, лабораторная посуда, реактивы
2.1. Для проведения идентификации и количественного определения ГМО растительного происхождения используется следующая аппаратура и инструменты:
• амплификаторы типа ABI Prism 7000, iCycler iQ, Rotor Gene - 3000 (6000), AHK-32, «Терцик МС-2» и другие;
• комплекс аппаратно-программный для анализа биологических микрочипов типа «ДЕРМИГЕН-001»;
• прибор для горизонтального электрофореза типа «Mini-Sub Cell GT System» с комплектом кювет и гребенок;
• источник напряжения типа «Power Рас 300» с диапазоном регулируемого напряжения 50 - 300 В;
• трансиллюминатор типа Т12 с защитным экраном, диапазон излучения 300 - 400 нм;
• видеосистема типа «Gel Doc 2000ТМ», предназначенная для ввода в компьютер, анализа и документирования изображений люминисцирующих следов ДНК в гелях, окрашенных бромистым этидием, чувствительность - не менее 10 нг ДНК (по бромистому этидию);
• холодильник бытовой электрический типа «Электролюкс», с температурой морозильной камеры минус 20 °C;
• микроцентрифуга настольная типа Эппендорф (частота вращения не менее 13000 об./мин):
• термостат типа «TERMO 24-15» под пробирки типа Эппендорф вместимостью 0,5 и 1,5 мл, диапазон температур от 15 до 120 °C, количество гнезд - не менее 20 каждого типа, точность поддержания температуры - 0,2 °C, разность температур между соседними ячейками - не более 0,5 °C;
• термостат суховоздушный типа ТВ3-25 с рабочей температурой 42 °C, рабочий диапазон от 20 до 60 °C, точность поддержания температуры ±1 °C;
• аппарат для встряхивания типа «Вортекс», скорость вращения 250 - 3000 об./мин;
• печь микроволновая (мощностью не менее 400 W);
• весы лабораторные общего назначения 2-го класса точности с наибольшим пределом взвешивания 200 г;
• анализатор потенциометрический типа MP 220, погрешность измерений pH ± 0,01;
• гомогенизатор перистальтического типа «Стомайкер» или других моделей;
• облучатель бактерицидный настенный типа ОБН-150;
• дозаторы с переменным объемом дозирования: 0,2 - 2,0 мкл с шагом 0,01 мкл, с точностью ±1,2 %; 0,5 - 10,0 мкл с шагом 0,01 мкл, с точностью ±0,8 %; 2 - 20 мкл с шагом 0,01 мкл, с точностью ±0,8 %; 20 - 200 мкл с шагом 0,1 мкл, с точностью ±0,6 %; 100 - 1000 мкл с шагом 1 мкл, с точностью ±3 %; 2 - 10 мл с шагом 0,1 мл, с точностью ±0,5 %.
2.2. Для проведения идентификации и количественного определения ГМО растительного происхождения используется следующая лабораторная посуда:
• цилиндры мерные лабораторные вместимостью 10, 25, 100, 1000 мл, корпорация «Сигма Алдрич» (Sigma), кат. № Z 327263-2 ЕА, Z 327301-2 ЕА, Z 327379-2 ЕА, Z 327476-2 ЕА;
• колбы мерные лабораторные вместимостью 25, 50, 100, 250, 1000 мл, корпорация «Сигма Алдрич» (Sigma), кат. № Z 329517-1EA, Z 329525-1ЕА, Z 329533-1EA, Z329541-1EA, Z 329576-1ЕА;
• пробирки микроцентрифужные типа Эппендорф вместимостью 0,2, 0,5, 1,5 мл;
• наконечники с фильтром для дозаторов с переменным объемом дозирования до: 10; 20; 200; 1000 мкл; 10 мл.
• кислота соляная, корпорация «Сигма Алдрич» (Sigma), кат. № Н 1758;
• кислота борная, корпорация «Сигма Алдрич» (Sigma), кат. № В 7901;
• натрий едкий, корпорация «Сигма Алдрич» (Sigma), кат. № 221465;
• натрий хлористый, корпорация «Сигма Алдрич» (Sigma), кат. № S 3014;
• этилендиаминтетрауксусная кислота (ЭДТА), корпорация «Сигма Алдрич» (Sigma), кат. № Е 5134;
• гексадецилтриметиламмоний бромид (СТАВ), корпорация «Сигма Алдрич» (Sigma), кат. № Н 5882;
• трис(оксиметил)аминометан корпорация «Сигма Алдрич» (Sigma), кат. № Т 6791;
• альбумин бычий сывороточный сухой (БСА), корпорация «Сигма Алдрич» (Sigma), кат. № В 4287;
• этидий бромистый, корпорация «Сигма Алдрич» (Sigma), кат. № Е 4391;
• спирт этиловый, корпорация «Сигма Алдрич» (Sigma), кат № 459836;
• спирт изопропиловый, корпорация «Сигма Алдрич» (Sigma), кат. № 19516;
• хлороформ, корпорация «Сигма Алдрич» (Sigma), кат. № 151823;
• вода деионизированиая, корпорация «Сигма Алдрич» (Sigma), кат. № W 4502;
• вода дистиллированная, корпорация «Сигма Алдрич» (Sigma), кат. № W 3500;
• 2-меркаптоэтанол, корпорация «Сигма Алдрич» (Sigma), кат. № М 3148;
• термостабильный фермент Taq-полимераза, оптимум работы в области 70 - 72 °C, корпорация «Сигма Алдрич» (Sigma), кат. № Д 1806;
• буфер для ПЦР с MgCl2, корпорация «Сигма Алдрич» (Sigma), кат. № Р 2192;
• агароза для электрофореза (тип П), корпорация «Сигма Алдрич» (Sigma), кат. № А 6877;
• маркер молекулярной массы ДНК, корпорация «Сигма Алдрич» (Sigma), кат. № Р 1473;
• стандартный образец состава генетически немодифицированного организма растительного происхождения, корпорация «Сигма Алдрич» (Fluka), кат. № 53198
• стандартный образец состава ГМО растительного происхождения, корпорация «Сигма Алдрич» (Fluka), кат. № 44386;
• 2'-дезоксиаденозин-5'трифосфорной кислоты тетранатриевая соль, тригидрат (АТФ), корпорация «Сигма Алдрич» (Sigma), кат. № Д 4788;
• 2'-дезоксицитидин-5'трифосфорной кислоты тетранатриевая соль, тригидрат (ЦТФ), корпорация «Сигма Алдрич» (Sigma), кат. № Д 4913;
• 2'-дезоксигуанозин-5'трифосфорной кислоты тетранатриевая соль, тригидрат (ГТФ), корпорация «Сигма Алдрич» (Sigma), кат. № Д 5038;
• 2'-дезокситимидин-5'трифосфорной кислоты тетранатриевая соль, тригидрат (ТТФ), корпорация «Сигма Алдрич» (Sigma), кат. № Т 9656;
• праймеры, ЗАО «Синтол», (Россия);
• натрия додецилсульфат (SDS), корпорация «Сигма Алдрич» (Sigma), кат. № L 4390;
• 3 %-й раствор перекиси водорода, корпорация «Сигма Алдрич» (Sigma), кат. № 7722.
3. Подготовка к анализу
3.1. Приготовление растворов:
• для приготовления 1М ТРИС - НСl (pH 7,5) в мерной колбе на 100 мл растворить 12,11 г трис (оксиметил) аминометана в 80 мл дистиллированной воды, довести pH концентрированной соляной кислотой до 7,5, довести объем раствора до метки деионизованной водой, перемешать, хранить при температуре - 20 °C не более года;
• для приготовления 5М NaCl растворить 29,22 г натрия хлористого в 100 мл дистиллированной воды, перемешать, хранить в колбе с притертой пробкой при комнатной температуре до 1 года;
• для приготовления 30 %-й NaOH растворить 3 г натрия гидроокиси в 7 мл дистиллированной воды;
• для приготовления 0,5 М ЭДТА (pH 8,0) в мерной колбе на 100 мл растворить 18,62 г этилендиаминтетрауксусной кислоты в 80 мл дистиллированной воды, раствором 30 %-й натрия гидроокиси довести pH раствора до 8,0, дистиллированной водой объем раствора довести до метки, перемешать, хранить в колбе с притертой пробкой при комнатной температуре до 1 года.
3.2. Приготовление хлороформа, насыщенного водой:
• смешать 100 мл хлороформа с 20 мл деионизированной воды и оставить на 24 ч для насыщения;
• срок хранения при температуре от 4 до 5 °C - не более 6 мес.
3.3. Приготовление 70 %-го раствора этилового спирта:
• смешать 70 мл 96 %-го этилового спирта с 26 мл деионизированной воды;
• срок хранения при температуре от 4 до 5 °C - не более 2 мес.
3.4. Приготовление раствора БСА (20 мкг/мл):
• растворить 0,002 г сухого альбумина бычьего сывороточного в 1 мл деионизированной воды, 10 мкл полученного раствора смешать с 990 мкл деионизированной воды;
• срок хранения в морозильной камере при температуре минус 20 °C - не более 6 мес.
3.5. Приготовление лизирующего буфера (2 %-го «СТАВ»):
• растворить 0,5 г гексадецилтриметиламмония бромида в 10 мл деионизированной воды, добавить 2,5 мл 1М Трис - НСl, 7 мл 5М NaCl, 1 мл 0,5М ЭДТА, довести объем раствора деионизированной водой до 25 мл, перемешать;
• срок хранения при температуре от 4 до 5 °C - не более 6 мес.
3.6. Приготовление 1х ТВЕ буфера для электрофореза:
• в мерной колбе на 1000 мл растворить 10,8 г трис (оксиметил)-аминометана, 5,5 г борной кислоты и 0,92 г этилендиаминтетрауксусной кислоты, довести дистиллированной водой до метки, перемешать до полного растворения;
• срок хранения 1х раствора - 10 дней.
3.7. Приготовление раствора бромистого этидия - C21H20N3Br (10 мг/мл):
• растворить 1 г бромистого этидия в 100 мл дистиллированной воды;
• срок хранения в посуде темного стекла при температуре от 4 до 5 °C - 12 мес.
3.8. Приготовление осаждающего буфера СТАВ:
• в мерную колбу внести 1 г СТАВ, 0,5 г NaCl, добавить 100 мл деионизированной воды, довести раствором 30 %-й натрия гидроокиси pH раствора до 8,0, довести объем деионизированной водой до 200 мл;
• хранить при 4 °C не более 6 мес.
3.9. Приготовление 1,2 M NaCl:
• растворить 7,0 г NaCl в 100 мл деионизированной воды, перемешать;
• хранить в колбе с притертой пробкой при комнатной температуре до 1 года.
3.10. Приготовление 10 %-го раствора SDS:
• растворить 10 г SDS в 90 мл дистиллированной воды;
• хранить при комнатной температуре не более 1 года.
4. Выделение ДНК
4.1. Метод выделения ДНК с помощью СТАВ:
• навеску исследуемого гомогенизированного продукта массой 100 мг поместить в микроцентрифужную пробирку типа Эппендорф на 1,5 мл;
• добавить 300 мкл деионизированной воды, перемешать шпателем;
• добавить 500 мкл лизирующего СТАВ-буфера с меркаптоэтанолом, тщательно перемешать шпателем;
• инкубировать при 65 °C 90 мин;
• центрифугировать 10 мин при 13000 об./мин;
• перенести 500 мкл супернатанта в чистую пробирку типа Эппендорф вместимостью 1,5 мл;
• добавить 500 мкл хлороформа, перемешать на вортекс 30 с;
• центрифугировать 10 мин при 13000 об./мин;
• перенести 500 мкл верхней фракции в чистую пробирку, добавить 500 мкл хлороформа, перемешать;
• центрифугировать 5 мин при 13000 об./мин;
• перенести верхнюю фракцию в чистую пробирку типа Эппендорф вместимостью 1,5 мл, не захватывая слой хлороформа;
• добавить 2 объема СТАВ-осаждающего буфера, перемешать пипетированием;
• инкубировать 60 мин при комнатной температуре;
• центрифугировать 5 мин при 13000 об./мин;
• удалить супернатант;
• растворить осадок в 350 мкл NaCl (1,2 М);
• добавить 350 мкл хлороформа, перемешать на вортекс 30 с;
• центрифугировать 10 мин при 13000 об./мин;
• перенести верхнюю фракцию в чистую пробирку типа Эппендорф вместимостью 1,5 мл;
• добавить 0,6 объема изопропилового спирта, перемешать;
• центрифугировать 10 мин при 13000 об./мин;
• удалить супернатант;
• добавить 500 мкл 70 %-го раствора этилового спирта и перемешать на вортекс;
• центрифугировать 10 мин при 13000 об./мин;
• удалить супернатант;
• подсушить осадок не более 5 мин при 65 °C для удаления капель спирта;
• растворить осадок в 100 мкл деионизированной воды, осторожно встряхивая, полученный раствор ДНК готов для проведения полимеразной цепной реакции (ПЦР);
• хранить при минус 20 °C.
4.2. Сорбционный метод выделения ДНК:
• в центрифужные пробирки типа Эппендорф на 1,5 мл внести 300 мг бисера и 70 - 80 мг анализируемого материала, добавить 0,5 мл 5 мМ Na2-соль ЭДТА и термостатировать 30 - 60 мин при 65 °C;
• к содержимому пробирки добавить 400 мкл лизирующего реагента, перемешать на вортекс до максимально однородного состояния, термостатировать при 65 °C 60 - 120 мин;
• перемешать на вортекс, добавить 500 мкл бидистиллированной воды, перемешать на вортекс;
• центрифугировать 1 мин при 12000 об./мин, прозрачный супернатант перенести в чистую пробирку;
• добавить 20 мкл сорбента, пробирку поместить на ротатор или перемешивать на вортекс 10 мин при 10000 - 20000 об./мин;
• центрифугировать 10 с при 12000 об./мин;
• удалить супернатант, к осадку добавить 200 мкл лизирующего реагента, перемешать на вортекс до однородного состояния, центрифугировать 10 с при 12000 об./мин;
• удалить супернатант, к осадку добавить 1 мл рабочего раствора солевого буфера, перемешать содержимое пробирки переворачиванием 5 - 10 раз, центрифугировать 10 с при 12000 об./мин;
• удалить супернатант, не задевая осадка;
• к осадку добавить 1 мл рабочего раствора солевого буфера, перемешать на вортекс, центрифугировать 10 с при 12000 об./мин, удалить супернатант;
• повторить предыдущий пункт еще раз;
• подсушить осадок при 65 °C в течение 4 - 5 мин;
• к осадку добавить 50 мкл экстракционного раствора, отбор раствора из исходного флакона проводить при постоянном помешивании, не допуская выпадения в осадок гранул ионообменной смолы;
• суспендировать содержимое пробирки на вортекс 5 - 10 с до гомогенного состояния, затем термостатировать 10 мин при 65 °C;
• повторно суспендировать пробу на вортекс, центрифугировать 1 мин при 12000 об./мин;
• раствор ДНК перенести в чистую пробирку, хранить при минус 20 °C.
5. ПЦР с электрофоретической детекцией
5.1. Идентификация видоспецифичной растительной ДНК
5.1.1. Идентификация ДНК сои, ген лектина:
• праймеры:
1) 5' GCC СТС ТАС ТСС АСС ССС АТС С 3',
2) 5' GCC CAT CTG CAA GCC TTT TTG TG 3';
• реакционная смесь для проведения ПЦР, рассчитанная на 10 проб:
|
Реактивы |
Объем, мкл |
|
Деионизированная вода |
193,70 |
|
Буфер для ПЦР с MgCl2 (10х) |
25,00 |
|
Смесь нуклеотидов (4 млМ) |
12,50 |
|
Праймер 1 (20 мкМ) |
6,25 |
|
Праймер 2 (20 мкМ) |
6,25 |
|
Taq-полимераза (5 единиц/мкл) |
1,30 |
• реакционную смесь перемешать на вортекс, центрифугировать 30 с при 3000 об./мин, разлить в пробирки для проведения ПЦР по 24,0 мкл в каждую, добавить 1,0 мкл раствора ДНК в каждую пробирку, перемешать, центрифугировать 30 с при 3000 об./мин, при использовании амплификатора с крышкой без подогрева в каждую пробирку добавить каплю минерального масла;
• условия амплификации:
|
Стадия |
Программа амплификации |
|
Денатурация |
3 мин/ 95 °C, |
|
Амплификация |
30 с/95 °C, 30 с/60 °C, 40 с/72 °C |
|
Количество циклов амплификации |
40 |
|
Конечное удлинение |
3 мин/72 °C |
|
Фаза остывания |
4 °C |
• после проведения амплификации пробы готовы для проведения электрофореза в агарозном геле, продукт амплификации - 118 пар нуклеотидов, прилож. 2.1.
5.1.2. Идентификация ДНК кукурузы, ген зеина:
• праймеры:
1) 5' TGC TTG CAT TGT TCG CTC TCC TAG 3',
2) 5' GTC GCA GTG АСА TTG TGG CAT 3';
• реакционная смесь для проведения ПЦР, рассчитанная на 10 проб:
|
Реактивы |
Объем, мкл |
|
Деионизированная вода |
193,70 |
|
Буфер для ПЦР с MgCl2 (10x) |
25,00 |
|
Смесь нуклеотидов (4 мМ) |
12,50 |
|
Праймер 1 (20 мкМ) |
6,25 |
|
Праймер 2 (20 мкМ) |
6,25 |
|
Taq-полимераза (5 ед./мкл) |
1,30 |
• реакционную смесь перемешать на вортекс, центрифугировать 30 с при 3000 об./мин, разлить в пробирки для проведения ПЦР по 24,0 мкл в каждую, добавить 1,0 мкл раствора ДНК в каждую пробирку, перемешать, центрифугировать 30 с при 3000 об./мин, при использовании амплификатора с крышкой без подогрева в каждую пробирку добавить каплю минерального масла;
• условия амплификации:
|
Стадия |
Программа амплификации |
|
Денатурация |
3 мин/ 95 °C |
|
Амплификация |
1 мин/94 °C, 1 мин/60 °C, 1 мин/72 °C |
|
Количество циклов амплификации |
40 |
|
Конечное удлинение |
7 мин/72 °C |
|
Фаза остывания |
4 °C |
• после проведения амплификации пробы готовы для проведения электрофореза в агарозном геле, продукт амплификации - 329 пар нуклеотидов, прилож. 2.2.
5.1.3. Идентификация ДНК картофеля, ген фосфоенолпируват карбоксилазы:
• праймеры:
1) 5' GTC ТСС TTG GCT TGT CAT TTT ATG С 3',
2) 5' САА GTT AGC TGC CAT CAT TCT GGC С 3';
• реакционная смесь для проведения ПЦР, рассчитанная на 10 проб:
|
Реактивы |
Объем, мкл |
|
Деионизированная вода |
188,70 |
|
Буфер для ПЦР с MgCl2 (10х) |
25,00 |
|
Смесь нуклеотидов (4 млМ) |
12,50 |
|
Праймер 1 (20 мкМ) |
6,25 |
|
Праймер 2 (20 мкМ) |
6,25 |
|
Taq-полимераза (5 ед./мкл) |
1,30 |
• реакционную смесь перемешать на вортекс и центрифугировать 30 с при 3000 об./мин, разлить в пробирки для проведения ПЦР по 24,0 мкл в каждую, добавить 1,0 мкл раствора ДНК в каждую пробирку, перемешать, центрифугировать 30 с при 3000 об./мин, при использовании амплификатора с крышкой без подогрева в каждую пробирку добавить каплю минерального масла;
• условия амплификации:
|
Стадия |
Программа амплификации |
|
Денатурация |
3 мин/ 95 °C |
|
Амплификация |
1 мин/94 °C, 1 мин/60 °C, 1 мин/72 °C |
|
Количество циклов амплификации |
40 |
|
Конечное удлинение |
7 мин/72 °C |
|
Фаза остывания |
4 °C |
• после проведения амплификации пробы готовы для проведения электрофореза в агарозном геле, продукт амплификации - 1149 пар нуклеотидов, прилож. 2.3.
5.2. Скриниговый анализ
5.2.1. Метод идентификации промотора 35 S:
• праймеры:
1) 5' GCT ССТ АСА ААТ GCC АТС А 3',
2) 5' GAT AGT GGG ATT GTG CGT СА 3';
• реакционная смесь для проведения ПЦР, рассчитанная на 10 проб:
|
Реактивы |
Объем, мкл |
|
Деионизированная вода |
169,0 |
|
Буфер для ПЦР с MgCl2 (10х) |
29,0 |
|
Раствор БСA (20 мкг/мл) |
29,0 |
|
Смесь нуклеотидов (4 млМ) |
14,0 |
|
Праймер 1 (20 мкМ) |
7,0 |
|
Праймер 2 (20 мкМ) |
7,0 |
|
Taq-полимераза (5 ед./мкл) |
1,5 |
• реакционную смесь перемешать на вортекс, центрифугировать 30 с при 3000 об./мин, разлить в пробирки для проведения ПЦР по 24,0 мкл в каждую, добавить 1,0 мкл раствора ДНК в каждую пробирку, перемешать, центрифугировать 30 с при 3000 об./мин, при использовании амплификатора с крышкой без подогрева в каждую пробирку добавить каплю минерального масла;
• условия амплификации:
|
Стадия |
Программа амплификации |
|
Денатурация |
3 мин/94 °C |
|
Амплификация |
20 с/94 °C, 40 с/54 °C, 60 с/72 °C |
|
Количество циклов амплификации |
40 |
|
Конечное удлинение |
3 мин/72 °C |
|
Фаза остывания |
1 мин/4 °C |
|
Скорость нагрева |
0,77 °C/с |
|
Скорость остывания |
3,15 °C/с |
• после проведения амплификации пробы готовы для проведения электрофореза в агарозном геле, продукт амплификации - 195 пар нуклеотидов, прилож. 2.4.
5.2.2. Метод идентификации терминатора NOS:
• праймеры:
1) 5' GAA ТСС TGT TGC CGG TCT TG 3',
2) 5' ТТА ТСС TAG TTT GCG CGC ТА 3';
• реакционная смесь для проведения ПЦР, рассчитанная на 10 проб:
|
Реактивы |
Объем, мкл |
|
Деионизированная вода |
169,0 |
|
Буфер для ПЦР с MgCl2 (10х) |
29,0 |
|
Раствор БСА (20 мкг/мл) |
29,0 |
|
Смесь нуклеотидов (4 млМ) |
14,0 |
|
Праймер 1 (20 мкМ) |
7,0 |
|
Праймер 2 (20 мкМ) |
7,0 |
|
Taq-полимераза (5 ед./мкл) |
1,5 |
• реакционную смесь перемешать на вортекс, центрифугировать 30 с при 3000 об./мин, разлить в пробирки для проведения ПЦР по 24,0 мкл в каждую, добавить 1,0 мкл раствора ДНК в каждую пробирку, перемешать, центрифугировать 30 с при 3000 об./мин, при использовании амплификатора с крышкой без подогрева в каждую пробирку добавить каплю минерального масла;
• условия амплификации:
|
Стадия |
Программа амплификации |
|
Денатурация |
3 мин/94 °C |
|
Амплификация |
20 с/94 °C, 40 с/54 °C, 60 с/72 °C |
|
Количество циклов амплификации |
40 |
|
Конечное удлинение |
3 мин/72 °C |
|
Фаза остывания |
1 мин/4 °C |
• после проведения амплификации пробы готовы для проведения электрофореза в агарозном геле, продукт амплификации - 180 пар нуклеотидов, прилож. 2.5.
5.2.3. Метод идентификации маркерного гена npt II:
• праймеры:
1) 5' GGA ТСТ ССТ GCT АТС Т 3',
2) 5' GAT CAT ССТ GAT CGA С 3';
• реакционная смесь для проведения ПЦР, рассчитанная на 10 проб:
|
Реактивы |
Объем, мкл |
|
Деионизированная вода |
16,53 |
|
Буфер для ПЦР с MgCl2 (10х) |
3,30 |
|
Раствор БСА (20 мкг/мл) |
3,30 |
|
Смесь нуклеотидов (4 млМ) |
0,62 |
|
Праймер 1 (32 пикомоль/мкл) |
0,40 |
|
Праймер 2 (59 пикомоль/мкл) |
0,20 |
|
Taq-полимераза (5 ед./мкл) |
0,15 |
• реакционную смесь перемешать на вортекс и центрифугировать 30 с при 3000 об./мин, разлить в пробирки для проведения ПЦР по 24,0 мкл в каждую, добавить 1,0 мкл раствора ДНК в каждую пробирку, перемешать, центрифугировать 30 с при 3000 об./мин, при использовании амплификатора с крышкой без подогрева в каждую пробирку добавить каплю минерального масла;
• условия амплификации:
|
Стадия |
Программа амплификации |
|
Денатурация |
3 мин/ 94 °C |
|
Амплификация |
30 с/95 °C, 50 с/50 °C, 40 с/72 °C |
|
Количество циклов амплификации |
40 |
|
Конечное удлинение |
3 мин/72 °С |
|
Фаза остывания |
4 °С |
• после проведения амплификации пробы готовы для проведения электрофореза в агарозном геле, продукт амплификации - 173 пары нуклеотидов, прилож. 2.6.
5.3. Идентификация линий ГМО
5.3.1. Метод идентификации сои линии 40-3-2:
• 1-й раунд, внешние праймеры:
1) 5' ССА CTG ACG TAA GGG ATG ACG 3',
2) 5' САТ GAA GGA CCG GTG GGA GAT 3';
• реакционная смесь для проведения ПЦР, рассчитанная на 10 проб:
|
Реактивы |
Объем, мкл |
|
Деионизированная вода |
188,70 |
|
Буфер для ПЦР с MgCl2 (10х) |
25,00 |
|
Смесь нуклеотидов (4 млМ) |
12,50 |
|
Праймер 1 (20 мкМ) |
6,25 |
|
Праймер 2 (20 мкМ) |
6,25 |
|
Taq-полимераза (5 ед./мкл) |
1,30 |
• реакционную смесь перемешать на вортекс, центрифугировать 30 с при 3000 об./мин, разлить в пробирки для проведения ПЦР по 24,0 мкл в каждую, добавить 1,0 мкл раствора ДНК в каждую пробирку, перемешать, центрифугировать 30 с при 3000 об./мин, при использовании амплификатора с крышкой без подогрева в каждую пробирку добавить каплю минерального масла;
|
Стадия |
Программа амплификации |
|
Денатурация |
3 мин/ 95 °C |
|
Амплификация |
30 с/95 °C, 30 с/60 °C, 40 с/72 °C |
|
Количество циклов амплификации |
25 |
|
Конечное удлинение |
3 мин/72 °С |
|
Фаза остывания |
4 °C |
• после проведения амплификации пробы поместить на холод, хранение не более одного часа в холодильнике до проведения 2-го раунда;
• 2-й раунд, внутренние праймеры:
3) 5' АТС ССА СТА ТСС ТТС GCA АСА 3',
4) 5' TGG GGT ТТА TGG AAA TTG GAA 3';
• реакционная смесь для проведения ПЦР, рассчитанная на 10 проб:
|
Реактивы |
Объем, мкл |
|
Деионизированная вода |
193,70 |
|
Буфер для ПЦР с MgCl2 (10х) |
25,00 |
|
Смесь нуклеотидов (4 млМ) |
12,50 |
|
Праймер 3 (20 мкМ) |
6,25 |
|
Праймер 4 (20 мкМ) |
6,25 |
|
Taq-полимераза (5 ед./мкл) |
1,30 |
• реакционную смесь перемешать на вортекс, центрифугировать 30 с при 3000 об./мин, разлить в пробирки для проведения ПЦР по 24,5 мкл в каждую, добавить 0,5 мкл раствора ДНК в каждую пробирку, перемешать, центрифугировать 30 с при 3000 об./мин, при использовании амплификатора с крышкой без подогрева в каждую пробирку добавить каплю минерального масла;
• условия амплификации:
|
Стадия |
Программа амплификации |
|
Денатурация |
3 мин/ 95 °C |
|
Амплификация |
30 с/95 °C, 30 с/60 °C, 40 с/72 °С |
|
Количество циклов амплификации |
35 |
|
Конечное удлинение |
3 мин/72 °C |
|
Фаза остывания |
4 °C |
• после проведения амплификации пробы готовы для проведения электрофореза, продукт амплификации - 169 пар нуклеотидов, прилож. 2.7.
5.3.2. Метод идентификации сои линии А2704-12:
• праймеры:
1) 5' GGC GTT CGT AGT GAC TGA GG 3',
2) 5' GTT TTA CAA CGT CGT GAC TGG 3';
• реакционная смесь для проведения ПЦР, рассчитанная на 10 проб:
|
Реактивы |
Объем, мкл |
|
Деионизированная вода |
169,0 |
|
Буфер для ПЦР с MgCl2 (10х) |
29,0 |
|
Раствор БСА (20 мкг/мл) |
29,0 |
|
Смесь нуклеотидов (4 млМ) |
14,0 |
|
Праймер 1 (20 мкМ) |
7,0 |
|
Праймер 2 (20 мкМ) |
7,0 |
|
Taq-полимераза (5 ед./мкл) |
1,5 |
• реакционную смесь перемешать на вортекс, центрифугировать 30 с при 3000 об./мин, разлить в пробирки для проведения ПЦР по 24,0 мкл в каждую, добавить 1,0 мкл раствора ДНК в каждую пробирку, перемешать, центрифугировать 30 с при 3000 об./мин, при использовании амплификатора с крышкой без подогрева в каждую пробирку добавить каплю минерального масла;
• условия амплификации:
|
Стадия |
Программа амплификации |
|
Денатурация |
3 мин/ 94 °C |
|
Амплификация |
20 с/94 °C, 40 с/54 °C, 60 с/72 °C |
|
Количество циклов амплификации |
40 |
|
Конечное удлинение |
3 мин/72 °C |
|
Фаза остывания |
4 °C |
• в после проведения амплификации пробы готовы для проведения электрофореза в агарозном геле, продукт амплификации - 185 пар нуклеотидов, прилож. 2.8.
5.3.3. Метод идентификации сои линии А5547-127:
• праймеры:
1) 5' TGT GGT TAT GGC GGT GCC АТС 3',
2) 5' TGC TAC AGG CAT CGT GGT GTC 3';
• реакционная смесь для проведения ПЦР, рассчитанная на 10 проб:
|
Реактивы |
Объем, мкл |
|
Деионизированная вода |
169,0 |
|
Буфер для ПЦР с MgCl2 (10х) |
29,0 |
|
Раствор БСА (20 мкг/мл) |
29,0 |
|
Смесь нуклеотидов (4 млМ) |
14,0 |
|
Праймер 1 (20 мкМ) |
7,0 |
|
Праймер 2 (20 мкМ) |
7,0 |
|
Taq-полимераза (5 ед./мкл) |
1,5 |
• реакционную смесь перемешать на вортекс, центрифугировать 30 с при 3000 об./мин, разлить в пробирки для проведения ПЦР по 24,0 мкл в каждую, добавить 1,0 мкл раствора ДНК в каждую пробирку, перемешать, центрифугировать 30 с при 3000 об./мин, при использовании амплификатора с крышкой без подогрева в каждую пробирку добавить каплю минерального масла;
• условия амплификации:
|
Стадия |
Программа амплификации |
|
Денатурация |
3 мин/94 °C |
|
Амплификация |
20 с/94 °C, 40 с/54 °C, 60 с/72 °C |
|
Количество циклов амплификации |
40 |
|
Конечное удлинение |
3 мин/72 °C |
|
Фаза остывания |
4 °C |
• после проведения амплификации пробы готовы для проведения электрофореза в агарозном геле, продукт амплификации - 150 пар нуклеотидов, прилож. 2.9.
5.3.4. Метод идентификации кукурузы линии Bt 176:
• 1-й раунд, внешние праймеры:
1) 5' CGG ССС CGA GTT САС СТТ 3',
2) 5' CTG CTG GGG ATG ATG TTG TTG 3';
• реакционная смесь для проведения ПЦР, рассчитанная на 10 проб:
|
Реактивы |
Объем, мкл |
|
Деионизированная вода |
188,70 |
|
Буфер для ПЦР с MgCl2 (10 x) |
25,00 |
|
Смесь нуклеотидов (4 млМ) |
12,50 |
|
Праймер 1 (20 мкМ) |
6,25 |
|
Праймер 2 (20 мкМ) |
6,25 |
|
Taq-полимераза (5 ед./мкл) |
1,30 |
• реакционную смесь перемешать на вортекс и центрифугировать 30 с при 3000 об./мин, разлить в пробирки для проведения ПЦР по 24,0 мкл в каждую, добавить 1,0 мкл раствора ДНК в каждую пробирку, перемешать, центрифугировать 30 с при 3000 об./мин, при использовании амплификатора с крышкой без подогрева в каждую пробирку добавить каплю минерального масла;
• условия амплификации:
|
Стадия |
Программа амплификации |
|
Денатурация |
3 мин/ 95 °C |
|
Амплификация |
40 с/95 °C, 40 с/60 °C, 40 с/72 °C |
|
Количество циклов амплификации |
25 |
|
Конечное удлинение |
3 мин/72 °C |
|
Фаза остывания |
4 °C |
• после проведения амплификации пробы поместить на холод, хранение не более одного часа в холодильнике до проведения 2-го раунда;
• 2-й раунд, внутренние праймеры:
3) 5' CCG САС ССТ GAG CAG САС 3',
4) 5' GGT GGC ACG TTG TTG TTC TGA 3';
• реакционная смесь для проведения ПЦР, рассчитанная на 10 проб:
|
Реактивы |
Объем, мкл |
|
Деионизированная вода |
193,70 |
|
Буфер для ПЦР с MgCl2 (10х) |
25,00 |
|
Смесь нуклеотидов (4 млМ) |
12,50 |
|
Праймер 3 (20 мкМ) |
6,25 |
|
Праймер 4 (20 мкМ) |
6,25 |
|
Taq-полимераза (5 ед./мкл) |
1,30 |
• реакционную смесь перемешать на вортекс, центрифугировать 30 с при 3000 об./мин, разлить в пробирки для проведения ПЦР по 24,5 мкл в каждую, добавить 0,5 мкл раствора ДНК в каждую пробирку, перемешать, центрифугировать 30 с при 3000 об./мин, при использовании амплификатора с крышкой без подогрева в каждую пробирку добавить каплю минерального масла;
|
Стадия |
Программа амплификации |
|
Денатурация |
3 мин/ 95 °C |
|
Амплификация |
40 с/95 °C, 40 с/60 °C, 40 с/72 °C |
|
Количество циклов амплификации |
35 |
|
Конечное удлинение |
3 мин/72 °C |
|
Фаза остывания |
4 °C |
• после проведения амплификации пробы готовы для проведения электрофореза в агарозном геле, продукт амплификации - 189 пар нуклеотидов, прилож. 2.10.
5.3.5. Метод идентификации кукурузы линии MON 810:
• 1-й раунд, внешние праймеры:
1) 5' TAT CTC CAC TGA CGT AAG GGA TGA С 3',
2) 5' TGC ССТ АТА АСА ССА АСА TGT GCT Т 3';
• реакционная смесь для проведения ПЦР, рассчитанная на 10 проб:
|
Реактивы |
Объем, мкл |
|
Деионизированная вода |
188,70 |
|
Буфер для ПЦР с MgCl2 (10х) |
25,00 |
|
Смесь нуклеотидов (4 млМ) |
12,50 |
|
Праймер 1 (20 мкМ) |
6,25 |
|
Праймер 2 (20 мкМ) |
6,25 |
|
Taq-полимераза (5 ед./мкл) |
1,30 |
• реакционную смесь перемешать на вортекс, центрифугировать 30 с при 3000 об./мин, разлить в пробирки для проведения ПЦР по 24,0 мкл в каждую, добавить 1,0 мкл раствора ДНК в каждую пробирку, перемешать, центрифугировать 30 с при 3000 об./мин, при использовании амплификатора с крышкой без подогрева в каждую пробирку добавить каплю минерального масла;
• условия амплификации:
|
Стадия |
Программа амплификации |
|
Денатурация |
3 мин/ 95 °C |
|
Амплификация |
45 с/95 °C, 50 с/60 °C, 50 с/72 °C |
|
Количество циклов амплификации |
35 |
|
Конечное удлинение |
3 мин/72 °C |
|
Фаза остывания |
4 °C |
• 2-й раунд, внутренние праймеры:
3) 5' ACT АТС СТТ CGC AAG АСС СТТ ССТС 3',
4) 5' GCA TTC AGA GAA ACG TGG CAG ТАА С 3';
• реакционная смесь для проведения ПНР, рассчитанная на 10 проб:
|
Реактивы |
Объем, мкл |
|
Деионизированная вода |
193,70 |
|
Буфер для ПЦР с MgCl2 (10x) |
25,00 |
|
Смесь нуклеотидов (4 млМ) |
12,50 |
|
Праймер 3 (20 мкМ) |
6,25 |
|
Праймер 4 (20 мкМ) |
6,25 |
|
Taq-полимераза (5 ед./мкл) |
1,30 |
• реакционную смесь перемешать на вортекс и центрифугировать 30 с при 3000 об./мин, разлить в пробирки для проведения ПЦР по 24,5 мкл в каждую, добавить 0,5 мкл раствора ДНК в каждую пробирку, перемешать, центрифугировать (30 с при 3000 об./мин), при использовании амплификатора с крышкой без подогрева в каждую пробирку добавить каплю минерального масла;
• условия амплификации:
|
Стадия |
Программа амплификации |
|
Денатурация |
3 мин/ 95 °C |
|
Амплификация |
45 с/95 °C, 50 с/60 °C, 50 с/72 °C |
|
Количество циклов амплификации |
40 |
|
Конечное удлинение |
3 мин/72 °C |
|
Фаза остывания |
4 °C |
• после проведения амплификации пробы готовы для проведения электрофореза в агарозном геле, продукт амплификации - 149 пар нуклеотидов, прилож. 2.11.
5.3.6. Метод идентификации кукурузы линии MON 863:
• праймеры:
1) 5' GTA GGA TCG GAA AGC TTG GTA С 3',
2) 5' TGT TAC GGC СТА ААТ GCT GAA CT 3';
• реакционная смесь для проведения ПЦР, рассчитанная на 10 проб:
|
Реактивы |
Объем, мкл |
|
Деионизированная вода |
169,0 |
|
Буфер для ПЦР с MgCl2 (10х) |
29,0 |
|
Раствор БСА (20 мкг/мл) |
29,0 |
|
Смесь нуклеотидов (4 млМ) |
14,0 |
|
Праймер 1 (20 мкМ) |
7,0 |
|
Праймер 2 (20 мкМ) |
7,0 |
|
Taq-полимераза (5 ед./мкл) |
1,5 |
• реакционную смесь перемешать на вортекс и центрифугировать 30 с при 3000 об./мин, разлить в пробирки для проведения ПЦР по 24,0 мкл в каждую, добавить 1,0 мкл раствора ДНК в каждую пробирку, перемешать, центрифугировать 30 с при 3000 об./мин, при использовании амплификатора с крышкой без подогрева в каждую пробирку добавить каплю минерального масла;
• условия амплификации:
|
Стадия |
Программа амплификации |
|
Денатурация |
3 мин/ 94 °C |
|
Амплификация |
20 с/94 °C, 40 с/54 °C, 60 с/72 °C |
|
Количество циклов амплификации |
40 |
|
Конечное удлинение |
3 мин/72 °C |
|
Фаза остывания |
1 мин - 4 °C |
• после проведения амплификации пробы готовы для проведения электрофореза в агарозном геле, продукт амплификации 84 пары нуклеотидов, прилож. 2.12.
5.3.7. Метод идентификации кукурузы линии NK 603:
• праймеры:
1) 5' AGT AAT GAC CTC GAG TAA GCT TGT ТАА 3',
2) 5' AAG AGA TAA CGA GAT CCA CTC AAA САС Т 3';
• реакционная смесь для проведения ПЦР, рассчитанная на 10 проб:
|
Реактивы |
Объем, мкл |
|
Деионизированная вода |
169,0 |
|
Буфер для ПЦР с MgCl2 (10х) |
29,0 |
|
Раствор БСА (20 мкг/мл) |
29,0 |
|
Смесь нуклеотидов (4 млМ) |
14,0 |
|
Праймер 1 (20 мкМ) |
7,0 |
|
Праймер 2 (20 мкМ) |
7,0 |
|
Taq-полимераза (5 ед./мкл) |
1,5 |
• реакционную смесь перемешать на вортекс, центрифугировать 30 с при 3000 об./мин, разлить в пробирки для проведения ПЦР по 24,0 мкл в каждую, добавить 1,0 мкл раствора ДНК в каждую пробирку, перемешать, центрифугировать 30 с при 3000 об./мин, при использовании амплификатора с крышкой без подогрева в каждую пробирку добавить каплю минерального масла;
• условия амплификации:
|
Стадия |
Программа амплификации |
|
Денатурация |
3 мин/ 94 °C |
|
Амплификация |
20 с/94 °C, 40 с/54 °C, 60 с/72 °C |
|
Количество циклов амплификации |
40 |
|
Конечное удлинение |
3 мин/72 °C |
|
Фаза остывания |
1 мин - 4 °C |
• после проведения амплификации пробы готовы для проведения электрофореза в агарозном геле, продукт амплификации - 108 пар нуклеотидов, прилож. 2.13.
5.3.8. Метод идентификации кукурузы линии Bt 11:
• праймеры:
1) 5' CCA TTT TTC AGC TAG GAA GTT С 3',
2) 5' TCG TTG ATG TTK GGG TTG TTG ТСС 3';
• реакционная смесь для проведения ПЦР, рассчитанная на 10 проб:
|
Реактивы |
Объем, мкл |
|
Деионизированная вода |
169,0 |
|
Буфер для ПЦР с MgCl2 (10х) |
29,0 |
|
Раствор БСА (20 мкг/мл) |
29,0 |
|
Смесь нуклеотидов (4 млМ) |
14,0 |
|
Праймер 1 (20 мкМ) |
7,0 |
|
Праймер 2 (20 мкМ) |
7,0 |
|
Taq-полимераза (5 ед./мкл) |
1,5 |
• реакционную смесь перемешать на вортекс, центрифугировать 30 с при 3000 об./мин, разлить в пробирки для проведения ПЦР по 24,0 мкл в каждую, добавить 1,0 мкл раствора ДНК в каждую пробирку, перемешать, центрифугировать 30 с при 3000 об./мин, при использовании амплификатора с крышкой без подогрева в каждую пробирку добавить каплю минерального масла;
|
Стадия |
Программа амплификации |
|
Денатурация |
10 мин/95 °C |
|
Амплификация |
30 с/95 °С, 60 с/63 °C, 60 с/72 °C |
|
Количество циклов амплификации |
10 |
|
Амплификация |
30 с/95 °C, 30 с/60 °C, 30 с/95 °C |
|
Количество циклов амплификации |
30 |
|
Конечное удлинение |
7 мин/72 °C |
|
Фаза остывания |
1 мин - 4 °C |
• после проведения амплификации пробы готовы для проведения электрофореза в агарозном геле, продукт амплификации - 110 пар нуклеотидов, прилож. 2.14.
5.3.9. Метод идентификации кукурузы Т 25:
• праймеры:
1) 5' GCC AGT TAG GCC AGT ТАС ССА 3',
2) 5' TGA GCG AAA CCC TAT AAG ААС ССТ 3';
• реакционная смесь для проведения ПЦР, рассчитанная на 10 проб:
|
Реактивы |
Объем, мкл |
|
Деионизированная вода |
169,0 |
|
Буфер для ПЦР с MgCl2 (10х) |
29,0 |
|
Раствор БСА (20 мкг/мл) |
29,0 |
|
Смесь нуклеотидов (4 млМ) |
14,0 |
|
Праймер 1 (20 мкМ) |
7,0 |
|
Праймер 2 (20 мкМ) |
7,0 |
|
Taq-полимераза (5 ед./мкл) |
1,5 |
• реакционную смесь перемешать на вортекс, центрифугировать 30 с при 3000 об./мин, разлить в пробирки для проведения ПЦР по 24,0 мкл в каждую, добавить 1,0 мкл раствора ДНК в каждую пробирку, перемешать, центрифугировать 30 с при 3000 об./мин, при использовании амплификатора с крышкой без подогрева в каждую пробирку добавить каплю минерального масла;
|
Стадия |
Программа амплификации |
|
Денатурация |
10 мин/95 °C |
|
Амплификация |
30 с/95 °C, 60 с/63 °C, 60 с/72 °C |
|
Количество циклов амплификации |
10 |
|
Амплификация |
30 с/95 °C, 30 с/60 °C, 30 с/95 °C |
|
Количество циклов амплификации |
30 |
|
Конечное удлинение |
7 мин/72 °C |
|
Фаза остывания |
1 мин - 4 °C |
• после проведения амплификации пробы готовы для проведения электрофореза в агарозном геле, продукт амплификации - 149 пар нуклеотидов, прилож. 2.15.
5.3.10. Метод идентификации кукурузы линии GA 21:
• праймеры:
1) 5' ACG GTG GAA GAG TTC AAT GTA TG 3',
2) 5' ТСТ ССТ TGA TGG GCT GCA 3';
• реакционная смесь для проведения ПЦР, рассчитанная на 10 проб:
|
Реактивы |
Объем, мкл |
|
Деионизированная вода |
169,0 |
|
Буфер для ПЦР с MgCl2 (10x) |
29,0 |
|
Раствор БСА (20 мкг/мл) |
29,0 |
|
Смесь нуклеотидов (4 млМ) |
14,0 |
|
Праймер 1 (20 мкМ) |
7,0 |
|
Праймер 2 (20 мкМ) |
7,0 |
|
Taq-полимераза (5 ед./мкл) |
1,5 |
• реакционную смесь перемешать на вортекс и центрифугировать 30 с при 3000 об./мин, разлить в пробирки для проведения ПЦР по 24,0 мкл в каждую, добавить 1,0 мкл раствора ДНК в каждую пробирку, перемешать, центрифугировать 30 с при 3000 об./мин, при использовании амплификатора с крышкой без подогрева в каждую пробирку добавить каплю минерального масла;
|
Стадия |
Программа амплификации |
|
Денатурация |
3 мин/ 94 °C |
|
Амплификация |
20 с/94 °C, 40 с/54 °C, 60 с/72 °C |
|
Количество циклов амплификации |
40 |
|
Конечное удлинение |
3 мин/72 °C |
|
Фаза остывания |
1 мин - 4 °C |
• после проведения амплификации пробы готовы для проведения электрофореза в агарозном геле, продукт амплификации - 270 пар нуклеотидов, прилож. 2.16.
5.3.11. Метод идентификации кукурузы линии MIR 604:
• праймеры:
1) 5' GGT ACC CAT TTG GCG CCG AT 3',
2) 5' CAG CGT TGC GGT TCT GTC AG 3';
• реакционная смесь для проведения ПНР:
|
Реактивы |
Объем, мкл |
|
Раствор ДНК |
0,5 |
|
Праймер 1 (20 мкМ) |
1,0 |
|
Праймер 2 (20 мкМ) |
1,0 |
|
Буферная смесь |
2,5 |
|
Taq-полимераза |
0,2 |
|
Деионизированная вода |
19,8 |
• состав буферной смеси:
|
Реактивы |
Объем, мкл |
|
1 М KCl |
500 |
|
100 мМ dATP |
20 |
|
100 мМ dCTP |
20 |
|
100 мМ dTTP |
20 |
|
100 мМ dGTP |
20 |
|
100 мМ MgCl2 |
150 |
|
Деионизированная вода |
170 |
|
1 М Tris-HCl-pH 8,3 |
100 |
|
Стадия |
Программа амплификации |
|
Денатурация |
4 мин /94 °C |
|
Амплификация |
30 с/95 °C, 30 с/55 °C, 2 мин/72 °C |
|
Количество циклов амплификации |
34 |
|
Конечное удлинение |
5 мин/72 °C |
|
Фаза остывания |
до конца/ 4 °C |
• после проведения амплификации пробы готовы для проведения электрофореза в агарозном геле, продукт амплификации - 895 пар нуклеотидов, прилож. 2.17.
5.3.12. Метод идентификации кукурузы линии MON 88017:
• праймеры:
1) 5' GAG CAG GAC CTG CAG AAG СТ 3',
2) 5' ТСС GGA GTT GAC CAT CCA 3';
• реакционная смесь для проведения ПЦР:
|
Реактивы |
Объем, мкл |
|
Раствор ДНК |
0,5 |
|
Праймер 1 (20 мкМ) |
1,0 |
|
Праймер 2 (20 мкМ) |
1,0 |
|
Буферная смесь |
2,5 |
|
Taq-полимераза |
0,2 |
|
Деионизированная вода |
19,8 |
• состав буферной смеси:
|
Реактивы |
Объем, мкл |
|
1 М KCl |
500 |
|
100 мМ dATP |
20 |
|
100 мМ dCTP |
20 |
|
100 мМ dTTP |
20 |
|
100 мМ dGTP |
20 |
|
100 мМ MgCl2 |
150 |
|
Деионизированная вода |
170 |
|
1 М Tris-HCl-pH 8,3 |
100 |
|
Стадия |
Программа амплификации |
|
Денатурация |
4 мин/94 °C |
|
Амплификация |
30 с/95 °С, 30 с/55 °C, 2 мин/72 °C |
|
Количество циклов амплификации |
34 |
|
Конечное удлинение |
5 мин/72 °C |
|
Фаза остывания |
до конца/4 °C |
• после проведения амплификации пробы готовы для проведения электрофореза в агарозном геле, продукт амплификации - 94 пары нуклеотидов, прилож. 2.18.
5.3.13. Метод идентификации сахарной свеклы линии Н7-1:
• праймеры:
1) 5' TGG GAT CTG GGT GGC ТСТ ААС Т 3',
2) 5' ААТ GCT GCT AAA ТСС TGA G 3';
• реакционная смесь для проведения ПЦР, рассчитанная на 10 проб:
|
Реактивы |
Объем, мкл |
|
Деионизированная вода |
169,0 |
|
Буфер для ПЦР с MgCl2 (10х) |
29,0 |
|
Раствор БСА (20 мкг/мл) |
29,0 |
|
Смесь нуклеотидов (4 млМ) |
14,0 |
|
Праймер 1 (20 мкМ) |
7,0 |
|
Праймер 2 (20 мкМ) |
7,0 |
|
Taq-полимераза (5 ед./мкл) |
1,5 |
• реакционную смесь перемешать на вортекс, центрифугировать 30 с при 3000 об./мин, разлить в пробирки для проведения ПЦР по 24,0 мкл в каждую, добавить 1,0 мкл раствора ДНК в каждую пробирку, перемешать, центрифугировать 30 с при 3000 об./мин, при использовании амплификатора с крышкой без подогрева в каждую пробирку добавить каплю минерального масла;
• условия амплификации:
|
Стадия |
Программа амплификации |
|
Денатурация |
3 мин/ 94 °C |
|
Амплификация |
20 с/94 °C, 40 с/54 °C, 60 с/72 °C |
|
Количество циклов амплификации |
40 |
|
Конечное удлинение |
3 мин/72 °C |
|
Фаза остывания |
1 мин /4 °C |
• после проведения амплификации пробы готовы для проведения электрофореза в агарозном геле, продукт амплификации 110 пар нуклеотидов, прилож. 2.19.
5.3.14. Метод идентификации риса LL 62:
• праймеры:
1) 5' AGC TGG CGT AAT AGC GAA GAG G 3',
2) 5' TGC TAA CGG GTG CAT CGT СТА 3';
• реакционная смесь для проведения ПНР, рассчитанная на 10 проб:
|
Реактивы |
Объем, мкл |
|
Деионизированная вода |
169,0 |
|
Буфер для ПЦР с MgCl2 (10х) |
29,0 |
|
Раствор БСА (20 мкг/мл) |
29,0 |
|
Смесь нуклеотидов (4 млМ) |
14,0 |
|
Праймер 1 (20 мкМ) |
7,0 |
|
Праймер 2 (20 мкМ) |
7,0 |
|
Taq-полимераза (5 ед./мкл) |
1,5 |
• реакционную смесь перемешать на вортекс, центрифугировать 30 с при 3000 об./мин, разлить в пробирки для проведения ПЦР по 24,0 мкл в каждую, добавить 1,0 мкл раствора ДНК в каждую пробирку, перемешать, центрифугировать 30 с при 3000 об./мин, при использовании амплификатора с крышкой без подогрева в каждую пробирку добавить каплю минерального масла;
• условия амплификации:
|
Стадия |
Программа амплификации |
|
Денатурация |
3 мин/ 94 °C |
|
Амплификация |
20 с/94 °C, 40 с/54 °C, 60 с/72 °C |
|
Количество циклов амплификации |
40 |
|
Конечное удлинение |
3 мин/72 °C |
|
Фаза остывания |
1 мин/4 °C |
• после проведения амплификации пробы готовы для проведения электрофореза в агарозном геле, продукт амплификации 88 пар нуклеотидов, приложение 2.20.
5.3.15. Метод идентификации картофеля, устойчивого к колорадскому жуку сортов Рассет Бурбанк Ньюлив, Супериор Ньюлив, Елизавета 2904/1 kgs, Луговской 1210 amk:
• 1-й раунд, внешние праймеры:
1) 5' СТА ССА СТА AGG ATG ТТА ТСС 3',
2) 5' ATG CAC TCA CGT AGT ССТ СС 3';
• реакционная смесь для проведения ПЦР, рассчитанная на 10 проб:
|
Реактивы |
Объем, мкл |
|
Деионизированная вода |
161,3 |
|
Буфер для ПЦР с MgCl2 (10 x) |
33,0 |
|
Раствор БСА (20 мкг/мл) |
33,0 |
|
Смесь нуклеотидов (10 млМ) |
6,2 |
|
Праймер 1 (20 мкМ) |
2,5 |
|
Праймер 2 (20 мкМ) |
2,5 |
|
Taq-полимераза (5 ед./мкл) |
1,5 |
• реакционную смесь перемешать на вортекс, центрифугировать 30 с при 3000 об./мин, разлить в пробирки для проведения ПЦР по 24,0 мкл в каждую, добавить 1,0 мкл раствора ДНК в каждую пробирку, перемешать, центрифугировать 30 с при 3000 об./мин, при использовании амплификатора с крышкой без подогрева в каждую пробирку добавить каплю минерального масла;
• условия амплификации:
|
Стадия |
Программа амплификации |
|
Денатурация |
2 мин/ 98 °C |
|
Амплификация |
30 с/95 °C, 30 с/60 °C, 40 с/72 °C |
|
Количество циклов амплификации |
20 |
|
Конечное удлинение |
3 мин/72 °C |
|
Фаза остывания |
4 °C |
• хранение не более одного часа в холодильнике до проведения 2-го раунда;
• 2-й раунд, внутренние праймеры:
3) 5' СТА ССА СТА AGG ATG ТТА ТСС 3',
4) 5' TTG TAT AGA AGC TCA CGA GG 3';
• реакционная смесь для проведения ПЦР, рассчитанная на 10 проб:
|
Реактивы |
Объем, мкл |
|
Деионизированная вода |
164,8 |
|
Буфер для ПЦР с MgCl2 (10х) |
33,0 |
|
Раствор БСА (20 мкг/мл) |
33,0 |
|
Смесь нуклеотидов (10 млМ) |
6,2 |
|
Праймер 3 (20 мкМ) |
2,5 |
|
Праймер 4 (20 мкМ) |
2,5 |
|
Taq-полимераза (5 ед./мкл) |
1,5 |
• реакционную смесь перемешать на вортекс, центрифугировать 30 с при 3000 об./мин, разлить в пробирки для проведения ПЦР по 24,5 мкл в каждую, добавить 0,5 мкл раствора ДНК в каждую пробирку, перемешать, центрифугировать 30 с при 3000 об./мин, при использовании амплификатора с крышкой без подогрева в каждую пробирку добавить каплю минерального масла;
• условия амплификации:
|
Стадия |
Программа амплификации |
|
Денатурация |
2 мин/ 98 °C |
|
Амплификация |
30 с/95 °C, 30 с/60 °C, 40 с/72 °C |
|
Количество циклов амплификации |
40 |
|
Конечное удлинение |
3 мин/72 °C |
|
Фаза остывания |
4 °C |
• после проведения амплификации пробы готовы для проведения электрофореза, продукт амплификации - 102 пары нуклеотидов, прилож. 2.21.
6. Проведение электрофореза в агарозном геле
6.1. Приготовление 2 %-го агарозного геля:
• к 1 г агарозы добавить 50 мл 1х буфера ТВЕ, тщательно перемешать;
• полученный раствор поместить в микроволновую печь на 2 - 5 мин или прокипятить на водяной бане 15 мин до полного расплавления агарозы;
• расплавленную агарозу охладить до 56 °C, добавить 5 мкл бромистого этидия, тщательно перемешать, разлить в подготовленную форму, толщина геля 0,5 - 0,7 см, через 30 - 40 мин удалить гребенку;
• готовый гель использовать сразу или хранить в 1х ТВЕ буфере в холодильнике при 4 °C.
6.2. Проведение электрофореза:
• 10 мкл реакционной смеси после аплификации внести в лунку геля, в одну из лунок внести маркер молекулярной массы;
• поместить заполненный гель в камеру для электрофореза с буфером 1х ТБЕ, толщина слоя буфера над поверхностью геля ~ 2 - 3 мм;
• провести электрофорез в режиме постоянного напряжения 100 V 70 - 90 мин;
• гель (без формы) поместить на экран трансиллюминатора;
• документировать результат фореза при помощи гель-документирующей системы, фотокопию геля приложить к отчету по идентификации.
7. ПЦР с детекцией результатов методом ферментного анализа на биологическом микрочипе
7.1. Используются следующие праймеры:
• на 35 S-промотор вируса мозаики цветной капусты:
5' CGG СТА СТС САА GAA TAT CAA AGA TAC AGT TTC AGA AGA (39 н.о),
5' ССА ТТТ ТСС ТТТ ТТТ ATT GTC CTT TCG ATG AAG TGA CAG А (40 н.о.);
• на маркерный ген gus из бактерии Escherichia coli:
5' АСС GTA ССТ CGC ATT ACC CTT ACG CTG AAG AGA (33 н.о.),
5' TGC CCG CTT CGA AAC CAA TGC СТА AAG AGA (30 н.о.);
• на терминатор nos из агробактерии Agrobacterium tumefaciens:
5' GGA CAA GCC GTT TTA CGT TTG GAA CTG АСА GA (32 н.о.),
5' GCC TGA CGT ATG TGC TTA GCT CAT TAA ACT CCA GA (35 н.о.);
• на маркерный ген nptII из транспазона Tn5 бактериального происхождения:
5' GTG ACC CAT GGC GAT GCC TGC TTG С (25 н.о.),
5' ACC CAG CCG GCC АСА GTC GAT GAA TCC AGA (30 н.о.);
• на промотор ocs из агробактерии Agrobacterium tumefaciens:
5' AAA AAG TGG CAG AAC CGG TCA AAC СТА AAA GA (32 н.о.),
5' CGT TAT TAG TTC GCC GCT CGG TGT GTC GTA GA (32 н.о.).
7.2. Набор реактивов для ассиметричной мультиплексной ПЦР (амПЦР) включает:
• сухие смеси, включающие Taq ДНК полимеразу, дезоксинуклеозидтрифосфаты, хлорид магния с конечными концентрациями, соответственно, 1 ед, 200 мкМ и 2,5 млМ, оптимизированную буферную систему для проведения одной стандартной ПЦР;
• растворитель;
• минеральное масло;
• «+» контроль амплификации - 1 пробирка, 0,5 мл.
7.3. Проведение реакции:
• необходимое количество микропробирок с сухими реактивами промаркировать соответствующим образом: «-» контроль», «исследуемые пробы», «+» контроль»;
• добавить во все пробирки по 5 мкл праймеров, 10 мкл растворителя;
• в пробирку, которая служит отрицательным контролем, добавить 5 мкл деионизированной воды, в опытные пробирки - по 5 мкл раствора исследуемой ДНК, в пробирку с положительным контролем - 5 мкл раствора контрольной ДНК;
• добавить во все пробирки по 20 мкл минерального масла;
• пробы готовы для проведения амплификации;
• запустить программу амплификации:
|
Шаг программы |
Температура, °C |
Время инкубации, с |
Количество циклов |
|
1) |
94 |
180 |
1 |
|
2) |
94 |
30 |
42 |
|
3) |
62,5 |
30 |
|
|
4) |
72 |
180 |
1 |
• после проведения амплификации пробы готовы для осуществления гибридизации.
7.4. Гибридизация ДНК, ферментный анализ на биологическом микрочипе и сканирование результатов:
• набор реактивов для ДНК гибридизации и ферментного анализа содержит 20´SSC - 50 мл, диаминобензидин (ДАБ) - 100 таблеток, конъюгат пероксидазы хрена со стрептавидином - 0,1 мл с концентрацией 1 мг/мл, 1 пробирка;
• приготовить рабочие разведения раствора 20´SSC (3 М NaCl, 0,3 М цитрат натрия, pH 7,4): 2´SSC, 0,1 % SDS; 0,1´SSC; 0,1´SSC, 0,1 % SDS; 0,01´SSC.
• схема приготовления 100 мл раствора:
|
Раствор |
20´SSC, мл |
10 %-й SDS, мл |
H2O дист., мл |
|
2´SSC, 0,1 % SDS |
10,00 |
1 |
89,00 |
|
0,1´SSC |
0,50 |
- |
99,50 |
|
0,1´SSC, 0,1 % SDS |
0,50 |
1 |
98,50 |
|
0,01´SSC |
0,05 |
- |
99,95 |
• микропробирки с продуктами амплификации ДНК центрифугировать 1 - 2 с для сбора пробы на дне пробирки, добавить в каждую микропробирку 5 мкл 20´SSC и 0,2 мкл 10 % SDS, перемешать, центрифугировать 1 - 2 с при 3000 об./мин, распределить полученную смесь по поверхности микрочипа, содержащей зоны иммобилизованных олигонуклеотидов;
• поместить микрочип во влажную камеру, поставить на 1 ч в воздушный термостат с температурой 42 °C;
• по окончании реакции капли смыть буфером 2´SSC, 0,1 % SDS, тщательно промыть чип растворами 2´SSC, 0,1 % SDS - 1 раз 5 мин, 0,1´SSC, 0,1 % SDS - 2 раза по 5 мин, 0,1´SSC - 5 раз по 1 мин, 0,01´SSC в течение 10 с.
7.5. Проведение ферментного анализа:
• исходный стрептавидин-пероксидазный конъюгат разбавить в 200 раз буфером 1´SSC, содержащим 1 % БСА (бычий сывороточный альбумин), из расчета 25 мкл на микрочип;
• нанести 25 - 30 мкл разведенного конъюгата на рабочую зону микрочипа и поместить его на 30 мин во влажную камеру при комнатной температуре;
• смыть конъюгат раствором 1´SSC;
• залить микрочип раствором 2´SSC, промыть 5 мин;
• промыть микрочип раствором 1´SSC;
• непосредственно перед применением приготовить раствор субстрата - диаминобензидина (ДАБ), для этого растворить таблетку ДАБ в 1 см3 буфера 0,1´SSC, добавить 30 мм3 3 %-го раствора пероксида водорода и перемешать, раствор использовать немедленно;
• залить рабочую зону микрочипа раствором субстрата, выдержать от 2 до 10 мин при комнатной температуре;
• в случае положительной реакции появляются коричневые пятна окисленного субстрата;
• промыть микрочип дистиллированной водой, встряхнуть капли воды и поместить в термостат 42 °C на 5 - 10 мин, после сушки микрочип с окрашенными зонами хранить в темном месте.
7.6. Сканирование биологических микрочипов:
• осуществлять с применением аппаратно-программного комплекса для анализа биологических микрочипов типа «ДЕГМИГЕН-001» и компьютерной программы для анализа изображений;
• в соответствии с руководством по эксплуатации, поставляемым в комплекте с аппаратно-программным комплексом подготовить сканер микрочипов к работе;
• поместить микрочип в рамку для сканирования, зафиксировать его и закрыть рамку;
• запустить программу сканирования, функционирующую в диалоговом режиме, дождаться появления на мониторе приглашения к сканированию и только после этого вставить рамку с микрочипом в приемное окно детектора;
• после завершения сканирования микрочипа сохранить изображение, присвоив файлу соответствующее имя.
7.7. Анализ изображений биочипов:
• запустить программу обработки изображения микрочипа, ввести оцифрованное изображение в программу, для этого выбрать опцию «Файл», открыть изображение, в появившемся диалоговом окне выбрать формат, в котором представлены изображения, и выбрать в списке нужный файл, изображение появится в основном окне программы;
• провести операцию разметки матрицы, чтобы совместить центры измерительных зондов с центрами пятен решетки в изображении, для этого выбрать опцию «Анализ», «Разметка матрицы»;
• разметка начинается с рисования прямоугольника, боковые стороны которого проходят через центры узлов крайних столбцов, для этого нужно щелкнуть левой кнопкой мыши в центре левого верхнего пятна/ячейки, затем, держа кнопку нажатой, переместить правую нижнюю вершину появившегося прямоугольника в центр нижнего правого узла;
• в результате предварительной разметки на экране появится четырехугольник, с внутренними линиями, расположенными равномерно, в соответствии с заданным числом столбцов матрицы, чтобы завершить разметку и закрыть диалоговое окно, нужно нажать клавишу «Принять»;
• после завершения базовой разметки провести автоматическую коррекцию положения зондов, для этого в меню выбрать опцию «Настройки / Автоматическая подстройка»;
• для анализа результатов нужно выбрать опцию меню «Анализ» - «Показать результаты», по окончании измерений программа предоставляет возможность подготовки и распечатки протокола испытаний, для этого нужно выбрать опцию меню «Файл» и затем «Заполнить протокол», после этого появится окно с формой для заполнения, после того как она будет заполнена, нажать кнопку «Выход».
7.8. Интерпретация результатов:
• появление регистрируемого компьютерной программой оптического сигнала в одной, нескольких или во всех пяти зонах гибридизации, содержащих иммобилизованные олигонуклеотиды, указывает на присутствие рекомбинантной ДНК, свидетельствующей о наличии ГМО растительного происхождения в анализируемом образце;
• отсутствие регистрируемого оптического сигнала во всех пяти гибридизационных зонах, содержащих иммобилизованные олигонуклеотиды, указывает на отсутствие рекомбинантной ДНК, что свидетельствует о том, что анализируемый образец не имеет ГМО растительного происхождения;
• появление оптического сигнала в зоне гибридизации при использовании отрицательного контроля амплификации, свидетельствует о получении ложноположительного результата, причиной может быть загрязнение реактивов и/или оборудования, в этом случае необходимо обработать поверхности лабораторных столов и оборудования раствором 1 Н соляной кислоты, заменить реактивы на свежеприготовленные и повторить анализ;
• отсутствие оптического сигнала при использовании положительного контроля амплификации свидетельствует о получении ложноотрицательного результата, причиной могут быть потеря активности одного из компонентов реакционной смеси для амПЦР и/или гибридизации с применением ферментного анализа на биологическом микрочипе, в этом случае необходимо заменить реактивы на свежеприготовленные и повторить анализ.
8. Количественный анализ методом ПЦР в реальном времени
8.1. Метод количественного определения генетически модифицированной сои:
• метод позволяет количественно определить рекомбинантную ДНК, характерную для генетически модифицированных линий сои в пищевых продуктах методом ПЦР в реальном времени;
• анализ проводится по гену лектина, который присутствует в геноме всех линий сои, и универсальной последовательности 35 S промотора вируса мозаики цветной капусты, который присутствует в геноме всех генетически модифицированных линий сои;
• праймеры на ген лектина:
1) 5' ТСС АСС ССС АТС СAC ATT T 3',
2) 5' GGC ATA GAA GGT GAA GTT GAA GGA 3',
3) 5' - FAM - AAC CGG TAG CGT TGC CAG СТТ CG - TAMRA - 3',
длина ампликона 81 пара нуклеотидов;
• праймеры на целевую последовательность ГМО:
4) 5' GCC TCT GCC GAC AGT GGT 3',
5) 5' AAG ACG TGG TTG GAA CGT СТТ С 3',
6) 5' - FAM - CAA AGA TGG АСС ССС АСС САС G - TAMRA - 3',
длина ампликона 82 пары нуклеотидов;
• реакционная смесь для проведения ПЦР, количественное определение ДНК сои:
|
Реактивы |
Объем, мкл |
|
Раствор целевой ДНК (максимальное количество ДНК 200 нг) |
10,00 |
|
Taq-полимераза (5 ед./мкл) |
0,25 |
|
Буфер для ПЦР без MgCl2 (10х) |
5,00 |
|
Концентрация в реакционной смеси |
|
|
MgCl2 (25 ммоль/л) |
5 ммоль/л |
|
Праймеры 1, 2 |
900 нмоль/л каждого |
|
dUTP |
400 ммоль/л |
|
Смесь нуклеотидов dATP, dCTP, dGTP (2,5 ммоль/л каждого) |
200 ммоль/л каждого |
|
Праймер 3 |
100 нмоль/л |
|
Деионизированная вода |
Довести до 50,00 мкл |
• реакционная смесь для проведения ПЦР, количественное определение рекомбинантной ДНК:
|
Реактивы |
Объем, мкл |
|
Раствор целевой ДНК (максимальное количество ДНК 200 нг) |
10,00 |
|
Taq-полимераза (5 ед./мкл) |
0,25 |
|
Буфер для ПЦР без MgCl2 (10х) |
5,00 |
|
Концентрация в реакционной смеси |
|
|
MgCl2 (25 ммоль/л) |
5 ммоль/л |
|
Праймеры 4, 5 |
900 нмоль/л каждого |
|
dUTP |
400 ммоль/л |
|
Смесь нуклеотидов dATP, dCTP, dGTP |
200 ммоль/л каждого |
|
(2,5 ммоль/л каждого) |
|
|
Праймер 6 |
100 нмоль/л |
|
Деионизированная вода |
Довести до 50,00 мкл |
• при проведении исследования использовали стандартные образцы состава генетически модифицированной сои;
• условия амплификации:
|
Стадия |
Программа амплификации |
|
Доамплификационный период |
2 мин/50 °C |
|
Денатурация |
10 мин/95 °С |
|
Амплификация |
15 с/95 °C, 60 с/60 °C измерение |
|
Количество циклов амплификации |
45 |
• результаты исследования, приложение 22.
8.2. Метод количественного определения генетически модифицированной кукурузы:
• метод позволяет количественно определить рекомбинантную ДНК, характерную для генетически модифицированных линий кукурузы, в пищевых продуктах методом ПЦР в реальном времени;
• анализ проводится по гену инвертазы кукурузы, который присутствует в геноме всех линий кукурузы, и универсальной последовательности 35 S промотора вируса мозаики цветной капусты, который присутствует в геноме всех генетически модифицированных линий, за исключением GA 21;
• праймеры на ген инвертазы кукурузы:
1) 5' САС ТСС АТС GTG GAG AGC ТТ 3',
2) 5' GGC GTT GTT GAA GAG GAA GA 3',
3) 5' - FAM - TAC ССС АСА CGA GCC АТС ТАС GAC Т - TAMRA - 3,
длина ампликона 111 пар нуклеотидов;
• праймеры, на целевую последовательность ГМО:
4) 5' CGT СТТ САА AGC AAG TGG ATT G 3',
5) 5' ТСТ TGC GAA GGA TAG TGG GAT T 3',
6) 5' - FAM - TCT CCA CTG ACG TAA GGG ATG ACG CA - TAMRA - 3',
длина ампликона 79 пар нуклеотидов;
• реакционная смесь для проведения ПЦР, количественное определение ДНК кукурузы:
|
Реактивы |
Объем, мкл |
|
Раствор целевой ДНК (максимальное количество ДНК 200 нг) |
10,00 |
|
Taq-полимераза (5 ед./мкл) |
0,25 |
|
Буфер для ПЦР без MgCl2 (10х) |
5,00 |
|
Концентрация в реакционной смеси |
|
|
MgCl2 (25 ммоль/л) |
5 ммоль/л |
|
Праймеры 1, 2 |
900 нмоль/л каждого |
|
dUTP |
400 ммоль/л |
|
Смесь нуклеотидов dATP, dCTP, dGTP (2,5 ммоль/л каждого) |
200 ммоль/л каждого |
|
Праймер 3 |
100 нмоль/л |
|
Деионизированная вода |
Довести до 50,00 мкл |
• реакционная смесь для проведения ПЦР, количественное определение рекомбинантной ДНК:
|
Реактивы |
Объем, мкл |
|
Раствор целевой ДНК (максимальное количество ДНК 200 нг) |
10,00 |
|
Taq-полимераза (5 ед./мкл) |
0,25 |
|
Буфер для ПЦР без MgCl2 (10х) |
5,00 |
|
Концентрация в реакционной смеси |
|
|
MgCl2 (25 ммоль/л) |
5 ммоль/л |
|
Праймеры 4, 5 |
900 нмоль/л каждого |
|
dUTP |
400 ммоль/л |
|
Смесь нуклеотидов dATP, dCTP, dGTP (2,5 ммоль/л каждого) |
200 ммоль/л каждого |
|
Праймер 6 |
100 нмоль/л |
|
Деионизированная вода |
Довести до 50,00 мкл |
• при проведении исследования использовали стандартные образцы состава генетически модифицированной кукурузы;
• условия амплификации:
|
Стадия |
Программа амплификации |
|
Доамплификационный период |
2 мин/ 50 °C |
|
Денатурация |
10 мин/95 °C |
|
Амплификация |
15 с/95 °C, 30 с/60 °C измерение |
|
Количество циклов амплификации |
50 |
• результат исследований, прилож. 23.
8.3. Метрологические характеристики метода:
• границы интервала, в котором погрешность определения находится с доверительной вероятностью P = 0,95, составляют от 0,1 % до 5,0 %, нижнюю и верхнюю границы погрешности определяют с использованием сертифицированных стандартных образцов состава и свойств, стандартные отклонения повторяемости результатов (δ) составляет от 0,067 (для стандарта 0,1 %) до 0,540 (для стандарта 5 %), что соответствует погрешности сертифицированных стандартных образцов состава ГМО растительного происхождения;
• результаты анализа образцов принимают, если коэффициент корреляции калибровочной прямой, построенной по сертифицированным стандартным образцам состава ГМО растительного происхождения, по методу наименьших квадратов (R2) > 0,97.
8.4. Метод количественного определения сои линии 40-3-2:
• основан на ПЦР в реальном времени с определением гена лектина и генетической конструкции, характерной для сои линии 40-3-2;
• используются зонды, специфичные к трансгену и гену лектина, меченые красителями FAM и VIC соответственно;
• для построения калибровочной прямой используются стандартные образцы состава генетически модифицированной сои: 5,0, 2,0, 1,0, 0,5 и 0,0 %;
• праймеры на ген лектина сои:
1) 5' ТСС АСС ССС АТС САС АТТ Т 3',
2) 5' GGC ATA GAA GGT GAA GTT GAA GGA 3',
3) 5' - VIC - AAC CGG TAG CGT TGC CAG CTT CG - TAMRA - 3';
• на целевую последовательность ГМО:
4) 5' GCC ATG TTG TTA ATT TGT GCC AT 3'
5) 5' GAA GTT CAT TTC ATT TGG AGA GGA С 3'
6) 5' - FAM - CTT GAA AGA TCT GCT AGA GTC AGC TTG TCA GCG - TAMRA - 3'
• реакционная смесь для проведения ПЦР:
|
Реактивы |
Объем, мкл |
|
Раствор целевой ДНК (максимальное количество ДНК 50 - 200 нг) |
5,00 |
|
Деионизированная вода |
18,30 |
|
Праймеры 1, 2 (20 мкМ) |
0,10 каждого |
|
Праймеры 4, 5 (20 мкМ) |
0,25 каждого |
|
Праймеры 3, 6 (10 мкМ) |
0,50 каждого |
|
Смесь нуклеотидов (4 млМ) |
10,00 |
|
Буфер для ПЦР 10х |
10,60 |
|
MgCl2 раствор (50 млМ) |
4,00 |
|
Taq-полимераза (5 ед./мкл) |
0,40 |
|
Итого: |
50,00 |
• условия амплификации:
|
Стадия |
Программа амплификации |
|
Доамплификационный период |
2 мин/ 50 °C |
|
Денатурация первичная |
10 мин/ 95 °C |
|
Амплификация |
|
|
Денатурация |
15 с/95 °C |
|
Отжиг |
60 с/60 °C измерение |
|
Количество циклов амплификации |
45 |
8.5. Метод количественного определения сои линии А2704-12:
• основан на ПЦР в реальном времени, с определением гена лектина и области ДНК, специфичной трансформационному событию А2704-12;
• используются зонды, меченые красителем FAM;
• для построения калибровочной прямой используются стандартные образцы состава генетически модифицированной сои А2704-12: 0,1, 0,4,0,9, 2,0, 3,3 %;
• праймеры на ген лектина сои:
1) 5' САС СТТ ТСТ CGC ACC AAT TGA СА 3',
2) 5' ТСА ААС ТСА АСА GCG ACG АС 3',
3) 5' - FAM - CCA САА АСА CAT GCA GGT TAT СТТ GG - TAMRA - 3',
длина ампликона 105 пар нуклеотидов;
• праймеры на целевую последовательность ГМО:
4) 5' GCA AAA AAG CGG TTA GCT ССТ 3',
5) 5' ATT CAG GCT GCG САА CTG ТТ 3',
6) 5' - FAM - CGG ТСС ТСС GAT CGC ССТ ТСС - TAMRA - 3',
длина ампликона 64 пары нуклеотидов;
• реакционная смесь для проведения ПЦР, количественное определение ДНК сои:
|
Реактивы |
Объем, мкл |
|
Раствор целевой ДНК (максимальное количество ДНК 50 - 200 нг) |
5,0 |
|
Деионизированная вода |
18,0 |
|
Праймеры 1, 2 (20 мкМ) |
0,5 каждого |
|
Праймер 3 (10 мкМ) |
1,0 |
|
Смесь нуклеотидов (4 млМ) |
10,0 |
|
Буфер для ПЦР 10х |
10,6 |
|
MgCl2 раствор (50 млМ) |
4,0 |
|
Taq-полимераза (5 ед./мкл) |
0,4 |
|
Итого: |
50,0 |
• реакционная смесь для проведения ПЦР, количественное определение рекомбинантной ДНК:
|
Реактивы |
Объем, мкл |
|
Раствор целевой ДНК (максимальное количество ДНК 50 - 200 нг) |
5,0 |
|
Деионизированная вода |
17,0 |
|
Праймеры 4, 5 (20 мкМ) |
1,0 каждого |
|
Праймер 6 (10 мкМ) |
1,0 |
|
Смесь нуклеотидов (4 млМ) |
10,0 |
|
Буфер для ПЦР 10х |
10,6 |
|
MgCl2 раствор (50 млМ) |
4,0 |
|
Taq-полимераза (5 ед./мкл) |
0,4 |
|
Итого: |
50,0 |
• условия амплификации:
|
Стадия |
Программа амплификации |
|
Доамплификационный период |
2 мин/ 50 °C |
|
Денатурация первичная |
10 мин/ 95 °C |
|
Амплификация |
|
|
Денатурация |
15 с/95 °C |
|
Отжиг |
60 с/60 °C измерение |
|
Количество циклов амплификации |
45 |
8.6. Метод количественного определения кукурузы линии MON 810:
• основан на ПЦР в реальном времени с определением гена, кодирующего синтез группы белков, присущих для всех линий кукурузы (hmg) и области ДНК, специфичной трансформационному событию MON 810, на границе генома кукурузы и элемента генетической конструкции промотора 35 S из вируса мозаики цветной капусты;
• используются зонды, меченые красителем FAM;
• для построения калибровочной прямой используются стандартные образцы состава генетически модифицированной кукурузы: < 0,02, 0,1, 0,5, 1,0, 2,0, 5,0 %;
• праймеры на ген hmg:
1) 5' TTG GAC TAG AAA TCT CGT GCC CA 3',
2) 5' GCT АСА TAG GGA GCC TTG ТСС Т 3',
3) 5' - FAM - CAA ТСС АСА CAA ACG CAC GCG ТА - TAMRA - 3',
длина ампликона 79 пар нуклеотидов;
• праймеры на целевую последовательность ГМО:
4) 5' TCG AAG GAC GAA GGA CTC TAA CGT 3',
5) 5' GCC АСС ТТС СТТ ТТС CAC TAT CTT 3',
6) 5' - FAM - AAC АТС СТТ TGC CAT TGC CCA GC - TAMRA - 3',
длина ампликона 92 пары нуклеотидов;
• реакционная смесь для проведения ПЦР, количественное определение ДНК кукурузы:
|
Реактивы |
Объем, мкл |
|
Раствор целевой ДНК (максимальное количество ДНК 50 - 200 нг) |
5,0 |
|
Деионизированная вода |
19,3 |
|
Праймеры 1, 2 (20 мкМ) |
0,1 каждого |
|
Праймер 3 (10 мкМ) |
0,5 |
|
Смесь нуклеотидов (4 млМ) |
10,0 |
|
Буфер для ПЦР 10х |
10,6 |
|
MgCl2 раствор (50 млМ) |
4,0 |
|
Taq-полимераза (5 ед./мкл) |
0,4 |
|
Итого: |
50,0 |
• реакционная смесь для проведения ПЦР, количественное определение рекомбинантной ДНК:
|
Реактивы |
Объем, мкл |
|
Раствор целевой ДНК (максимальное количество ДНК 50 - 200 нг) |
5,0 |
|
Деионизированная вода |
19,0 |
|
Праймеры 4, 5 (20 мкМ) |
0,25 каждого |
|
Праймер 6 (10 мкМ) |
0,5 |
|
Смесь нуклеотидов (4 млМ) |
10,0 |
|
Буфер для ПЦР 10х |
10,6 |
|
MgCl2 раствор (50 млМ) |
4,0 |
|
Taq-полимераза (5 ед./мкл) |
0,4 |
|
Итого: |
50,0 |
• условия амплификации:
|
Стадия |
Программа амплификации |
|
Доамплификационный период |
2 мин/ 50 °C |
|
Денатурация первичная |
10 мин/ 95 °C |
|
Амплификация |
|
|
Денатурация |
15 с/95 °C, |
|
Отжиг |
60 с/60 °C измерение |
|
Количество циклов амплификации |
45 |
8.7. Метод количественного определения кукурузы линии MON 863:
• основан на ПЦР в реальном времени с определением гена; кодирующего синтез алкогольдегидрогеназы 1 (adhl 1), присущей для всех линий кукурузы и области ДНК, специфичной трансформационному событию MON 863, на границе генома кукурузы и элемента генетической конструкции;
• используются зонды, меченые красителем FAM;
• для построения калибровочной прямой используются стандартные образцы состава генетически модифицированной кукурузы: 0,01, 1,0, 5,0, 10,0 %;
• праймеры на ген adhl 1:
1) 5' CCA GCC TCA TGG CCA AAG 3',
2) 5' CCT TCT TGG CGG CTT АТС TG 3',
3) 5' - FAM - CTT AGG GGC AGA CTC CCG TGT ТСС СТ - 3',
длина ампликона 84 пары нуклеотидов;
• праймеры на целевую последовательность ГМО:
4) 5' GTA GGA TCG GAA AGC TTG GTA С 3',
5) 5' TGT TAC GGC СТА ААТ GCT GAA CT 3',
6) 5' - FAM - TGA АСА ССС АТС CGA АСА AGT AGG GTC А - TAMRA - 3',
длина ампликона 70 пар нуклеотидов;
• реакционная смесь для проведения ПЦР, количественное определение ДНК кукурузы:
|
Реактивы |
Объем, мкл |
|
Раствор целевой ДНК (максимальное количество ДНК 200 нг) |
4,00 |
|
Деионизированная вода |
19,00 |
|
Праймеры 1, 2 (10 мкМ) |
0,75 каждого |
|
Праймер 3 (5 мкМ) |
0,50 |
|
Смесь нуклеотидов (4 млМ) |
10,00 |
|
Буфер для ПЦР 10х |
10,60 |
|
MgCl2 раствор (50 млМ) |
4,00 |
|
Taq-полимераза (5 ед./мкл) |
0,40 |
|
Итого: |
50,00 |
• реакционная смесь для проведения ПЦР, количественное определение рекомбинантной ДНК:
|
Реактивы |
Объем, мкл |
|
Раствор целевой ДНК (максимальное количество ДНК 200 нг) |
4,00 |
|
Деионизированная вода |
19,00 |
|
Праймеры 4, 5 (10 мкМ) |
0,75 каждого |
|
Праймер 6 (5 мкМ) |
0,50 |
|
Смесь нуклеотидов (4 млМ) |
10,00 |
|
Буфер для ПЦР 10х |
10,60 |
|
MgCl2 раствор (50 млМ) |
4,00 |
|
Taq-полимераза (5 ед./мкл) |
0,40 |
|
Итого: |
50,00 |
• условия амплификации:
|
Стадия |
Программа амплификации |
|
Доамплификационный период |
2 мин/ 50 °C |
|
Денатурация первичная |
10 мин/95 °C |
|
Амплификация |
|
|
Денатурация |
15 с/95 °C |
|
Отжиг |
60 с/60 °C измерение |
|
Количество циклов амплификации |
45 |
8.8. Метод количественного определения кукурузы линии NK 603:
• основан на ПЦР в реальном времени с определением гена, кодирующего синтез алкогольдегидрогеназы 1 (adhl 1), присущей для всех линий кукурузы, и области ДНК, специфичной трансформационному событию NK 603, на границе генома кукурузы и элемента генетической конструкции;
• используются зонды, меченые красителем FAM;
• для построения калибровочной прямой используются стандартные образцы состава генетически модифицированной кукурузы: 0,10, 0,49, 0,98, 1,96, 4,91 %;
• праймеры на ген adhl 1:
1) 5' CCA GCC TCA TGG CCA AAG 3',
2) 5' CCT TCT TGG CGG CTT АТС TG 3',
3) 5' - FAM - CTT AGG GGC AGA CTC CCG TGT ТСС СТ - 3',
длина ампликона 70 пар нуклеотидов;
• праймеры на целевую последовательность ГМО:
4) 5' ATG AAT GAC CTC GAG TAA GCT TGT TAA 3',
5) 5' AAG AGA TAA CAG GAT CCA CTC AAA САС Т 3',
6) 5' - FAM - TGG ТАС САС GCG АСА САС ТТС САС TC - TAMRA - 3',
длина ампликона 108 пар нуклеотидов;
• реакционная смесь для проведения ПЦР, количественное определение ДНК кукурузы:
|
Реактивы |
Объем, мкл |
|
Раствор целевой ДНК (максимальное количество ДНК 200 нг) |
4,00 |
|
Деионизированная вода |
19,00 |
|
Праймеры 1, 2 (10 мкМ) |
0,75 каждого |
|
Праймер 3 (5 мкМ) |
0,50 |
|
Смесь нуклеотидов (4 млМ) |
10,00 |
|
Буфер для ПЦР 10X |
10,60 |
|
MgCl2 раствор (50 млМ) |
4,00 |
|
Taq-полимераза (5 ед./мкл) |
0,40 |
|
Итого: |
50,00 |
• реакционная смесь для проведения ГЩР, количественное определение рекомбинантной ДНК:
|
Реактивы |
Объем, мкл |
|
Раствор целевой ДНК (максимальное количество ДНК 200 нг) |
4,00 |
|
Деионизированная вода |
19,00 |
|
Праймеры 4, 5 (10 мкМ) |
0,75 каждого |
|
Праймер 6 (5 мкМ) |
0,50 |
|
Смесь нуклеотидов (4 млМ) |
10,00 |
|
Буфер для ПЦР 10х |
10,60 |
|
MgCl2 раствор (50 млМ) |
4,00 |
|
Taq-полимераза (5 ед./мкл) |
0,40 |
|
Итого: |
50,00 |
• условия амплификации:
|
Стадия |
Программа амплификации |
|
Доамплификационный период |
2 мин/ 50 °C |
|
Денатурация первичная |
10 мин/ 95 °C |
|
Амплификация |
|
|
Денатурация |
15 с/95 °C |
|
Отжиг |
60 с/60 °C измерение |
|
Количество циклов амплификации |
45 |
8.9. Метод количественного определения кукурузы линии Bt 11:
• основан на ПЦР в реальном времени с определением гена, кодирующего синтез алкогольдегидрогеназы 1 (adhl 1), присущей для всех линий кукурузы, и области ДНК, специфичной трансформационному событию Bt 11, на границе генома кукурузы и элемента генетической конструкции;
• используются зонды, меченые красителем FAM;
• для построения калибровочной прямой используются стандартные образцы состава генетически модифицированной кукурузы: 0,1, 0,3, 0,7, 1,0, 1,3, 2,0 %;
• праймеры на ген adhl 1:
1) 5' CGT CGT ТТС ССА ТСТ СТТ ССТ СС 3',
2) 5' CCA CTC CGA GAC ССТ CAG ТС 3',
3) 5' - FAM - AAT CAG GGC ТСА ТТТ ТСТ CGC ТСС TCA - TAMRA - 3';
• праймеры на целевую последовательность ГМО:
4) 5' GCG GAA ССС СТА ТТТ GTT ТА 3',
5) 5' ТСС AAG ААТ ССС ТСС ATG AG 3',
6) 5' - FAM - AAA TAG ATT CAA ATA TGT АТС CGC TCA - TAMRA - 3';
• реакционная смесь для проведения ПЦР, количественное определение ДНК кукурузы:
|
Реактивы |
Объем, мкл |
|
Раствор целевой ДНК (максимальное количество ДНК 250 нг) |
6,000 |
|
Деионизированная вода |
9,000 |
|
Праймеры 1, 2 (20 мкМ) |
0,375 каждого |
|
Праймер 3 (10 мкМ) |
0,500 |
|
Смесь нуклеотидов dATP, dCTP, dGTP (10 млМ) |
0,500 каждого |
|
dUTP (20 млМ) |
0,500 |
|
Буфер для ПЦР 10х |
2,500 |
|
MgCl2 раствор (25 млМ) |
4,000 |
|
Taq-полимераза (5 ед./мкл) |
0,250 |
|
Итого: |
25,000 |
• реакционная смесь для проведения ПЦР, количественное определение рекомбинантной ДНК:
|
Реактивы |
Объем, мкл |
|
Раствор целевой ДНК (максимальное количество ДНК 200 нг) |
6,0000 |
|
Деионизированная вода |
7,7500 |
|
Праймеры 4, 5 (20 мкМ) |
0,9375 каждого |
|
Праймер 6 (10 мкМ) |
0,6250 |
|
Смесь нуклеотидов dATP, dCTP, dGTP (10 млМ) |
0,5000 каждого |
|
dUTP (20 млМ) |
0,5000 |
|
Буфер для ПЦР 10х |
2,5000 |
|
MgCl2 раствор (50 млМ) |
4,0000 |
|
Taq-полимераза (5 ед./мкл) |
0,2500 |
|
Итого: |
25,0000 |
• условия амплификации:
|
Стадия |
Программа амплификации |
|
Доамплификационный период |
2 мин/ 50 °C |
|
Денатурация первичная |
10 мин/ 95 °C |
|
Амплификация |
|
|
Денатурация |
15 с/95 °C |
|
Отжиг |
60 с/60 °C измерение |
|
Количество циклов амплификации |
45 |
8.10. Метод количественного определения кукурузы линии Т 25:
• основан на ПЦР в реальном времени с определением гена, кодирующего синтез алкогольдегидрогеназы 1 (adhl 1), присущей для всех линий кукурузы, и области ДНК, специфичной трансформационному событию Т 25, на границе генома кукурузы и элемента генетической конструкции;
• используются зонды, меченые красителем FAM;
• для построения калибровочной прямой используются стандартные образцы состава генетически модифицированной кукурузы: 0,15, 0,40, 0,90, 2,00, 3,30 %;
• праймеры на ген adhl 1:
1) 5' CGT CGT TTC CCA ТСТ СТТ ССТ ССТ 3',
2) 5' CCA CTC CGA GAC ССТ CAG ТС 3',
3) 5' - FAM - AAT CAG GGC ТСА ТТТ ТСТ CGC ТСС TCA - TAMRA - 3',
длина ампликона 136 пар нуклеотидов;
• праймеры на целевую последовательность ГМО:
4) 5' АСА AGC GTG TCG TGC ТСС АС 3',
5) 5' GAC ATG ATA CTC СТТ CCA CCG 3',
6) 5' - FAM - ТСА TTG AGT CGT ТСС GCC ATT GTC G - TAMRA - 3',
длина ампликона 102 пары нуклеотидов;
• реакционная смесь для проведения ПЦР, количественное определение ДНК кукурузы:
|
Реактивы |
Объем, мкл |
|
Раствор целевой ДНК (максимальное количество ДНК 200 нг) |
5,00 |
|
Деионизированная вода |
9,75 |
|
Праймеры 1, 2 (10 мкМ) |
0,50 каждого |
|
Праймер 3 (10 мкМ) |
0,50 |
|
Смесь нуклеотидов dATP, dCTP, dGTP (10 млМ) |
0,50 каждого |
|
dUTP (20 млМ) |
0,50 |
|
Буфер для ПЦР 10х |
2,50 |
|
MgCl2 раствор (25 млМ) |
4,00 |
|
Taq-полимераза (5 ед./мкл) |
0,25 |
|
Итого: |
25,00 |
• реакционная смесь для проведения ПЦР, количественное определение рекомбинантной ДНК:
|
Реактивы |
Объем, мкл |
|
Раствор целевой ДНК (максимальное количество ДНК 200 нг) |
5,00 |
|
Деионизированная вода |
8,75 |
|
Праймеры 4, 5 (10 мкМ) |
1,00 каждого |
|
Праймер 6 (10 мкМ) |
0,50 |
|
Смесь нуклеотидов dATP, dCTP, dGTP (10 млМ) |
0,50 каждого |
|
dUTP (20 млМ) |
0,50 |
|
Буфер для ПЦР 10х |
2,50 |
|
MgCl2 раствор (50 млМ) |
4,00 |
|
Taq-полимераза (5 ед./мкл) |
0,25 |
|
Итого: |
25,00 |
• условия амплификации:
|
Стадия |
Программа амплификации |
|
Доамплификационный период |
2 мин/ 50 °C |
|
Денатурация первичная |
10 мин/95 °C |
|
Амплификация |
|
|
Денатурация |
15 с/95 °C |
|
Отжиг |
60 с/60 °C измерение |
|
Количество циклов амплификации |
45 |
8.11. Метод количественного определения кукурузы линии GA 21:
• основан на ПЦР в реальном времени с определением гена, кодирующего синтез алкогольдегидрогеназы 1 (adhl 1), присущей для всех линий кукурузы и области ДНК, специфичной трансформационному событию GA 21, на границе генома кукурузы и элемента генетической конструкции;
• используются зонды, меченые красителем FAM;
• для построения калибровочной прямой используются стандартные образцы состава генетически модифицированной кукурузы: 0,10, 0,49, 0,98, 1,3, 1,71, 4,26 %;
• праймеры на ген adhl 1:
1) 5' CCA GCC TCA TGG CCA AAG 3',
2) 5' CCT TCT TGG CGG CTT АТС TG 3',
3) 5' - FAM - CTT AGG GGC AGA CTC CCG TGT TCC CT - TAMRA - 3',
длина ампликона 70 пар нуклеотидов;
• праймеры на целевую последовательность ГМО:
4) 5' СТТ АТС GTT ATG СТА ТТТ GCA ACT ТТА GA 3',
5) 5' TGG CTC GCG АТС CTC CT 3',
6) 5' - FAM - CAT ATA СТА ACT CAT АТС TCT TTC TCA АСА GCA GGT GGG T - TAMRA - 3',
длина ампликона 112 пар нуклеотидов;
• реакционная смесь для проведения ПЦР, количественное определение ДНК кукурузы:
|
Реактивы |
Объем, мкл |
|
Раствор целевой ДНК (максимальное количество ДНК 300 нг) |
5,00 |
|
Taq-полимераза (5 ед./мкл) |
0,25 |
|
Буфер для ПЦР 10х |
5,00 |
|
Концентрация в реакционной смеси |
|
|
MgCl2 раствор |
5,00 ммоль/л |
|
Праймеры 1, 2 |
150,00 нмоль/л каждого |
|
dUTP |
400,00 мкмоль/л |
|
Смесь нуклеотидов dATP, dCTP, dGTP |
200,00 мкмоль/л каждого |
|
Праймер 3 |
50,00 нмоль/л |
|
Деионизированная вода |
довести до 50,00 мкл |
• реакционная смесь для проведения ПЦР, количественное определение рекомбинантной ДНК:
|
Реактивы |
Объем, мкл |
|
Раствор целевой ДНК (максимальное количество ДНК 300 нг) |
5,00 |
|
Taq-полимераза (5 ед./мкл) |
0,25 |
|
Буфер для ПЦР 10х |
5,00 |
|
Концентрация в реакционной смеси |
|
|
MgCl2 раствор |
5,00 ммоль/л |
|
Праймеры 4, 5 |
150,00 нмоль/л каждого |
|
dUTP |
400,00 мкмоль/л |
|
Смесь нуклеотидов dATP, dCTP, dGTP |
200,00 мкмоль/л каждого |
|
Праймер 6 |
50,00 нмоль/л |
|
Деионизированная вода |
довести до 50,00 мкл |
• условия амплификации:
|
Стадия |
Программа амплификации |
|
Доамплификационный период |
2 мин/ 50 °C |
|
Денатурация первичная |
10 мин/95 °C |
|
Амплификация |
|
|
Денатурация |
15 с/95 °C |
|
Отжиг |
60 с/60 °C измерение |
|
Количество циклов амплификации |
45 |
8.12. Метод количественного определения кукурузы линии MIR 604:
• основан на ПЦР в реальном времени с определением гена, кодирующего синтез алкогольдегидрогеназы 1 (adhl 1), присущей для всех линий кукурузы, и области ДНК, специфичной трансформационному событию MIR 604, на границе генома кукурузы и элемента генетической конструкции;
• используются зонды, меченые красителем FAM и VIC;
• для построения калибровочной прямой используются стандартные образцы состава и свойств генетически модифицированной кукурузы: менее 0,09, 0,10, 0,98, 9,85 %;
• праймеры на ген adhl 1:
1) 5' CGT CGT ТТС ССА ТСТ СТТ ССТ СС 3',
2) 5' CCA CTC CGA GAC ССТ CAG ТС 3',
3) 5' - VIC - AAT CAG GGC ТСА ТТТ ТСТ CGC ТСС TCA - TAMRA - 3',
длина ампликона 136 пар нуклеотидов;
• праймеры на целевую последовательность ГМО:
4) 5' GCG CAC GCA ATT CAA CAG 3',
5) 5' GGT CAT AAC GTG ACT CCC TTA ATT CT 3',
6) 5' - FAM - AGG CGG GAA ACG АСА АТС TGA ТСА TG - TAMRA - 3',
длина ампликона 76 пар нуклеотидов;
• реакционная смесь для проведения ПЦР, количественное определение ДНК кукурузы:
|
Реактивы |
Объем, мкл |
|
Раствор целевой ДНК (максимальное количество ДНК 250 нг) |
5,00 |
|
Taq-полимераза (5 ед./мкл) |
0,25 |
|
Буфер для ПЦР 10х |
5,00 |
|
Концентрация в реакционной смеси |
|
|
MgCl2 раствор |
5,00 ммоль/л |
|
Праймеры 1, 2 |
300 нмоль/л каждого |
|
dUTP |
400 мкмоль/л |
|
Смесь нуклеотидов dATP, dCTP, dGTP |
200 мкмоль/л каждого |
|
Праймер 3 |
200 нмоль/л |
|
Деионизированная вода |
довести до 25,00 мкл |
• реакционная смесь для проведения ПЦР, количественное определение рекомбинантной ДНК:
|
Реактивы |
Объем, мкл |
|
Раствор целевой ДНК (максимальное количество ДНК 200 нг) |
5,00 |
|
Taq-полимераза (5 ед./мкл) |
0,25 |
|
Буфер для ПЦР 10х |
5,00 |
|
Концентрация в реакционной смеси |
|
|
MgCl2 раствор |
5 ммоль/л |
|
Праймер 4 |
600 нмоль/л |
|
Праймер 5 |
300 нмоль/л |
|
dUTP |
400 мкмоль/л |
|
Смесь нуклеотидов dATP, dCTP, dGTP |
200 мкмоль/л каждого |
|
Праймер 6 |
200 нмоль/л |
|
Деионизированная вода |
довести до 25,00 мкл |
• условия амплификации:
|
Стадия |
Программа амплификации |
|
Доамплификационный период |
2 мин/ 50 °C |
|
Денатурация первичная |
10 мин/ 95 °C |
|
Амплификация |
|
|
Денатурация |
15 с/95 °C |
|
Отжиг |
60 с/60 °C измерение |
|
Количество циклов амплификации |
40 |
8.13. Метод количественного определения риса линии LL 62:
• основан на ПЦР в реальном времени с определением гена, кодирующего синтез фосфолипазы Д (PLD), присущей для всех линий риса, и области ДНК, специфичной трансформационному событию LL 62, на границе генома риса и элемента генетической конструкции;
• используются зонды, меченые красителем FAM;
• для построения калибровочной прямой используются стандартные образцы состава генетически модифицированного риса: менее 0,09, 0,45, 0,90, 1,80, 3,60 %;
• праймеры на ген PLD:
1) 5' TGG TGA GCG ТТТ TGC AGT СТ 3',
2) 5' CTG АТС САС TAG CAG GAG GTC С 3',
3) 5' - FAM - TGT TGT GCT GCC AAT GTG GCC TG - TAMRA - 3',
длина ампликона 64 пары нуклеотидов;
• праймеры на целевую последовательность ГМО:
4) 5' AGC TGG CGT AAT AGC GAA GAG G 3',
5) 5' TGC TAA CGG GTG CAT CGT СТА 3',
6) 5' - FAM - CGC АСС GAT TAT ТТА ТАС ТТТ TAG ТСС АСС - TAMRA - 3',
длина ампликона 88 пар нуклеотидов;
• реакционная смесь для проведения ПЦР, количественное определение ДНК риса:
|
Реактивы |
Объем, мкл |
|
Раствор целевой ДНК (максимальное количество ДНК 200 нг) |
5,00 |
|
Taq-полимераза (5 ед./мкл) |
0,25 |
|
Буфер для ПЦР 10х |
5,00 |
|
Концентрация в реакционной смеси |
|
|
MgCl2 раствор |
5 ммоль/л |
|
Праймеры 1, 2 (10 мкМ) |
200 нмоль/л каждого |
|
dUTP |
400 мкмоль/л |
|
Смесь нуклеотидов dATP, dCTP, dGTP |
200 мкмоль/л каждого |
|
Праймер 3 (10 мкМ) |
200 нмоль/л |
|
Деионизированная вода |
довести до 25,00 мкл |
• реакционная смесь для проведения ПЦР, количественное определение рекомбинантной ДНК:
|
Реактивы |
Объем, мкл |
|
Раствор целевой ДНК (максимальное количество ДНК 200 нг) |
5,00 |
|
Taq-полимераза (5 ед./мкл) |
0,25 |
|
Буфер для ПЦР 10х |
5,00 |
|
Концентрация в реакционной смеси |
|
|
MgCl2 раствор |
5 ммоль/л |
|
Праймер 4, 5 (10 мкМ) |
400 нмоль/л |
|
dUTP |
400 мкмоль/л |
|
Смесь нуклеотидов dATP, dCTP, dGTP |
200 мкмоль/л каждого |
|
Праймер 6 (10 мкМ) |
200 нмоль/л |
|
Деионизированная вода |
довести до 25,00 мкл |
|
Стадия |
Программа амплификации |
|
Доамплификационный период |
2 мин/50 °C |
|
Денатурация первичная |
10 мин/95 °C |
|
Амплификация |
|
|
Денатурация |
15 с/95 °C |
|
Отжиг |
60 с/60 °C измерение |
|
Количество циклов амплификации |
45 |
8.14. Метод количественного определения сахарной свеклы линии Н7-1:
• основан на ПЦР в реальном времени с определением гена, кодирующего синтез глютамин синтетазы (GS), присущей для всех линий сахарной свеклы, и области ДНК, специфичной трансформационному событию Н7-1, на границе генома сахарной свеклы и элемента генетической конструкции;
• используются зонды, меченые красителем FAM:
• для построения калибровочной прямой используются стандартные образцы состава генетически модифицированной сахарной свеклы: менее 0,1, 0,5, 0,9, 2,0, 5,0 %;
• праймеры на ген GS:
1) 5' GAC CTC CAT ATT ACT GAA AGG AAG 3',
2) 5' GAG TAA TTG CTC CAT CCT GTT CA 3',
3) 5' - FAM - CTA CGA AGT TTA AAG TAT GTG CCG CTC - TAMRA - 3',
длина ампликона 121 пара нуклеотидов;
• праймеры на целевую последовательность ГМО:
4) 5' TGG GAT CTG GGT GGC ТСТ ААС Т 3',
5) 5' ААТ GCT GCT AAA ТСС TGA G 3',
6) 5' - FAM - AAG GCG GGA ААС GAC ААТ СТ - TAMRA - 3',
• длина ампликона 110 пар нуклеотидов;
• реакционная смесь для проведения ПЦР, количественное определение ДНК сахарной свеклы:
|
Реактивы |
Объем, мкл |
|
Раствор целевой ДНК (максимальное количество ДНК 125 нг) |
5,0000 |
|
Деионизированная вода |
9,2000 |
|
Праймеры 1, 2 (100 мкМ) |
0,0375 каждого |
|
Праймер 3 (100 мкМ) |
0,0250 |
|
dUTP (20 млМ) |
0,5000 |
|
Смесь нуклеотидов dATP, dCTP, dGTP (10 млМ) |
0,5000 каждого |
|
Буфер для ПЦР 10х |
2,5000 |
|
MgCl2 раствор (25 млМ) |
5,0000 |
|
Taq-полимераза (5 ед./мкл) |
0,2000 |
|
Краситель ROX (25 мкМ) |
1,0000 |
|
Итого |
25,0000 |
• реакционная смесь для проведения ПЦР, количественное определение рекомбинантной ДНК:
|
Реактивы |
Объем, мкл |
|
Раствор целевой ДНК (максимальное количество ДНК 125 нг) |
5,0000 |
|
Деионизированная вода |
7,0750 |
|
Праймеры 4, 5 (100 мкМ) |
0,1000 каждого |
|
Праймер 6 (100 мкМ) |
0,0250 |
|
dUTP (20 млМ) |
0,5000 |
|
Смесь нуклеотидов dATP, dCTP, dGTP (10 млМ) |
0,5000 каждого |
|
Буфер для ПЦР 10х |
2,5000 |
|
MgCl2 раствор (25 млМ) |
7,0000 |
|
Taq-полимераза (5 ед./мкл) |
0,2000 |
|
Краситель ROX (25 мкМ) |
1,0000 |
|
Итого: |
25,0000 |
• условия амплификации:
|
Стадия |
Программа амплификации |
|
Денатурация первичная |
10 мин/95 °C |
|
Амплификация |
|
|
Денатурация |
15 с/95 °C |
|
Отжиг |
60 с/60 °C измерение |
|
Количество циклов амплификации |
45 |
9. Методы идентификации и количественного определения ГМО с использованием тест-систем
9.1. Метод количественного определения генно-инженерно-модифицированной сои и кукурузы с использованием наборов «TaqMan GMO Soy Detection Kit» и «TaqMan GMO Maize Detection Kit»:
• наборы реактивов предназначены для количественного определения в пищевых продуктах генно-инженерно-модифицированной кукурузы или сои;
• метод основан на ПЦР в реальном времени;
• амплифицируется участок эндогенной ДНК, характерной для всех линий кукурузы или сои, и участок рекомбинантной ДНК в ходе двух независимых реакций с использованием соответствующих праймеров и зондов, меченых флуоресцентным красителем;
• регистрация флуоресценции красителей осуществляется приборами типа ABI-PRISM 7000, Rotor Gene 3000 и анализируется с использованием программного обеспечения приборов;
• относительное содержание ГМО в пищевом продукте рассчитывается с использованием стандартных образцов состава, путем сравнения результатов измерения флуоресценции красителя FAM, специфичного для ГМО, с результатами измерения флуоресценции красителя VIC, специфичного для всех линий сои или кукурузы;
• выделение ДНК из стандартных образцов состава и из исследуемых образцов осуществляется одновременно одним методом с помощью СТАВ или набора реактивов «ДНК-сорб-С».
9.2. Метод идентификации и количественного определения ГМО с использованием наборов «Ампликвант ГМ соя», «Ампликвант ГМ кукуруза», «АмплиСенс ГМ соя FTR», «АмплиСенс ГМ кукуруза FTR», разработанных ФГУН Центральный НИИ эпидемиологии Роспотребнадзора.
9.2.1. Набор реактивов «Ампликвант ГМ соя»:
• предназначен для количественного определения генно-инженерно-модифицированной сои;
• метод основан на ПЦР в реальном времени;
• амплифицируется участок эндогенной ДНК, характерной для всех линий сои, и участок рекомбинантной ДНК, промотора 35 S из вируса мозаики цветной капусты, в ходе двух независимых реакций с использованием соответствующих праймеров и зондов, меченых флуоресцентным красителем;
• регистрация флуоресценции красителей осуществляется приборами типа ABI-PRISM 7000, Rotor Gene 3000 и анализируется с использованием программного обеспечения приборов;
• относительное содержание ГМО в пищевом продукте рассчитывается с использованием стандартных образцов состава, путем сравнения результатов измерения флуоресценции красителя FAM, специфичного для ГМО, с результатами измерения флуоресценции красителя VIC, специфичного для всех линий сои;
• выделение ДНК из стандартных образцов состава и из исследуемых образцов осуществляется одновременно одним методом с помощью СТАВ или набора реактивов «ДНК-сорб-С».
9.2.2. Набор реактивов «Ампликвант ГМ кукуруза»:
• предназначен для количественного определения генно-инженерно-модифицированной кукурузы;
• метод основан на ПЦР в реальном времени;
• амплифицируется участок эндогенной ДНК, характерной для всех линий кукурузы, и участок рекомбинантной ДНК, промотора 35 S из вируса мозаики цветной капусты, в ходе двух независимых реакций с использованием соответствующих праймеров и зондов, меченых флуоресцентным красителем;
• регистрация флуоресценции красителей осуществляется приборами типа ABI-PRISM 7000, Rotor Gene 3000 и анализируется с использованием программного обеспечения приборов;
• относительное содержание ГМО в пищевом продукте рассчитывается с использованием стандартных образцов состава путем сравнения результатов измерения флуоресценции красителя FAM, специфичного для ГМО, с результатами измерения флуоресценции красителя VIC, специфичного для всех линий кукурузы;
• выделение ДНК из стандартных образцов состава из исследуемых образцов осуществляется одновременно одним методом с помощью СТАВ или набора реактивов «ДНК-сорб-С».
9.2.3. Набор реактивов «АмплиСенс ГМ соя FRT»:
• предназначен для идентификации генно-инженерно-модифицированной сои в пищевых продуктах и растительном сырье методом ПЦР в реальном времени;
• анализ представляет собой проведение трех ПЦР в одной пробирке, для каждой из которых используются специфичные праймеры и меченый флуоресцентными красителями зонд;
• в двух реакциях выявляются последовательности ДНК, специфичные для промотора 35 S из вируса мозаики цветной капусты и терминатора NOS из Agrobactetium tumefaciens, третья предназначена для амплификации эндогенной ДНК, специфичной для всех линий сои;
• выделение ДНК осуществляется с помощью СТАВ или набора реактивов «ДНК-сорб-С».
9.2.4. Набор реактивов «АмплиСенс ГМ кукуруза FRT»:
• предназначен для идентификации генно-инженерно-модифицированной кукурузы в пищевых продуктах и растительном сырье методом ПЦР в реальном времени;
• анализ представляет собой проведение трех ПЦР в одной пробирке, для каждой из которых используются специфичные праймеры и меченый флуоресцентными красителями зонд;
• в двух реакциях выявляются последовательности ДНК, специфичные для промотора 35 S из вируса мозаики цветной капусты и терминатора NOS из Agrobactetium tumefaciens, третья предназначена для амплификации эндогенной ДНК, специфичной для всех линий кукурузы;
• выделение ДНК осуществляется с помощью СТАВ или набора реактивов «ДНК-сорб-С».
9.2.5. Выделение ДНК с использованием набора реактивов «ДНК-сорб-С»:
• буфер для лизирующего реагента и раствор для отмывки 1 прогреть при 64 °C до полного растворения кристаллов;
• в каждую пробирку внести по 400 мкл буфера для лизирующего реагента и по 17 мкл лизирующего реагента, тщательно перемешать;
• инкубировать при 64 °C 1 ч, периодически встряхивая на вортекс;
• центрифугировать 5 мин при 12000 - 14000 об./мин;
• отобрать и перенести надосадочную жидкость в объеме 200 - 350 мкл в чистые пробирки;
• центрифугировать 5 с при 5000 об./мин;
• тщательно ресуспендировать сорбент на вортекс, в каждую пробирку добавить по 25 мкл ресуспендированного сорбента, перемешать на вортекс, оставить в штативе на 10 - 15 мин, перемешивая каждые 2 мин;
• центрифугировать 1 мин при 5000 об./мин, удалить супернатант;
• добавить по 300 мкл раствора для отмывки 1, перемешать на вортекс до полного ресуспендирования сорбента, центрифугировать 1 мин при 5000 об./мин;
• удалить супернатант;
• добавить по 500 мкл раствора для отмывки 2, перемешать на вортекс до полного ресуспендирования сорбента, центрифугировать 1 мин при 10000 - 12000 об./мин, отобрать супернатант;
• повторить процедуру отмывки, отобрать супернатант полностью, поместить пробирки в термостат 64 °С на 5 - 10 мин для подсушивания сорбента, при этом крышки пробирок должны быть открыты;
• добавить по 50 мкл ТЕ-буфера для элюции ДНК, перемешать на вортекс;
• поместить в термостат 64 °C на 5 - 8 мин, периодически встряхивая на вортекс;
• центрифугировать 1 мин при 12000 - 14000 об./мин;
• раствор ДНК хранить в течение 1 недели при температуре от 2 до 8 °C и в течение 1 года - при температуре минус 20 °C.
9.3. Методы количественного определения сои линии 40-3-2, кукурузы линии GA 21, кукурузы линии NK 603, кукурузы линии MON 863, разработанные Центром «Биоинженерия» РАН.
9.3.1. Наборы реактивов для количественного определения сои линии 40-3-2, кукурузы линии GA 21, кукурузы линии NK 603, кукурузы линии MON 863 методом ПЦР в реальном времени:
• в состав каждого набора входят 2 пробирки матричной реакционной смеси, 1 пробирка с термостабильной полимеразой, 8 пробирок со стандартными разведениями рекомбинантной ДНК;
• реакционная смесь на одну пробу содержит 9,25 мкл матричной реакционной смеси, 0,75 мкл термостабильной полимеразы, 32,0 мкл деионизированной воды, конечный объем каждой пробы - 50 мкл;
• реакционную смесь разлить в пробирки по 42 мкл на пробу;
• добавить 8 мкл раствора ДНК в следующем порядке - контроль без ДНК, ДНК 0 %, ГМО 0,5 %, ГМО 100 %, исследуемые образцы;
• центрифугировать;
• условия амплификации: 94 °C - 9 мин - 1 цикл, (94 °C - 30 с) + (62 °C - 30 с) + (72 °C - 1 мин) - 40 циклов;
• наборы реактивов оптимизированы для работы на амплификаторах типа ABI Prism 7000/7700.
9.3.2. Метод выделения ДНК с применением технологии Wizard, Promega:
• навеску исследуемого продукта массой 100 мг поместить в микроцентрифужную пробирку типа Эппендорф вместимостью 1,5 мл;
• добавить 300 мкл - буфера I (50 мМ Трис НСl, pH 8,0; 10 мМ ЭДТА; 50 мкг/мл панкреатической РНКазы свободной от ДНКаз, 3 М гуанидин тиоцианата) при комнатной температуре;
• растереть пробу в пробирке пестиком до гомогенного состояния;
• добавить 400 мкл буфера II (2 % додецилсульфат натрия, 0,2 М NaOH) и перемешать на вортекс;
• инкубировать при 65 °C 30 мин, перемешать на вортекс, охладить до комнатной температуры;
• добавить 400 мкл буфера III (5 M ацетат калия, pH 4,5), перемешать на вортекс 2 мин;
• центрифугировать 10 мин при 13000 об./мин.;
• надосадок отобрать и перенести в чистую пробирку типа Эппендорф вместимостью 1,5 мл, добавить смолу Wizard MaxiPreps из расчета 100 мкл смолы на 200 мкл надосадочной жидкости и перемешать на вортекс;
• при помощи стерильного шприца емкостью 2 мл прокачать смесь через микроцентрифужную колонку;
• стерильным шприцем емкостью 2 мл прокачать через микроцентрифужную колонку 2 мл промывочного буфера (0,2 М NaCl, 20 мМ Трис НСl, pH 8,0, 5 мМ ЭДТА смешать в соотношении 5:7 с 96 %-м этанолом);
• поместить микроколонку в микроцентрифужную пробирку типа Эппендорф вместимостью 1,5 мл;
• центрифугировать 1 мин при 13000 об./мин;
• поместить микроколонку в чистую микроцентрифужную пробирку типа Эппендорф вместимостью 1,5 мл;
• добавить в колонку 100 мкл деионизованной воды, нагретой до 65 °C, центрифугировать 15 с при 13000 об./мин;
• измерить концентрацию раствора ДНК и довести ее до 10 нг/мкл;
• раствор ДНК хранить при минус 20 °C.
9.4. Количественное определение сои линии 40-3-2, кукурузы линий GA 21, MON 810, Т-25, Bt-176, Bt-11 с использованием наборов реагентов GeneScan Analytics GmbH.
9.4.1. Наборы реактивов для определения сои линии 40-3-2, (GMO-Quant Roundup Ready™ Soy), кукурузы линии Bt-176, (GMOQuant Maximizer™ Bt 176 Corn), кукурузы линии Bt-11 (GMOQuant Bt-11 Com), кукурузы линии MON 810 (GMOQuant YieldCard™ MON 810), кукурузы линии Т-25 (GMOQuant LibertyLink™ T25 Corn), кукурузы линии GA 21, (GMOQuant Roundup Ready™ GA 21 Corn):
• используется реакционная смесь, позволяющая амплифицировать участок эндогенной ДНК, характерной для кукурузы или сои, и реакционная смесь, позволяющая амплифицировать участок рекомбинантной ДНК;
• каждая реакционная смесь содержит соответствующие праймеры и зонд, меченый флуоресцентным красителем FAM, специфичный для ГМО и VIC, специфичный для сои или кукурузы;
• интенсивность флуоресценции измеряют с помощью приборов типа ABI-PRISM 7000, iCycler iQ и анализируют с применением программного обеспечения приборов.
9.4.2. Метод выделения ДНК с помощью набора реагентов «GENESpin»:
• набор «GENESpin» предназначен для выделения геномной ДНК из пищевых продуктов;
• исследуемый образец пищевого продукта гомогенизировать, добавить лизирующий буфер, содержащий денатурирующие агенты и детергенты;
• лизат центрифугировать;
• добавить связывающий буфер и этанол для создания оптимальных условий осаждения ДНК на фильтре со специально подобранным силикагелем;
• промыть буфером для удаления потенциальных ингибиторов ДНК-полимеразы;
• ДНК элюировать водой или буфером, хранить при минус 20 °C.
9.5. Методы количественного определения сои линии 40-3-2, кукурузы линии MON 810, разработанные ГУ ВНИИ сельскохозяйственной биотехнологии РАСХН:
9.5.1. Принцип методов:
• для количественного определения ГМО одновременно проводятся две независимые реакции в одной пробирке, одна реакция позволяет обнаруживать ДНК сои или кукурузы, другая - последовательность, специфичную для сои линии 40-3-2 или кукурузы линии MON 810;
• для обнаружения ДНК сои или кукурузы используется зонд, меченый красителем R6G, для обнаружения генетической конструкции - красителем FAM или ROX в зависимости от типа прибора;
• интенсивность флуоресценции измеряют с помощью приборов типа АНК-32, ABI-PRISM 7000, iCycler iQ и анализируют с применением программного обеспечения приборов;
• определение процентного содержания ГМО осуществляется с использованием калибровочных образцов (КО), которые представляют собой смеси ДНК растения дикого типа (0 %) и ДНК ГМО (100 %) в определенном процентном соотношении, разность значений пороговых циклов двух реакций для калибровочных образцов используется для построения калибровочной прямой. С помощью калибровочной прямой рассчитывается процентное содержание ДНК ГМО в анализируемых пробах.
9.5.2. Метод выделения ДНК «Сорб-ГМО»:
• измельченные навески образцов перенести в одноразовые микроцентрифужные пробирки объемом 1,5 или 2,0 мл;
• внести в каждую пробирку по 600 мкл лизирующего буфера и 10 мкл лизирующего реагента, тщательно перемешать, инкубировать 50 - 60 мин при 65 °C, периодически перемешивая на вортекс;
• внести в каждую пробирку по 500 мкл хлороформа, интенсивно перемешать, центрифугировать 10 мин при 12000 - 14000 об./мин;
• верхнюю водную фазу в объеме 300 мкл аккуратно, не захватывая хлороформ и межфазный слой, перенести в пробирку с сорбентом, интенсивно перемешать на вортекс до полного ресуспензирования сорбента, инкубировать при комнатной температуре 10 мин, периодически встряхивая;
• центрифугировать суспензию при 10000 об./мин 1 мин, удалить супернатант;
• добавить к осадку 500 мкл промывочного раствора А, перемешать на вортекс до максимального ресуспензирования сорбента, инкубировать при комнатной температуре 2 - 3 мин, периодически встряхивая;
• центрифугировать при 7000 об./мин 30 с, удалить супернатант;
• добавить к осадку 500 мкл промывочного раствора Б, перемешать на вортекс до максимального ресуспензирования сорбента;
• центрифугировать суспензию при 7000 об./мин 30 с, удалить супернатант;
• добавить к осадку 500 мкл промывочного раствора В, перемешать на вортекс до максимального ресуспензирования сорбента;
• центрифугировать при 7000 об./мин 30 с, удалить супернатант;
• поместить пробирки с открытыми крышками в термостат при температуре 65 °C на 5 мин для испарения жидкости;
• к сухому осадку добавить 100 мкл ТЕ буфера, перемешать на вортекс, инкубировать 10 мин при температуре 65 °C, перемешивая каждые 2 мин;
• центрифугировать при 12000 - 14000 об./мин 2 мин;
• чистую надосадочную жидкость перенести в чистую пробирку объемом 0,5 - 1,5 мл, не захватывая сорбент.
9.5.3. Порядок проведения исследований:
• взять необходимое количество пробирок с реакционной смесью из тест-системы из расчета N + 8, где N - количество анализируемых образцов;
• после размораживания реакционной смеси центрифугировать пробирки 30 - 60 с при более 4000 об./мин;
• внести в пробирки по 2 мкл исследуемых образцов и в последнюю очередь калибровочных образцов сои или кукурузы в двух повторах, перемешать многократным пипетированием, поместить пробирки в амплификатор;
• программа амплификации для сои: 10 мин/95 °C, 20 с/95 °C, 50 с/62 °C съемка 50 циклов, 25 °C - хранение;
• программа амплификации для кукурузы: 10 мин/95 °C, 20 с/95 °C, 50 с/60 °C съемка 50 циклов, 25 °С - хранение.
9.6. Для определения ГМО растительного происхождения допустимо использование тест-систем с техническими характеристиками, аналогичными указанным выше и разрешенными для использования в установленном порядке.
Приложение 1
Пример представления данных электрофореза по результатам идентификации ДНК сои (ген лектин).
Продукт ПЦР - 118 пар нуклеотидов.
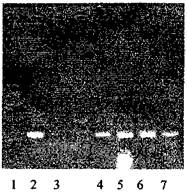
1. Маркер молекулярной массы (100 п.н., Лаборатория Био-Рад).
2. Продукт ПЦР, полученный на препаратах ДНК из семян нетрансгенной сои.
3. Контроль качества реакционной смеси - ПЦР в отсутствие матричной ДНК.
4 - 7. Продукты ПЦР, полученные на препаратах ДНК из продуктов переработки сои.
Приложение 2
Пример представления данных электрофореза по результатам идентификации ДНК кукурузы (ген зеин).
Продукт ПЦР - 329 пар нуклеотидов.

1. Маркер молекулярной массы (100 п.н., Лаборатория Био-Рад).
2 - 5. Продукт ПЦР, полученный на препаратах ДНК из семян нетрансгенной кукурузы.
6. Контроль качества реакционной смеси - ПЦР в отсутствие матричной ДНК.
Приложение 3
Продукт ПЦР - 1149 пар нуклеотидов.
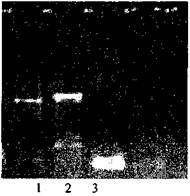
1. Маркер молекулярной массы (100 п.н., Лаборатория Био-Рад).
2. Продукт ПЦР, полученный на препаратах ДНК из клубней нетрансгенного картофеля.
3. Контроль качества реакционной смеси - ПЦР в отсутствие матричной ДНК.
Приложение 4
Продукт ПЦР - 195 пар нуклеотидов.

1 - 3. Продукты ПЦР, полученные на препаратах ДНК из семян сои линии 40-3-2.
4. Продукты ПЦР, полученные на препаратах ДНК из семян нетрансгенной сои.
5. Контроль качества реакционной смеси - ПЦР в отсутствие матричной ДНК.
6. Маркер молекулярной массы (100 п.н., Лаборатория Био-Рад).
Приложение 5
Продукт ПЦР - 180 пар нуклеотидов.

1 - 3. Продукты ПЦР, полученные на препаратах ДНК из семян сои линии 40-3-2.
4. Продукты ПЦР, полученные на препаратах ДНК из семян нетрансгенной сои.
5. Контроль качества реакционной смеси - ПЦР в отсутствие матричной ДНК.
6. Маркер молекулярной массы (100 п.н., Лаборатория Био-Рад).
Приложение 6
Продукт ПЦР - 173 пары нуклеотидов.

1. Контроль качества реакционной смеси - ПЦР в отсутствие матричной ДНК.
2. Маркер молекулярной массы (100 п.н., Лаборатория Био-Рад).
3. Продукт ПЦР, полученный на препаратах ДНК из зерна кукурузы линии MON 863.
Приложение 7
Продукт ПЦР - 169 пар нуклеотидов.
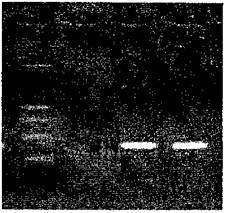
1. Маркер молекулярной массы (100 п.н., Лаборатория Био-Рад).
2. Продукты ПЦР, полученные на препаратах ДНК из семян нетрансгенной сои.
3 - 4. Продукты ПЦР, полученные на препаратах ДНК из семян сои линии 40-3-2.
Приложение 8
Продукт ПЦР - 185 пар нуклеотидов.

1. Маркер молекулярной массы (100 п.н., Лаборатория Био-Рад).
2. Продукт ПЦР, полученный на препаратах ДНК из семян нетрансгенной сои.
3 - 6. Продукты ПЦР, полученные на препаратах ДНК из семян сои линии А 2704-12.
Приложение 9
Продукт ПЦР - 150 пар нуклеотидов.

1. Продукт ПЦР, полученный на препаратах ДНК из семян сои линии А5547-127,
2. Продукт ПЦР, полученный на препаратах ДНК из семян нетрансгенной сои.
3. Маркер молекулярной массы (100 п.н., Лаборатория Био-Рад).
Приложение 10
Продукт ПЦР - 189 пар нуклеотидов.

1. Маркер молекулярной массы (100 п.н., лаборатория Био-Рад).
2. Продукт ПЦР, полученный на препаратах ДНК из зерна кукурузы линии Bt-176.
3. Продукт ПЦР, полученный на препаратах ДНК из зерна нетрансгенной кукурузы.
Приложение 11
Продукт ПЦР - 149 пар нуклеотидов.
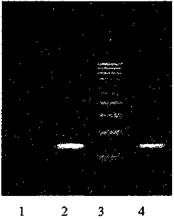
1. Продукт ПЦР, полученный на препаратах ДНК из зерна нетрансгенной кукурузы.
2. Продукт ПЦР, полученный на препаратах ДНК из зерна кукурузы линии MON 810.
3. Маркер молекулярной массы (100 п.н., лаборатория Био-Рад).
4. Продукт ПЦР, полученный на препаратах ДНК из зерна кукурузы линии MON 810.
Приложение 12
Продукт ПЦР - 84 пары нуклеотидов.

1. Продукт ПЦР, полученный на препаратах ДНК из зерна кукурузы линии MON 863.
2. Продукт ПЦР, полученный на препаратах ДНК из зерна нетрансгенной кукурузы.
3. Маркер молекулярной массы (100 п.н., лаборатория Био-Рад).
Приложение 13
Продукт ПЦР - 108 пар нуклеотидов.

1. Продукт ПЦР, полученный на препаратах ДНК из зерна кукурузы линии NK 603.
2. Продукт ПЦР, полученный на препаратах ДНК из зерна нетрансгенной кукурузы.
3. Маркер молекулярной массы (100 п.н., лаборатория Био-Рад).
Приложение 14
Продукт ПЦР - 110 пар нуклеотидов.

1. Продукт ПЦР, полученный на препаратах ДНК из зерна нетрансгенной кукурузы.
2. Маркер молекулярной массы (100 п.н., лаборатория Био-Рад).
3. Продукт ПЦР, полученный на препаратах ДНК из зерна кукурузы линии Bt 11.
Приложение 15
Продукт ПЦР - 149 пар нуклеотидов.

1. Продукт ПЦР, полученный на препаратах ДНК из зерна кукурузы линии Т 25.
2. Продукт ПЦР, полученный на препаратах ДНК из зерна нетрансгенной кукурузы.
3. Маркер молекулярной массы (100 п.н., лаборатория Био-Рад).
Приложение 16
Продукт ПЦР - 270 пар нуклеотидов.

1. Продукт ПЦР, полученный на препаратах ДНК из зерна нетрансгенной кукурузы.
2. Маркер молекулярной массы (100 п.н., лаборатория Био-Рад).
3. Продукт ПЦР, полученный на препаратах ДНК из зерна кукурузы линии GА 21.
Приложение 17
Продукт ПЦР - 894 пары нуклеотидов.

1. Продукт ПЦР, полученный на препаратах ДНК из зерна нетрансгенной кукурузы.
2. Маркер молекулярной массы (100 п.н., лаборатория Био-Рад).
3. Продукт ПЦР, полученный на препаратах ДНК из зерна кукурузы линии MIR 604.
4. Продукт ПЦР, полученный на препаратах ДНК из зерна нетрансгенной кукурузы.
Приложение 18
Продукт ПЦР - 94 пары нуклеотидов.

1. Продукт ПНР, полученный на препаратах ДНК из зерна нетрансгенной кукурузы.
2. Продукт ПЦР, полученный на препаратах ДНК из зерна кукурузы линии MON 88017.
3. Маркер молекулярной массы (100 п.н., лаборатория Био-Рад).
Приложение 19
Продукт ПЦР - 110 пар нуклеотидов.
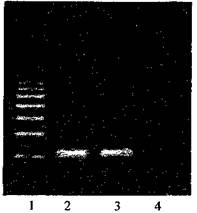
1. Маркер молекулярной массы (100 п.н., лаборатория Био-Рад).
2 - 3. Продукты ПЦР, полученные на препаратах ДНК из корнеплодов сахарной свеклы линии Н7-1.
4. Продукт ПЦР, полученный на препаратах ДНК из корнеплодов нетрансгенной сахарной свеклы.
Приложение 20
Продукт ПЦР - 88 пар нуклеотидов.

1. Продукт ПЦР, полученный на препаратах ДНК из семян риса линии LL 62.
2. Продукт ПЦР, полученный на препаратах ДНК из семян нетрансгенного риса.
3. Маркер молекулярной массы (100 п.н., лаборатория Био-Рад).
Приложение 21
(обязательное)
Продукт ПЦР - 102 пары нуклеотидов.

1. Продукт ПЦР, полученный на препаратах ДНК из клубней картофеля сорта Рассет Бурбанк Ньюлив.
2. Продукт ПЦР, полученный на препаратах ДНК из клубней картофеля сорта Супериор Ньюлив.
3. Продукт ПЦР, полученный на препаратах ДНК из клубней картофеля сорта Елизавета 2904/kgs.
4. Продукт ПЦР, полученный на препаратах ДНК из клубней картофеля сорта Луговской 1210 amk.
5. Продукт ПЦР, полученный на препаратах ДНК из клубней нетрансгенного картофеля.
6. Маркер молекулярной массы (100 п.н., лаборатория Био-Рад).
Приложение
22
(обязательное)
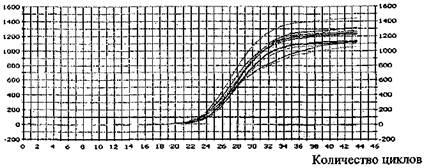
Зависимость величины сигнала флуоресценции (Rn) от количества циклов ПЦР для гена лектина.
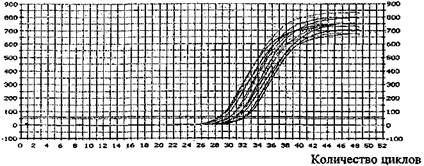
Зависимость величины сигнала флуоресценции (Rn) от количества циклов ПЦР для рекомбинантной ДНК.
Расчет количества рекомбинантной ДНК
По кривой амплификации определяется пороговый цикл для каждой ПЦР (Ct). Рассчитывается разность между Ct, специфичным для 35 S промотора, и Ct, специфичным для гена лектина. Относительное количество рекомбинантной ДНК в пробе определяется по формуле:
w = 2-(DCt sam - DCt ref). · c ref, где
DCt sam - разность между значениями Ct для 35 S промотора и гена лектина в исследуемом образце;
DCt ref - разность между значениями Ct для 35 S промотора и гена лектина в стандартном образце;
c ref - концентрация стандартного образца.
Приложение 23
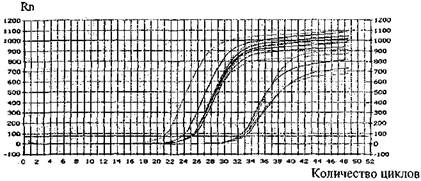
Зависимость величины сигнала флуоресценции (Rn) or количества циклов ПЦР для гена зеина.
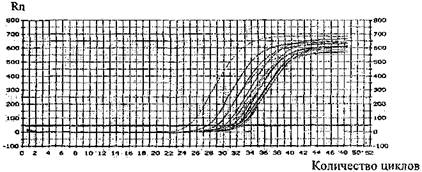
Зависимость величины сигнала флуоресценции (Rn) от количества циклов ПЦР для рекомбинантной ДНК.
Расчет количества рекомбинантной ДНК.
По кривой амплификации определяется пороговый цикл для каждой ПЦР (Ct). Рассчитывается разность между Ct, специфичным для 35 S промотора, и Ct, специфичным для гена зеина. Относительное количество рекомбинантной ДНК в пробе определяется по формуле:
w = 2-(DCt sam - DCt ref). · c ref, где
DCt sam - разность между значениями Ct для 35 S промотора и гена лектина в исследуемом образце;
DCt ref - разность между значениями Ct для 35 S промотора и гена лектина в стандартном образце;
с ref - концентрация стандартного образца.