 | Информационная система |  |
Федеральная служба по надзору в сфере защиты прав
потребителей
и благополучия человека
4.1. МЕТОДЫ КОНТРОЛЯ. ХИМИЧЕСКИЕ ФАКТОРЫ
Определение остаточных
количеств химических веществ
в объектах окружающей среды, атмосферном
воздухе, воздухе рабочей зоны
и сельскохозяйственной продукции
Сборник
методических указаний
МУК
4.1.1960, 4.1.1961, 4.1.1963
- 4.1.1980-05
1. Разработаны Московской сельскохозяйственной академией им. К.А. Тимирязева, Учебно-научным консультационным центром «Токсикология пестицидов и агрохимикатов» (Калинин В.А., Калинина Т.С., Рыбакова О.И., Калинин А.В.).
2. Рекомендованы к утверждению Комиссией по санитарно-гигиеническому нормированию Минздрава России (протокол № 1 от 31 марта 2005 г.).
3. Утверждены Главным государственным санитарным врачом Российской Федерации, руководителем Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека Главным государственным санитарным врачом Российской Федерации Г.Г. Онищенко 21 апреля 2005 г.
4. Введены в действие с 1 июля 2005 г.
5. Введены впервые.
СОДЕРЖАНИЕ
|
УТВЕРЖДАЮ Руководитель
Федеральной службы ______________________ Г.Г. Онищенко 21 апреля 2005 г. Дата введения: 1 июля 2005 г. |
4.1. МЕТОДЫ КОНТРОЛЯ. ХИМИЧЕСКИЕ ФАКТОРЫ
Определение остаточных
количеств эпоксиконазола
в ботве и корнеплодах сахарной свеклы методом
газожидкостной хроматографии
Методические указания
МУК 4.1.1973-05
1. Вводная часть
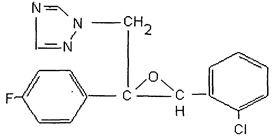
Действующее вещество: эпоксиконазол.
(2RS,3SR)-1-[3-(2-хлорфенил)-2,3-эпокси-2-(4-фторфенил)пропил]-1Н-1,2,4-триазол (ИЮПАК).
цис-1-[[3-(2-хлорфенил)-2-(4-фторфенил)оксиранил] метил]-1Н-1,2,4-триазол (С.А.).
Эмпирическая формула: C17H13ClFN3O.
Молекулярная масса: 329,8.
Бесцветное кристаллическое вещество без запаха.
Температура плавления: 136,2 °С.
Давление паров при 20 °С: менее 0,01 мПа.
Коэффициент распределения н-октанол/вода: KowlogP = 3,44 (рН 7).
Растворимость (г/л) при 20 °С: ацетон - 144, дихлорметан - 291, н-гептан - 0,4; вода - 6,6 мг/л.
Вещество стабильно при нормальных условиях хранения, не гидролизуется в водном растворе при различных значениях температуры и рН.
Краткая токсикологическая характеристика
Острая пероральная токсичность (LD50) для крыс - более 5000 мг/кг; острая дермальная токсичность (LD50) для крыс - более 2000 мг/кг, острая ингаляционная токсичность (LC50) для крыс - более 5,3 мг/л воздуха. Эпоксиконазол не оказывает раздражающего действия на кожу и слизистую оболочку глаз кролика. LC50 для рыб - 2,2 - 6,8 мг/кг (96 ч).
Эпоксиконазол нетоксичен для пчел, дождевых червей, птиц, дафний и водорослей.
Гигиенические нормативы
МДУ в сахарной свекле 0,1 мг/кг.
Область применения препарата
Эпоксиконазол - системный фунгицид широкого спектра действия из класса триазолов. Высокоэффективен против возбудителей ржавчины, мучнистой росы, пятнистостей листьев и колоса зерновых культур.
2. Методика определения остаточных
количеств эпоксиконазола в ботве и корнеплодах
сахарной свеклы методом газожидкостной хроматографии
2.1. Основные положения
2.1.1. Принцип метода
Методика основана на газохроматографическом определении эпоксиконазола на неподвижной фазе SE-30 с использованием электронозахватного детектора (ЭЗД) после экстракции его из растительного материала водным ацетоном, очистки экстракта перераспределением в системе несмешивающихся растворителей и на колонке с силикагелем.
Количественное определение проводится методом абсолютной калибровки.
2.1.2. Избирательность метода
В предлагаемых условиях метод специфичен в присутствии пестицидов, применяемых в интенсивной технологии выращивания сахарной свеклы.
2.1.3. Метрологическая характеристика метода
Таблица
Метрологическая характеристика метода
|
Анализируемый объект |
Метрологические параметры, Р = 0,95, n = 20 |
|||||
|
предел обнаружения, мг/кг |
диапазон определяемых концентраций, мг/кг |
среднее значение определения, % |
стандартное отклонение S, % |
относительное отклонение DS, % |
доверительный интервал среднего, % |
|
|
Ботва |
0,05 |
0,05 - 0,5 |
83,5 |
3,9 |
1,7 |
±3,7 |
|
Корнеплоды |
0,05 |
0,05 - 0,5 |
83,1 |
2,9 |
1,3 |
±2,7 |
2.2. Реактивы, растворы и материалы
|
Эпоксиконазол с содержанием д.в. 99,8 % (БАСФ, Германия) |
|
|
Ацетон |
|
|
Вода дистиллированная или деионизованная |
ГОСТ 7602-72 |
|
н-Гексан, ч |
ТУ 6-09-3375-78 |
|
Калия перманганат |
|
|
Кальция хлорид, хч |
ГОСТ 4161-77 |
|
Калий углекислый, хч |
|
|
Кислота серная, хч |
|
|
Натрий двууглекислый |
|
|
Натрия гидроксид, хч |
|
|
Натрия сульфат безводный, хч |
|
|
Натрия хлорид, хч |
|
|
Этилацетат |
|
|
Элюент № 1 для колоночной хроматографии: смесь гексан-ацетон (8:2, по объему) |
|
|
Элюент № 2 для колоночной хроматографии: смесь гексан-ацетон (6:4, по объему) |
|
|
Азот газообразный, осч |
|
|
Силикагель (0,063 - 0,2 мм) для адсорбционной хроматографии (Мерк, Германия) I степени активности |
|
|
Стекловата |
|
|
Целит 535 (2 - 15 мкм)/Серва, Германия/ |
|
|
Фильтры бумажные, синяя лента |
ТУ 6-09-1678 |
2.3. Приборы, аппаратура, посуда
|
Хроматограф газовый «Кристалл 2000М» с ЭЗД с пределом детектирования по линдану не выше 8,2×10-15 г/см3 или аналогичный |
|
|
Колонка хроматографическая 1500×3 мм, неподвижная фаза 3 % ОV-17 на Хромосорбе W/HP (0,12 - 0,15 мм) |
|
|
Колонка хроматографическая 1500×3 мм, неподвижная фаза 3 % SE-30 на Хромосорбе W/HP (0,12 - 0,15 мм) |
|
|
Колонка капиллярная для ГЖХ ZB-1, длина 30 м, внутренний диаметр 0,32 мм, толщина пленки 0,5 мкм, неподвижная фаза SE-30, фирма Phenomenex, США или аналогичная |
|
|
Микрошприц емкостью 10 мкл МШ-10Ф |
ТУ 64-1-2850 |
|
Весы аналитические типа ВЛР-200 |
|
|
Гомогенизатор или аналогичный |
МРТУ 42-1505-63 |
|
Ротационный испаритель, тип ИР-1М |
ТУ 25-11-917-76 |
|
Прибор для перегонки при атмосферном давлении |
|
|
Вакуумный водоструйный насос |
ГОСТ 10696-75 |
|
Воронка Бюхнера |
ГОСТ 0147-73 |
|
Колба Бунзена |
ГОСТ 5614-75 |
|
Воронки делительные вместимостью 100 и 500 мл |
|
|
Колбы конические с притертыми пробками, вместимостью 250 мл |
|
|
Колбы мерные, вместимостью 50 и 100 мл |
|
|
Колбы грушевидные, вместимостью 50, 100, 250 мл |
|
|
Цилиндры мерные, вместимостью 50, 100 и 250 мл |
|
|
Пробирки градуированные с притертыми пробками, вместимостью 5 и 10 мл |
ГОСТ 10515-75 |
|
Пипетки мерные, вместимостью 1, 2 и 5 мл |
ГОСТ 20292-74Е |
|
Воронки стеклянные |
ГОСТ 9737-70 |
2.4. Отбор проб
Отбор образцов проводится в соответствии с «Унифицированными правилами отбора проб сельскохозяйственной продукции, продуктов питания и объектов окружающей среды для определения микроколичеств пестицидов» (№ 2051-79 от 21.08.79).
Отобранные пробы ботвы и корнеплодов хранят в стеклянной или полиэтиленовой таре в холодильнике не более двух дней; при длительном хранении (не более трех месяцев) пробы замораживают и хранят в морозильной камере при температуре -18 °С. Перед анализом ботву и корнеплоды измельчают и отбирают усредненную пробу.
2.5. Подготовка к определению
2.5.1. Подготовка и очистка реактивов и растворителей
Органические растворители перед началом работы очищают, сушат и перегоняют в соответствии с типовыми методиками. Гексан встряхивают с небольшими порциями концентрированной серной кислоты до тех пор, пока свежая порция кислоты не перестанет окрашиваться. Затем растворитель последовательно промывают водой, 2,5 %-м раствором гидроксида натрия и снова водой, после чего сушат над гидроксидом натрия и перегоняют.
Ацетон перегоняют над перманганатом калия и поташом (на 1 л ацетона 10 г KMnO4 и 2 г K2CO3).
Этилацетат промывают равным объемом 5 %-го раствора двууглекислого натрия, сушат над хлористым кальцием и перегоняют.
Силикагель I степени активности встряхивают с двойным объемом очищенного ацетона и затем фильтруют на воронке Бюхнера через бумажный фильтр. Силикагель на фильтре промывают 1,5 объемом ацетона и затем высушивают при температуре 150 °С в течение 3 ч.
2.5.2. Подготовка и кондиционирование колонки
Готовую насадку (3 % SE-30 на Хромосорбе W/HP) засыпают в стеклянную колонку, уплотняют под вакуумом, колонку устанавливают в термостат хроматографа, не подсоединяя к детектору, и стабилизируют в токе азота при температуре 270 °С в течение 8 - 10 ч.
2.5.3. Приготовление стандартных растворов
Основной стандартный раствор эпоксиконазола с содержанием 100 мкг/мл готовят растворением 0,010 г препарата, содержащего 99,8 % д.в., в ацетоне в мерной колбе емкостью 100 мл. Раствор хранят в холодильнике не более месяца.
Рабочие растворы с концентрациями 0,05; 0,1; 0,25 и 0,5 мкг/мл готовят из основного стандартного раствора эпоксиконазола соответствующим последовательным разведением ацетоном. Рабочие растворы хранят в холодильнике не более недели.
2.5.4. Построение калибровочного графика
Для построения калибровочного графика в инжектор хроматографа вводят по 2 мкл рабочего стандартного раствора эпоксиконазола с концентрацией 0,05; 0,1; 0,25 и 0,5 мкг/мл. Осуществляют не менее 5 параллельных измерений и находят среднее значение площади хроматографического пика для каждой концентрации. Строят калибровочный график зависимости площади хроматографического пика в мВ × с от концентрации эпоксиконазола в растворе в мкг/мл.
2.5.5. Подготовка колонки с силикагелем для очистки экстракта
В нижнюю часть стеклянной колонки длиной 25 см и внутренним диаметром 0,8 см вставляют тампон из стекловаты, закрывают кран и вносят суспензию 5 г силикагеля в 10 мл гексана. Дают растворителю стечь до верхнего края сорбента и помещают на него слой безводного сульфата натрия высотой 1 см. Колонку последовательно промывают 20 мл смеси гексан-ацетон (8:2, по объему) и 20 мл гексана со скоростью 1 - 2 капли в с, после чего она готова к работе.
2.5.6. Проверка
хроматографического поведения
эпоксиконазола на колонке с силикагелем
В круглодонную колбу емкостью 10 мл отбирают 1 мл стандартного раствора эпоксиконазола с концентрацией 1 мкг/мл. Отдувают растворитель током теплого воздуха, остаток растворяют в 3 мл смеси гексан-ацетон (8:2, по объему) и наносят на колонку. Промывают колонку 50 мл смеси гексан-ацетон (8:2) и затем 40 мл смеси гексан-ацетон (6:4) со скоростью 1 - 2 капли в с. Отбирают фракции по 10 мл каждая, упаривают досуха, остаток растворяют в 2 мл этилацетата и анализируют на содержание эпоксиконазола по п. 2.7.1.
Фракции, содержащие эпоксиконазол, объединяют, упаривают досуха, остаток растворяют в 4 мл этилацетата и вновь анализируют по п. 2.7.1. Рассчитывают содержание эпоксиконазола в элюате, определяют полноту вымывания вещества из колонки и необходимый для очистки экстракта объем элюента.
Примечание. Профиль вымывания эпоксиконазола может меняться при использовании новой партии сорбента и растворителей.
2.6. Описание определения
2.6.1. Экстракция эпоксиконазола и очистка экстракта
К навеске (25 г) измельченной ботвы или корнеплодов добавляют 100 мл смеси ацетон-вода (80:20, по объему), гомогенизируют 3 мин при 10000 об/мин. Добавляют 2 г целита и фильтруют под вакуумом на воронке Бюхнера через бумажный фильтр в колбу емкостью 250 мл. Осадок на фильтре промывают 50 мл смеси ацетон-вода (80:20). Из объединенного экстракта отбирают аликвоту раствора (около 32 мл), эквивалентную 5 г растительного материала, и упаривают ее до водной фазы на роторном вакуумном испарителе при температуре 40 °С. Водный остаток переносят в делительную воронку емкостью 100 мл, приливают 15 мл насыщенного раствора хлорида натрия и 30 мл гексана и содержимое встряхивают в течение 1 мин. После разделения слоев отделяют гексановую фазу и собирают ее в колбу емкостью 100 мл. Оставшуюся водную фазу обрабатывают гексаном еще два раза (по 30 мл). Объединенный гексановый экстракт фильтруют через слой безводного сульфата натрия в грушевидную колбу емкостью 200 мл и затем упаривают досуха на роторном испарителе при температуре 30 °С. Дальнейшую очистку экстракта проводят по п. 2.6.2.
2.6.2. Очистка на колонке с силикагелем
Остаток в колбе, полученный при упаривании экстракта растительного материала из п. 2.6.1, количественно переносят тремя 1-мл порциями смеси гексан-ацетон (8:2) в подготовленную хроматографическую колонку (п. 2.5.5). Промывают колонку 40 мл элюента № 1, элюат отбрасывают. Эпоксиконазол элюируют 30 мл элюента № 2, собирая элюат в грушевидную колбу емкостью 100 мл. Полученный раствор упаривают досуха на роторном испарителе при температуре 30 °С. Сухой остаток растворяют в 5 мл этилацетата и анализируют на содержание эпоксиконазола по п. 2.7.1.
2.7. Условия хроматографирования
2.7.1. Метод ГЖХ с насадочными колонками
Газовый хроматограф «Кристалл 2000М» с электронозахватным детектором (Ni63) с пределом детектирования по линдану не выше 8,2×10-15 г/см3.
Колонка хроматографическая, стеклянная, 1500×3 мм; неподвижная фаза - 3 % SE-30 на Хромосорбе W/HP (0,12 - 0,15 мм).
Температура детектора 320 °С, испарителя 270 °С, термостата колонки 230 °С.
Скорость потока газа-носителя (азота) - 40 мл/мин.
Объем вводимой пробы - 2 мкл.
Время удерживания эпоксиконазола - 2 мин 10 с.
Предел детектирования - 0,1 нг.
Линейный диапазон детектирования - 0,1 - 1,0 нг.
Альтернативная фаза: 3 % OV-17 на Хромосорбе W/HP (0,12 - 0,15 мм), хроматографическая колонка 1500×3 мм; температура детектора 320 °С, инжектора 270 °С, термостата колонки 255 °С.
Время удерживания эпоксиконазола - 3 мин 25 с.
Каждую анализируемую пробу вводят три раза и вычисляют среднюю площадь пика.
Образцы, дающие пики большие, чем стандартный раствор с концентрацией 0,5 мкг/мл, разбавляют этилацетатом.
2.7.2. Метод ГЖХ с капиллярными колонками
Газовый хроматограф «Кристалл 2000М» с электронозахватным детектором Ni63 с пределом детектирования по линдану не выше 8,2×10-15 г/см3.
Колонка капиллярная кварцевая ZB-1, 30 м×0,32 мм×0,5 мкм (SE-30).
Температура термостата испарителя - 270 °С, детектора - 320 °С, термостата колонки по следующей программе: 170 °С - 2 мин; 25 °С/мин до 250 °С; выдержка - 10 мин.
Газовый режим: газ-носитель - азот, общий расход - 22,5 мл/мин; газ для поддува в детектор - азот, расход - 19,3 мл/мин.
Деление потока: 1:6.
Абсолютное время удерживания эпоксиконазола: 9 мин 10 с.
Объем вводимой пробы - 1 мкл.
Линейный диапазон детектирования: 0,025 - 0,5 нг.
Каждую анализируемую пробу вводят в хроматограф 3 раза и вычисляют среднюю площадь пика.
Образцы, дающие пики большие, чем стандартный раствор с концентрацией 0,2 мкг/мл, разбавляют этилацетатом.
2.8. Обработка результатов анализа
Содержание эпоксиконазола рассчитывают методом абсолютной калибровки по формуле:
|
|
Х - содержание эпоксиконазола в пробе, мг/кг;
Н1 - площадь пика анализируемой пробы, мВ х с;
H0 - площадь пика стандартного раствора, мВ х с;
А - концентрация стандартного раствора эпоксиконазола, мкг/мл;
V - объем экстракта, подготовленного для хроматографирования, мл;
m - масса анализируемой части образца, г (для ботвы и корнеплодов - 5 г).
3. Требования техники безопасности
Соблюдать общепринятые правила безопасности при работе с легко воспламеняющимися жидкостями, токсичными веществами, электронагревательными приборами, сосудами, работающими под вакуумом.
4. Контроль погрешности измерений
Оперативный контроль погрешности и воспроизводимости измерений осуществляется в соответствии с рекомендациями МИ 2335-95. ГСИ. Внутренний контроль качества результатов количественного химического анализа.
5. Разработчики
Назарова Т.А., Микитюк О.Д., Л.В. Дубовая, А.М. Макеев, ВНИИ фитопатологии, 143050 Московская обл., п/о Большие Вяземы, тел. 592-92-20.