 | Информационная система |  |
Федеральная
служба по надзору в сфере защиты прав потребителей
и благополучия человека
4.2. МЕТОДЫ КОНТРОЛЯ. БИОЛОГИЧЕСКИЕ И
МИКРОБИОЛОГИЧЕСКИЕ ФАКТОРЫ
Методы контроля бактериологических питательных сред
Методические указания
МУК 4.2.2316-08
Москва 2008
1. Разработаны: Федеральным государственным учреждением науки «Государственный научно-исследовательский институт стандартизации и контроля медицинских биологических препаратов имени Л.А. Тарасевича» Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека (С.М. Суханова, Н.Е. Захарова, Э.И. Конду, И.А. Голубенко).
2. Рекомендованы к утверждению Комиссией по государственному санитарно-эпидемиологическому нормированию при Федеральной службе по надзору в сфере защиты прав потребителей и благополучия человека (протокол от 6 декабря 2007 г. № 3).
3. Утверждены и введены в действие Руководителем Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека, Главным государственным санитарным врачом Российской Федерации Г.Г. Онищенко 18 января 2008 г.
4. Введены впервые взамен документов - «Методические указания по применению физико-химических методов контроля питательных сред», (Москва, 1977) и «Методические рекомендации к контролю питательных сред по биологическим показателям» (Москва, 1980).
СОДЕРЖАНИЕ
|
УТВЕРЖДАЮ Руководитель
Федеральной службы ____________________ Г.Г. Онищенко 18 января 2008 г. Дата введения: с момента утверждения |
4.2.
МЕТОДЫ КОНТРОЛЯ. БИОЛОГИЧЕСКИЕ И
МИКРОБИОЛОГИЧЕСКИЕ ФАКТОРЫ
Методы контроля бактериологических питательных сред
Методические указания
МУК 4.2.2316-08
1. Область применения
1.1. Настоящие методические указания предназначены для работников организаций, осуществляющих:
- изготовление и контроль качества бактериологических питательных сред (диагностических, для культивирования, транспортных и др.) и (или) их основ при серийном промышленном выпуске;
- конструирование новых питательных сред;
- изготовление сред из отдельных компонентов по прописям, а также могут быть использованы:
- при экспертизе НД и
- при проведении внутрилабораторного контроля качества коммерческих питательных сред.
1.2. Настоящие методические указания распространяются на исследования бактериологических питательных сред отечественного и зарубежного производства.
2. Нормативные и методические ссылки
2.1. Государственная Фармакопея СССР XI издания. Вып. 1, 2.
2.2. Методические указания по методам контроля МУК 4.1/4.2.588-96 «Методы контроля медицинских иммунобиологических препаратов, вводимых людям» /Минздрав России. М., 1998.
2.3. Санитарные правила СП 3.3.2.561-96 «Государственные испытания и регистрация новых медицинских иммунобиологических препаратов» /Минздрав России. М., 1998.
2.4. Санитарные правила СП 1.2.036-95 «Порядок учета, хранения, передачи и транспортирования микроорганизмов I - IV групп патогенности» /Госкомсанэпиднадзор России. М., 1996.
2.5. Микробиология. Продукты пищевые. Общие правила микробиологических исследований: ГОСТ Р 51446-99 (ISO 7218-96).
2.6. Агар микробиологический: ГОСТ 17206-96.
2.7. Методические рекомендации «Определение сроков годности сухих микробиологических сред и питательных основ методом «Ускоренного старения» при повышенной температуре». Махачкала, 1987.
2.8. Водоросли морские, травы морские и продукты их переработки: ГОСТ 26185-84.
2.9. Методические рекомендации к контролю питательных сред по биологическим показателям. М., 1980.
2.10. Методические указания по применению физико-химических методов контроля питательных сред. М., 1977.
2.11. Методические указания «Определение чувствительности микроорганизмов к антибактериальным препаратам»: МУК 4.2.1890-04.
3. Общие положения
3.1. Целью введения настоящих методических указаний является регламентация стандартных методов контроля бактериологических питательных сред.
3.2. Методические указания содержат описание общих методов контроля бактериологических питательных сред. Особенности контроля качества сред, не охватываемые настоящим документом, должны быть описаны в нормативной документации на эти препараты.
4. Термины и определения
4.1. Бактериологические питательные среды (БПС) - препараты, предназначенные для выявления, накопления, культивирования, дифференциальной диагностики, транспортирования и хранения микроорганизмов.
4.2. МИБП (медицинские иммунобиологические препараты) - лекарственные средства, предназначенные для иммунопрофилактики, диагностики и иммунотерапии заболеваний.
4.3. Качество бактериологических питательных сред (основ, добавок) - совокупность свойств продукции, обусловливающих ее способность удовлетворять определенным требованиям в соответствии с назначением.
4.4. Серия препарата - количество препарата, полученного в результате смешивания сухих компонентов питательной среды в мельнице-смесителе или сушки жидкого полуфабриката (для сухих питательных сред) при одноразовой закладке. Для жидких или агаризованных питательных сред, готовых к применению, под серией препарата подразумевают совокупность емкостей, полученных из полуфабриката одной емкости.
4.5. Оценка результатов. Определение положительного или отрицательного результата.
4.6. Разведение культуры. Величина, указывающая во сколько раз была разведена суспензия культуры (например, 10-6, 10-7 и т.д.) в отношении исходной, соответствующей 10 ед. по стандартному образцу мутности ФГУН ГИСК им. Л.А. Тарасевича (ОСО-42-28-85 П).
5. Общие указания при оценке качества питательных сред
I. Оценка качества питательных сред и их компонентов проводится с помощью совокупности показателей, выбираемых для контроля среды в соответствии с ее назначением и включает:*
________
*Используемые в лабораториях коммерческие питательные среды контролируются на предприятиях-изготовителях, поэтому внутрилабораторный контроль их качества проводят только в случаях:
- указания на необходимость проведения контроля в приказах Минздрава РФ, инструкции по применению или других документах;
- несоответствия клинического диагноза результатам микробиологического исследования в лаборатории;
- неудовлетворительного выполнения внешней оценки качества микробиологических исследований;
- неудовлетворительного качества среды при использовании в практической работе;
- несоответствия величины колоний искомого микроорганизма данному виду бактерий при росте в данной среде;
- позднего появления роста культуры в среде, не соответствующего срокам для данного микроорганизма;
- отсутствия подавления роста сопутствующей микрофлоры на среде с заявленными ингибирующими свойствами.
Для внутрилабораторного контроля качества коммерческих питательных сред, контроль которых не предусмотрен действующими нормативными документами, необходимо проводить визуальную оценку качества, определять значение pH готовой среды, стерильность каждой приготовленной серии (см. р. 7.1.1 «Контроль чистоты розлива»), а также оценивать качество среды с помощью контрольных штаммов.
1. Контроль качества препарата по физико-химическим показателям.
2. Контроль специфической активности препарата по биологическим показателям.
Перечень показателей, необходимых для контроля основных групп питательных сред, приведен в прилож. 1.
Готовую среду засевают культурой (тест-штаммом) того (целевого) микроорганизма, для которого приготовлена среда, и гетерологичных штаммов и визуально (или под малым увеличением микроскопа) изучают характер его роста. Рост микроорганизмов оценивают с помощью количественных (для плотных сред), полуколичественных или качественных методов*.
________
*Возможно использование среды сравнения - среды ранее отконтролированной и удовлетворяющей требованиям качества.
Для оценки результатов качественным методом определяют наличие и характер роста каждого из тест-штаммов. Рост целевых тест-штаммов должен быть типичным по цвету, размеру и морфологии колоний; рост нецелевых должен частично или полностью подавляться.
Для оценки результатов количественным методом при интерпретации ингибирующих, накопительных или задерживающих рост свойств среды, подсчитывают количество выросших колоний на тестируемой и контрольной (среде выращивания) средах.
Требования к специфической активности зарегистрированных в РФ бактериологических питательных сред и добавок перечислены в прилож. 2.
II. Количество образцов одной серии среды для контроля - не менее трех.
III. Серия среды признается годной только после проведения всех видов контроля.
6. Определение физико-химических показателей
6.1. Общие указания для приготовления реактивов
Концентрация. При указании концентрации растворов в процентах, следует подразумевать весобъемные проценты. Например, для приготовления 10 %-го раствора следует брать 10 г вещества на 100 мл готового раствора.
Точная навеска. Взвешивание на аналитических весах с точностью до 0,0002 г. Если не указано «точная навеска», то навеску берут с точностью до 0,01 г.
Постоянная масса - разница в массе между последовательными взвешиваниями, не превышающая 0,0005 г.
Оценка результатов. Результаты рассчитывают на основании не менее двух параллельных определений. За окончательный результат анализа принимают среднее арифметическое значений результатов двух параллельных измерений. Допустимое отклонение от средней величины не должно превышать 10%.
Реактивы и титрованные растворы. Реактивы и титрованные растворы, приведенные в настоящих МУК, описаны в соответствующих разделах Государственной Фармакопеи СССР XI издания, вып. 2, если нет других указаний.
Квалификация реактивов. Для анализа необходимо использовать реактивы квалификации хч и чда.
Растворитель - вода очищенная (ФС 42-2619-97), если нет других указаний.
Хранение реактивов. Растворы реактивов хранят при температуре 18 - 20 °С в течение 6 мес., если нет изменений их физических свойств или нет других указаний.
Контрольный опыт (контроль на реактивы). Под контрольным опытом подразумевают определение, проводимое с тем же количеством реактивов и в тех же условиях, но без испытуемого препарата, вместо которого используют растворитель.
6.2. Описание препарата
Внешний вид препарата определяют визуально, указывая:
- физическое состояние (жидкость, мелкодисперсный порошок, гель);
- цветность*;
- прозрачность (для препаратов готовых к применению). Препарат может быть либо прозрачным, либо с незначительной опалесценцией, либо мутный);
- гигроскопичность (для сухих препаратов);
- светочувствительность (при наличии в составе компонентов, разрушающихся на свету.
________
*При описании цвета оттенок указывают перед основным цветом (например, «желтовато-коричневый»).
6.3. Определение растворимости
Количество препарата (г), необходимое для приготовления конкретной серии питательной среды, должно растворяться при перемешивании и, если необходимо, при кипячении в течение 2 - 3 мин.
Препарат считают растворившимся, если в растворе при визуальном наблюдении в проходящем свете не обнаруживаются частицы вещества.
Для препаратов, образующих при растворении мутные растворы, соответствующее указание должно быть приведено в нормативной документации и инструкции по применению.
6.4. Определение прозрачности и цветности
Прозрачность и цветность сухих препаратов определяется визуально в проходящем свете в растворе после фильтрации его через ватно-марлевый фильтр (агаровые среды) и бумажный фильтр (жидкости) (подготовку образца см. раздел 6.3 «Определение растворимости») (см. примечание раздела «Описание препарата»).
Прозрачность и цветность готовых сред, разлитых во флаконы определяют визуально в проходящем свете. Агары предварительно расплавляют в кипящей водяной бане и разливают в чашки Петри слоем 4 - 5 мм.
Раствор препарата, а также готовая среда могут быть либо прозрачными, либо с незначительной опалесценцией, либо непрозрачными.
После приготовления среды из сухого препарата (стерилизации, розлива в чашки Петри, пробирки и подсушивания) показатель прозрачности и цветности указывается также и для готовой среды.
6.5. Определение pH
Определение pH питательных сред проводят потенциометрическим методом с применением стеклянного электрода.
Калибровка и проверка pH-метра (потенциометра). Подготовка pH-метра и электродной системы производится согласно инструкциям, прилагаемым к прибору. Перед работой на потенциометре необходимо, пользуясь стандартными буферными растворами со значениями pH 4,01; 6,86; 9,18 при 25 °С, провести калибровку прибора*. Для приготовления таких растворов могут быть использованы фиксаналы (ГОСТ 8-135- 74). Различие между показанием прибора и номинальным значением pH буферного раствора не должно превышать 0,04 единицы pH.
________
Если pH контролируемого раствора отличается менее чем на единицу от pH стандартного буферного раствора, то достаточна проверка прибора по одному буферному раствору, величина pH которого лежит в том же диапазоне измерения, что и значения pH контролируемого раствора. Если pH контролируемых растворов находятся в широких пределах, то проверку pH-метра следует производить по двум (трем) стандартным буферным растворам в соответствии с инструкцией.
При измерении pH контролируемых растворов отсчет величины pH по шкале прибора производят после того, как показания прибора примут установившееся значение. Время установления показаний определяется буферными свойствами и температурой раствора (обычно время установления показаний не превышает 2 мин). Определение pH проводят при (25 ± 2) °С, в противном случае необходимо сделать соответствующие поправки (подвести ручку термокомпенсатора либо использовать коэффициент пересчета). При измерении pH агаровых сред следует иметь ввиду, что полученные значения pH являются условными.
Оценку значения pH питательных сред необходимо проводить с учетом последующей стерилизации.
Примечание: автоклавирование, как правило, приводит к снижению pH, поэтому перед стерилизацией pH среды повышают на 0,2 единицы от требуемой величины, а после автоклавирования реакцию среды проверяют повторно.
Метод измерения pH
Подготовка проб:
- в готовых жидких средах и гидролизатах определение pH проводят непосредственно в растворе;
- для готовых плотных агаровых сред определение pH проводят в расплавленном и охлажденном до 45 - 50 °С препарате (необходимо особо тщательно отмывать электрод после измерения pH в агаризованных средах теплой (50 - 60 °С) дистиллированной водой; предпочтительно для этих сред пользоваться специально выделенным рН-метром). Возможно также определение pH в экстракте, приготовленном добавлением к 2,00 г измельченного студня 100 мл дистиллированной воды (pH 7,0 - 7,2), настаивания в течение 1 ч при температуре 18 - 25 °С с периодическим перемешиванием стеклянной палочкой и последующим фильтрованием через бумажный фильтр;
- для сухих препаратов, не содержащих агар, определение pH проводят в 2 %-м растворе, приготовленном добавлением к 2,00 г сухого препарата 100 мл дистиллированной воды, перемешиванием и последующим фильтрованием через бумажный фильтр;
- для сухих препаратов, содержащих агар, определение pH проводят в экстракте, приготовленном добавлением к 2,00 г сухого препарата 100 мл дистиллированной воды, настаиванием с периодическим перемешиванием в течение 1 ч при температуре 18 - 25 °С и последующим фильтрованием через бумажный фильтр.
6.6. Определение белка
Качественное определение отсутствия следов белка в пептонах - компонентах питательных сред - проводят визуально с использованием трихлоруксусной кислоты (ССl3СООН) для их осаждения.
Реактивы: 20 %-я трихлоруксусная кислота.
Ход определения
К 5 мл 5 %-го раствора анализируемого препарата добавляют равный объем 20 %-й ССl3СООН, тщательно перемешивают.
Помутнение раствора через 5 мин свидетельствует о присутствии в препарате следов белка.
6.7. Определение содержания пептидов по биуретовой реакции
Метод основан на способности пептидов давать цветную реакцию с биуретовым реактивом. Концентрацию пептидов («пептонов») определяют путем сравнения интенсивности окраски испытуемого и стандартного растворов.
Реактивы: 1) 2 %-й раствор меди сульфата в 9 %-м растворе натрия-калия тартрата - реактив А;
Приготовление реактива А. Растворяют 1 г меди сульфата (CuSO4⋅5Н2O) в нескольких миллилитрах воды. В этот раствор прибавляют 4,5 г натрия-калия тартрата, предварительно растворенного в 40 мл воды. Объем раствора доводят водой до 50 мл. Раствор годен к употреблению в течение дня.
2) 10 %-й раствор натрия едкого;
3) 0,9 %-й раствор натрия хлорида;
4) 1 %-й стандартный раствор пептона (ГОСТ 13805-76).
Приготовление 1 %-го стандартного раствора пептона. Стандартный раствор 1 %-го пептона готовят с учетом влажности при растворении навески в 0,9 %-м растворе натрия хлорида. Реактив хранят в холодильнике. В качестве консерванта используют мертиолят (1:10 000).
Приготовление контрольного раствора. К 5 мл 0,9 %-го раствора натрия хлорида добавляют 0,5 мл 10 %-го раствора натрия едкого и 0,5 мл реактива А.
Построение калибровочной кривой. Из стандартного раствора готовят ряд разведений с содержанием пептона от 0,1 до 0,5 % на 0,9 %-м растворе натрия хлорида с интервалом 0,1%. К 5 мл каждого разведения прибавляют 0,5 мл 10 %-го раствора натрия едкого и 0,5 мл реактива А.
Пробы колориметрируют сразу после внесения реактивов на фотоэлектроколориметре (ФЭК) при длине волны 540 нм в кюветах с толщиной слоя 5 мм против контрольного раствора. По показаниям прибора строят кривую зависимости оптической плотности от концентрации пептона. Калибровочную кривую проверяют перед каждым определением.
Подготовка проб. Для анализа используют гидролизаты и питательные среды, разведенные в 10 раз 0,9 %-м раствором натрия хлорида.
Ход определения
К 5 мл испытуемого раствора добавляют 0,5 мл 10 %-го раствора едкого натрия и 0,5 мл реактива А.
Одновременно готовят контрольную пробу и проводят определение, как описано при построении калибровочной кривой. Концентрацию пептона в испытуемом растворе в процентах вычисляют по калибровочной кривой и производят перерасчет с учетом разведения.*
________
*Методика может быть рекомендована для гидролизатов и питательных сред с определенной цветностью. Показатель оптической плотности среды не должен превышать 0,2 при определении на фотоэлектроколориметре при длине волны 540 нм в кюветах с толщиной слоя 5 мм против воды.
6.8. Определение общего азота с реактивом Несслера
Принцип метода основан на свойстве реактива Несслера давать цветную реакцию с ионами аммония (NH4)+, образующимися после минерализации азотсодержащих органических веществ.
Реактивы: 1) серная кислота концентрированная;
2) водорода перекись. Пергидроль (29 - 35 %) (ГОСТ 10929-76);
3) реактив Несслера (готовый);
4) раствор аммония серно-кислого, содержащий 0,05 мг/мл азота.
Приготовление стандартного раствора серно-кислого аммония (0,1 мг/мл азота). Из образца аммония сульфата, предварительно доведенного до постоянной массы (в эксикаторе над безводным кальция хлоридом), берут его точную навеску - 0,2357 г и растворяют в мерной колбе (v = 500 мл) в дистиллированной воде, доводя объем раствора до метки. Стандартный раствор хранят в течение 1 года при температуре 4 - 8 °С в колбе с притертой пробкой. Перед определением стандартный раствор разводят водой в 2 раза.
Построение калибровочной кривой. В пробирки вносят по 0,1 - 0,2 - 0,3 - 0,4 - 0,5 мл раствора аммония серно-кислого (содержание азота от 5 до 25 мкг с интервалом 5 мкг). Объем каждой пробы доводят водой до 9,5 мл, перемешивают, затем прибавляют по 0,5 мл реактива Несслера. Пробы вновь перемешивают, а затем колориметрируют на фотоэлектроколориметре с синим светофильтром (λ ~ 400 нм) в кюветах с толщиной слоя 10 мм.
Раствором сравнения служит контрольная проба, содержащая 0,5 мл реактива Несслера в 9,5 мл воды. По показаниям прибора строят кривую зависимости оптической плотности от концентрации азота. Калибровочный график воспроизводят при каждом определении.
Ход определения
Подготовка проб. Для анализа в пробирку пипеткой вносят 1 мл раствора образца, с содержанием общего азота 100 - 200 мкг*.
________
*При анализе сухой питательной среды, содержащей 5 - 10 % общего азота, готовят 0,2 %-й раствор на дистиллированной воде (анализируемая навеска образца С - 2 мг).
При анализе сухого гидролизата, содержащего 12 - 17 % общего азота, готовят 0,1 %-й раствор (анализируемая навеска образца С - 1 мг).
Жидкий гидролизат следует развести в 100 раз.
На песчаной бане минерализуют 1 мл исследуемого образца (2 параллельные пробы) с 0,1 мл концентрированной серной кислоты в пробирках со стеклянными колпачками. Параллельно минерализуют контрольную пробу, содержащую 0,1 мл концентрированной серной кислоты. Для ускорения минерализации в охлажденные испытуемые и контрольные пробы периодически добавляют по 1 - 2 капли пергидроля. Сжигание продолжают до обесцвечивания содержимого пробирок (не менее 10 ч).
К полученным минерализатам добавляют по 8,9 мл дистиллированной воды, предварительно обмыв колпачок, тщательно перемешивают растворы. На колориметрирование отбирают по 1 мл раствора минерализата (10 - 20 мкг азота), добавляют 8,5 мл дистиллированной воды, перемешивают, а затем - по 0,5 мл реактива Несслера. Пробы перемешивают и колориметрируют на фотоэлектроколориметре с синим светофильтром ((λ ~ 400 нм) в кюветах с толщиной слоя 10 мм. Раствором сравнения служит раствор, приготовленный аналогично образцу.
Содержание общего азота в препарате в процентах (X) вычисляют по формуле:
Для сухого образца (сухой гидролизат, сухая питательная среда)
|
|
А - количество азота (мкг), рассчитанное по калибровочному графику;
10 - разведение минерализата;
100 - коэффициент пересчета в проценты;
1,0 - количество анализируемого препарата (мл);
С - анализируемая навеска образца (мг), содержащаяся в 1 мл раствора образца;
1000 - коэффициент пересчета микрограммов в миллиграммы.
Для жидкого образца (жидкий гидролизат):
|
|
В - количество азота (мкг), найденное по калибровочному графику;
10 - разведение минерализата;
100 - степень разведения жидкого гидролизата;
100 - коэффициент пересчета (%);
1,0 - количество препарата (мл), взятое для колориметрирования;
1,0 - количество исследуемого образца (мл), взятое д ля минерализации;
1000000 - коэффициент пересчета (г),
6.9. Определение содержания аминного азота
формольным титрованием
Определение содержания аминного азота в питательных средах проводят методом формольного титрования. Принцип метода основан на блокировании формальдегидом при pH 7,0 свободных аминогрупп и титровании щелочью эквивалентного количества карбоксильных групп. Начало и конец титрования определяют потенциометрически.
Реактивы: 1) натрия гидроксид (0,1 моль/л) или раствор соляной кислоты (0,1 моль/л);
2) натрия гидроксид 10 %-й раствор;
3) раствор формалина (40 %-й раствор формальдегида)* (ГОСТ 1625-75).
Ход определения
В стакан вместимостью 50 мл наливают необходимый объем (А) (подготовка проб см. примечания 1 и 2) анализируемого раствора препарата, содержащего 1,5 - 5,0 мг аминного азота, и доводят общий объем дистиллированной водой до 20 мл. Электроды потенциометра (см. определение pH) погружают в исследуемый раствор, pH которого доводят до значения 7,0 с помощью раствора натрия гидроксида (0,1 моль/л) или раствора соляной кислоты (0,1 моль/л)**.
К нейтрализованному раствору добавляют 2 мл нейтрального формалина, перемешивают и, не вынимая электроды, титруют содержимое раствором натрия гидроксида (0,1 моль/л) до pH 9,1***. Проводят два параллельных измерения.
________
*Перед каждым определением pH формалина доводят до pH 7,0 10 %-м раствором натрия гидроксида.
**В ходе определения электроды должны все время оставаться погруженными в раствор.
***При титровании следует использовать бюретку, вместимостью 5 мл.
Содержание аминного азота в исследуемом препарате в процентах (X) вычисляют по следующим формулам.
Для сухого образца:
|
|
V - количество раствора натрия гидроксида (0,1 моль/л) в миллилитрах, пошедшее на титрование испытуемой пробы от pH 7,0 до 9,1;
K - поправка к титру раствора натрия гидроксида (0,1 моль/л);
1,4 - количество аминного азота в миллиграммах, эквивалентное
1,0 мл р-ра натрия гидроксида (0,1 моль/л);
С - анализируемая навеска сухого препарата в миллиграммах, содержащаяся в титруемом объеме «А»;
100 - коэффициент пересчета миллиграммов в проценты.
Для сухих образцов (гидролизаты, экстракты, среды (1,5 - 4,0 % аминного азота) - «А» = 10 мл 1 %-го р-ра (анализируемая навеска образца «С» составляет соответственно 100 мг).
Для жидкого образца:
|
|
А - количество жидкого образца (мл), взятого на анализ;
100 - коэффициент пересчета миллиграммов в проценты;
1000 - коэффициент пересчета миллиграммов в граммы.
- для жидких гидролизатов низкой степени расщепления (0,1 - 0,2 % аминного азота) «А» = 3 мл;
- для жидких гидролизатов средней степени расщепления (0,3 - 0,6 % аминного азота) «А» = 1 мл;
- для жидких гидролизатов высокой степени расщепления (0,7 - 1,3 % аминного азота) «А» = 0,5 мл;
- для жидких питательных сред (0,08 - 0,14 % аминного азота) «А» = 10 мл;
- для готовых плотных агаровых сред «А» = 3 мл препарата, расплавленного в кипящей водяной бане.
6.10. Определение содержания хлоридов
аргентометрическим
методом (в пересчете на натрия хлорид)
Метод основан на определении ионов хлора после окисления белков перманганатом калия в кислой среде в присутствии нитрата серебра, избыток которого оттитровывают раствором роданида аммония.
Реактивы: 1) серебро азотно-кислое - 0,01 н раствор (готовят, используя стандарт-титр (фиксанал)*;
2) кислота азотная концентрированная;
3) аммония роданид - 0,1 моль/л раствор (готовят, используя стандарт-титр фиксанал)*;
________
*Ex tempore готовят 0,01 моль/л раствор разведением 0,1 моль/л раствора (1:10).
4) калий марганцово-кислый - насыщенный раствор;
5) глюкоза безводная, не содержащая Сl-;
6) железоаммиачные квасцы, насыщенный раствор (к 40 %-му р-ру на холоде прибавляют по каплям концентрированную азотную кислоту до перехода коричневой окраски в желтовато-зеленую. Хранить в защищенном от света месте.
Ход определения
Для анализа используют объем «В, мл» жидкого образца.
Подготовка проб.
- Жидкие питательные среды, содержащие 0,5 - 0,9 % NaCl, «В» = 0,2 мл.
- Для жидких гидролизатов (1 - 10 % NaCl), пробу развести в 10 раз дистиллированной водой:
- при содержании NaCl 1 - 5 % - «В» = 0,5 мл;
- при содержании NaCl 6 - 10 % - «В» = 0,2 мл.
- Для сухих гидролизатов (1 - 10 % NaCl), готовят 10 %-й раствор на дистиллированной воде:
- при содержании NaCl в образце 1 - 5 % (анализируемая навеска образца С = 50 мг) «В» = 0,5 мл;
- при содержании NaCl в образце 6 - 10% (анализируемая навеска образца С = 20 мг) В = 0,2 мл.
- Для сухих питательных сред, содержащих 10 - 30 % NaCl, готовят 1,0 %-й раствор на дистиллированной воде и берут на анализ объем «В» = 0,5 мл (анализируемая навеска образца С = 5 мг).
В коническую колбу вместимостью 50 мл вносят 10 мл дистиллированной воды, а затем 0,2 мл препарата, содержащего 0,5 - 1,0 мг/мл (оптимальные значения содержания в питательных средах) натрия хлорида, прибавляют 5 мл р-ра азотно-кислого серебра (0,01 моль/л) и 1 мл концентрированной азотной кислоты. Смесь осторожно нагревают на асбестовой сетке до кипения. К испытуемому раствору прибавляют по каплям насыщенный раствор калия марганцово-кислого до бледно-розового окрашивания, не исчезающего в течение 5 мин. Затем прибавляют на кончике скальпеля сухую глюкозу (около 10 мг) до исчезновения окраски. После охлаждения раствора избыток ионов серебра титруют раствором аммония роданида (0,01 моль/л) до образования розового окрашивания (индикатор - железо-аммонийные квасцы - насыщенный ~40 % р-р), определяя объем, пошедший на титрование.
Параллельно проводят контрольный опыт - в качестве образца берут 0,2 мл дистиллированной воды.
Содержание натрия хлорида в жидких препаратах в процентах (X) вычисляют по формуле:
|
|
А - количество раствора аммония роданида (0,01 моль/л), пошедшего на титрование в контрольном опыте, мл;
Д - количество раствора аммония роданида (0,01 моль/л), пошедшего на титрование испытуемого раствора, мл;
K - поправка к титру раствора аммония роданида;
В - количество испытуемого раствора, мл;
Р - степень разведения жидкого образца (для питательных сред Р = 1, для гидролизатов Р = 10);
0,000585 - количество натрия хлорида, соответствующее 1 мл раствора роданида аммония (0,01 моль/л), г;
100 - коэффициент пересчета в проценты.
Содержание натрия хлорида в сухих препаратах в процентах (X) вычисляют по формуле:
|
|
С - навеска образца, мг.
Остальные обозначения см. выше.
6.11. Определение потери в массе при высушивании
Стеклянные бюксы высотой 45 мм и диаметром 28 мм доводят до постоянной массы при температуре 100 - 105 °С.
Около 0,15 - 0,20 г (точная навеска) препарата помещают в бюксы и сушат в сушильном шкафу при температуре (100 - 105) °С в течение 2 ч. После чего бюксы с закрытыми крышками выдерживают в эксикаторе в присутствии кальция хлорида безводного в течение 30 - 40 мин до полного охлаждения и взвешивают*.
________
*Анализ проводят при температуре (20 ± 5) °С и относительной влажности воздуха 40 - 80 %.
Расчет массовой доли влаги в процентах проводят по разности масс до и после высушивания.
6.12. Определение сухого остатка
Принцип метода основан на удалении влаги путем выпаривания исследуемого раствора и последующем высушивании остатка до постоянного веса.
Подготовка проб. Для анализа отбирается 1 мл исследуемого образца.
Ход определения
Анализ проводят во взвешенной и доведенной до постоянной массы фарфоровой чашке (d = 7 см), куда наливают 1 мл исследуемого образца и выпаривают его на кипящей водяной бане (при постоянном помешивании препаратов, содержащих агар). После испарения жидкости чашку ставят в сушильный шкаф (100 ± 5) °С на 2 ч, охлаждают в эксикаторе и взвешивают на аналитических весах.
Содержание сухого остатка (%) рассчитывают по формуле:
|
|
А - вес чашки (г) с исследуемым образцом после высушивания;
Д - вес чашки;
100 - коэффициент пересчета в проценты;
В - объем анализируемого образца (мл).
6.13. Определение стерильности готовых к применению сред
Определение стерильности готовой питательной среды проводят визуально путем просмотра 3 - 5 % каждой партии после инкубации в термостате при температуре 37 °С в течение 2 - 14 сут. в зависимости от типа среды.
Обнаружение после инкубации помутнения жидкой (полужидкой) среды или появление на чашках (пробирках) более 2 - 4 колоний свидетельствует о нестерильности среды, и вся исследуемая среда подлежит повторному контролю на удвоенном количестве образцов. При повторном подтверждении результата среда подлежит уничтожению.
Определение стерильности добавок питательных сред (кровь, сыворотка крови) проводят методом прямого посева.
Пробу препарата объемом 1 мл высевают в 2 пробирки, содержащие по 20,0 мл тиогликолевой среды, одну из которых инкубируют при 30 - 35 °С для выявления аэробных и анаэробных микроорганизмов, а другую при 20 - 25 °С для выявления грибов и бактерий с оптимумом роста в данном температурном режиме. Продолжительность инкубации посевов 14 сут. В течение всего срока проводится их периодический просмотр.
В случае помутнения питательной среды после внесения в нее испытуемого препарата следует в интервале от 3 до 7 сут. после посева сделать пересев приблизительно по 0,5 мл на две пробирки, содержащие
10,0 мл тиогликолевой среды. Все пробирки выдерживают после пересева при соответствующих температурах до окончания инкубации (14 сут.) со дня первичного посева.
Среды, приготавливаемые из сухих препаратов и (или) разливаемые в лаборатории в чашки (пробирки), контролируют на чистоту розлива (см. «Подготовка образцов питательных сред для контроля. Контроль чистоты розлива»),
6.14. Определение прочности студня агаровых сред по Валенту
Прочность студня среды. Сущность метода заключается в определении массы нагрузки, необходимой для разрушения структуры образца. Определение проводят с помощью прибора Валента (рис. 1).
Примечание.
Подготовка оборудования:
- сборные цилиндры (стаканчики) свинчиваются так, чтобы центральная выпуклость диска - отметка - была обращена кверху;
- в приборе Валента проверяются: линии отвеса и устойчивость прибора на всех регулировочных ножках. В сборник при помощи воронки насыпается песок, на шпильку нажимного штока надевается приёмник песка.
Время от времени проверяется скорость истечения песка за 1 с. Для этого на шпильку давящего штока надевается большой приемник (вес известен) и песок из сборника выпускается ровно 30 с. Шнур надо держать туго натянутым. Скорость истечения песка в приборе Валента подгоняется с помощью винта к 10,4 - 10,8 г/с, после чего винт закрепляется контргайкой. Песок из сборника выпускается ровно 30 с. Приемник с песком взвешивается. Масса песка (без приемника, деленная на 30, дает скорость истечения песка в 1 с. Определение проводят не менее 3 раз и рассчитывают средний показатель;
- песок, применяемый в приборе, приготавливается из кварцевого путем промывки его разбавленной соляной кислотой (12 ч), водой, высушивания и отсева на почвенных ситах. Для работы используется фракция с диаметром частиц более 0,5 мм.
Подготовка проб.
Для готовых препаратов. Готовую агаровую среду выдерживают в кипящей водяной бане до полного расплавления студня осторожно помешивая круговыми движениями, и немедленно разливают в 3 сборных цилиндра по 30 мл.
Для сухих препаратов. Для приготовления образца студня к навеске агаровой среды по прописи* (с точностью до 0,01 г) в сухой конической или плоскодонной колбе порциями при энергичном взбалтывании прибавляют 100 мл дистиллированной воды, смывая частицы препарата со стенок колбы. Колбу закрывают ватной пробкой и при осторожном нагревании жидкость доводят до кипения. Операцию повторяют 3 раза (до 3-кратного вспенивания). Признаком растворения будет появление крупно-пузырчатой пены; 100 мл полученного горячего раствора агаровой среды (не ниже 80 °С) немедленно разливают в 3 сборные цилиндра по 30 мл.
________
*Для сред с низкой прочностью (100 - 250 г) берут 2 - 3-кратную навеску.
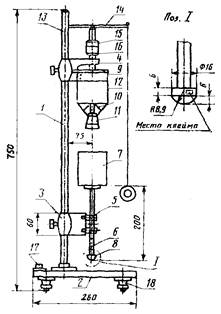
1 - штатив; 2 - основание; 3 - подвижный
кронштейн; 4 - неподвижный кронштейн;
5 - ролики; 6 - шток с площадкой; 7 - стакан для приемки
груза;
8 - грибовидная насадка; 9 - направляющая; 10 - запорный
шток; 11 - пробка;
12 - грузовой стакан с отверстием в коническом дне; 13 - ось; 14
- рычаг;
15 - колпачок; 16 - гайка; 17 - уровень; 18 -
регулировочные ножки.
Ход определения
Цилиндрики с горячей средой ставят в горизонтально установленный сосуд с плоским дном, наполненный водой, уровень которой немного ниже уровня раствора в цилиндриках, и выдерживают 20 мин при 20 °С, поддерживая температуру добавлением в сосуд при перемешивании холодной или теплой воды. Через 20 мин цилиндрики с образовавшимся студнем вынимают и, держа их наклонно (верхним краем к листу бумаги), отвинчивают дно. Нажимом вбок сдвигают вкладной диск и, увеличивая величину наклона, дают столбику студня выскользнуть на фильтровальную бумагу*. После чего его переносят на основание прибора Валента, установленного с помощью уровня.
________
*Поверхность столбика студня оберегать от повреждения!
Левой рукой поднимают нажимной шток прибора с насадкой над серединой столбика студня, который, в свою очередь, подводят правой рукой. Затем одновременно, осторожно опуская левой рукой шток на столбик студня, правой натягивают до отказа кольцо шнура перекрывающего механизма и насыпают песок в приемник до тех пор, пока насадка не начнет разрушать столбик студня.
Как только насадка прорвет пленку столбика студня, немедленно отпускают кольцо шнура. Снимают приёмник песка и взвешивают его с точностью до 1,0 г. Полученная сумма масс песка с приемником и штока с насадкой и будет выражать прочность исследуемого препарата по Валенту в граммах.
За окончательный результат анализа принимают среднее арифметическое значений результатов трех параллельных измерений. Допустимое отклонение измерений от средней величины не должно превышать 10 %.
6.15. Определение температуры застудневания
Метод основан на визуальном определении момента застудневания раствора агара.
Подготовка проб. Навеска препарата из расчета приготовления 150 мл среды растворяется при кипячении.
Ход определения
Во флакон со 150 мл раствора питательной среды (приготовленной в концентрации, указанной на этикетке флакона с сухой средой), погружают термометр, по которому фиксируют температуру перехода содержимого флакона в студень.
Температура застудневания для плотной агаризованной среды должна быть не ниже 30 и не выше 37 °С.
6.16. Определение температуры плавления студня среды
Метод основан на визуальном определении точки плавления агарового студня.
Подготовка проб. Для определения температуры плавления плотных питательных сред используют раствор среды, приготовленный для определения температуры застудневания.
Ход определения
Две пробирки (ГОСТ 25336-82Е) объёмом 20 мл заполняют приблизительно до половины их высоты раствором среды и закрывают заранее подобранными резиновыми пробками. Для застудневания раствора пробирки оставляют при температуре около 20 °С не менее, чем на 3 ч, после чего пробирки со студнем помещают в стакан с водой, имеющей температуру 60 °С, заменяя пробки на ватно-марлевые. Стакан с пробирками и термометром, опущенным в пробирку с водой, помещают в баню (60 °С), которую нагревают таким образом, чтобы скорость повышения температуры воды в стакане не превышала 0,5 °С в минуту.
Через каждый градус повышения температуры одну из пробирок вынимают из стакана и, наклонив ее, наблюдают, не расплавился ли студень. Температуру, при которой содержимое пробирки полностью перейдет в жидкое состояние, отмечают как температуру плавления среды. За окончательный результат анализа принимают среднее арифметическое значение результатов двух параллельных определений, допустимые расхождения между которыми не должны превышать 1 °С.
Температура плавления плотной агаризованной среды не должна быть ниже 80 °С.
6.17. Определение продолжительности плавления студня среды
Полное расплавление студня учитывают визуально.
Две бутылки с готовым препаратом выдерживают в кипящей водяной бане, периодически осторожно перемешивая содержимое. Показатель определяют от момента закипания воды до полного расплавления агара. Среда во флаконах (бутылках) должна выглядеть однородной, жидкой, без сгустков агара.
Продолжительность плавления студня среды должна быть не более 1 ч.
6.18. Определение срока годности
Для определения сроков годности питательных сред можно использовать метод выемок проб, а для сухих питательных сред также метод «ускоренного старения».
Метод выемок проб основан на изучении стабильности показателей качества препарата при хранении его в течение определенного срока* при определенной температуре. С этой целью на хранение при соответствующей температуре (18 - 25 °С или 2 - 8 °С) закладываются образцы препарата.
________
*Проводится не менее 5 измерений («выемок») по всем показателям качества.
Срок годности среды вычисляется как время хранения препарата, при котором все показатели его качества не изменяются или находятся в пределах допустимых значений, минус 3 месяца.
Сроки годности для большинства сухих питательных сред от 2 до 5 лет, готовых - 1 год.
Для сокращения времени изучения стабильности свойств сухих питательных сред может быть использован метод «ускоренного старения».
Метод «ускоренного старения» используют для определения сроков годности сухих микробиологических сред и питательных основ, в составе которых могут быть как синтетические ингредиенты, так и компоненты, получаемые из природного сырья (белковые основы, витамины, аминокислоты, агары и т.д.).
Данный метод заключается в выдерживании испытуемой среды (питательной основы) при температурах, превышающих среднюю температуру хранения, для ускорения протекающих в них физико-химических процессов. По результатам, полученным методом «ускоренного старения», можно установить температуру хранения, обеспечивающую заданный срок годности. Пересчет срока экспериментального хранения (годности) на срок хранения (годности) при стандартных условиях (давление 101,325 кПа, температура 20 °С, относительная влажность воздуха 60 %) проводят по следующему уравнению:
|
|
K - коэффициент соответствия срока экспериментального хранения при повышенной температуре сроку хранения при стандартной температуре, равной 20 °С**;
________
**Значения коэффициентов соответствия K для различных температур экспериментального хранения t, при температурном коэффициенте скорости химической реакции, равном 2 (табл.).
Таблица
|
tэ, °С |
25 |
30 |
35 |
40 |
45 |
50 |
|
K |
1,4 |
2,0 |
2,8 |
4,0 |
5,7 |
8,0 |
2 - принятое значение температурного коэффициента скорости химических реакций;
tэ - температура экспериментального хранения;
Сэ - срок экспериментального хранения;
С - срок хранения (годности) при стандартных условиях.
7. Оценка специфической активности питательных сред
по биологическим показателям
Набор показателей, необходимых для определения специфической активности каждой среды, определяется ее назначением (см. прилож. 1).
7.1 Подготовка образцов питательных сред для контроля
Готовые к применению среды. Работа должна быть проведена с соблюдением правил асептики. Перед использованием снять алюминиевый колпачок с бутылки, заменить резиновую пробку на стерильную ватно-марлевую.
- Жидкую среду разлить в стерильные пробирки*.
- Бутылку с агаром выдержать в кипящей водяной бане до полного расплавления студня, охладить до 45 - 50 °С (для уменьшения количество конденсата, образующегося при застывании агара) и разлить в стерильные пробирки или чашки Петри.
Сухие среды. Готовят в соответствии с инструкцией по применению среды. При необходимости стерилизуют автоклавированием**.
________
*Объем среды, разливаемой в пробирки, указывается в инструкции по применению обычно составляет:
- для бульонов - 5 мл, 10 мл (реже 4 мл, 9 мл) (в зависимости от объёма вносимого инокулята);
- для агаров - 5 мл (объем агаров, разливаемый в чашки Петри зависит от размера чашки (d = 90 или 100 мм) и должен соответствовать толщине агарового слоя - 3 - 4 мм (реже 5 - 6 мм), согласно инструкции по применению).
**Некоторые селективные бульоны (среды Кода, Лейфсона, SDS-бульон) не стерилизуют, а лишь доводят до кипения.
Бульоны фильтруют через бумажный фильтр и разливают в стерильные пробирки.
Агаровые среды фильтруют через ватно-марлевый фильтр, разливают в стерильные пробирки, флаконы и другие емкости.
Режимы стерилизации сред
|
Режим стерилизации |
Среды |
|
121 °С в течение 15 мин |
Тиогликолевая среда, МПА, МПБ, бульон Хоттингера, агар Хотгингера, СПА, СПБ |
|
120 °С в течение 30 мин |
0,9 %-й раствор NaCl |
|
112 °С в течение 20 мин |
Среды, содержащие углеводы (среды Гисса), витамины, молоко, желатин |
|
110 °С в течение 30 мин |
Среда Тароцци |
|
100 °С в течение 15 мин |
Среды с мочевиной |
Горячую среду охлаждают до 45 - 50 °С и разливают в стерильные чашки Петри. При необходимости пробирки с агаровыми средами скашивают. Разлитые в чашки Петри агаровые среды оставляют при 18 - 25 °С для застывания в течение 15 - 20 мин, после чего, соблюдая правила асептики, подсушивают в открытом виде вверх дном* при температуре (37 ± 1) °С в течение 40 - 60 мин.
7.1.1. Контроль чистоты розлива
В зависимости от объёма розлива необходимо проверять 1 - 2 чашки (пробирки) или 1 % чашек или пробирок в начале и столько же в конце процесса розлива среды. Чашки (пробирки) следует инкубировать не менее 18 ч при 37 °С или в условиях инкубирования, рекомендуемых для каждой среды.
7.1.2. Хранение приготовленных сред
Готовые к применению стерильные среды разлитые в чашки (пробирки) хранят при 2 - 8 °С в течение 5 - 30 дней согласно инструкции по применению** (см. раздел «Определение срока годности»).
________
*Возможно подсушивание закрытых чашек со средой в термостате при 37 °С в течение 10 - 12 ч.
**Некоторые среды можно хранить при температуре 18 - 25 °С в защищенном от света месте, другие должны быть использованы в день приготовления. При необходимости стерильные питательные среды, разлитые во флаконы объемом не менее 150 мл можно хранить при 2 - 8 °С до 2-х мес., повторно расплавляя перед использованием. Исключение составляют среды, в инструкциях по применению которых содержится предупреждение о том, что стерильная среда во флаконах не подлежит повторному расплавлению.
Определение срока хранения приготовленных сред
Среду готовят к использованию (вносят добавки, разливают в пробирки, чашки Петри и т.д.), помещают в определенные условия (t°, свет) и устанавливают, в течение какого времени и при каких условиях среда сохраняет свой искомый внешний вид (цвет, прозрачность, отсутствие признаков высыхания), pH и специфическую активность.
7.2. Тест-штаммы
Для проведения контроля качества БПС необходимо иметь коллекцию типовых культур, которые могут быть получены из следующих специализированных коллекций:
- Государственная коллекция патогенных микроорганизмов Государственного института стандартизации и контроля (ФГУН ГИСК им. Л.А. Тарасевича Роспотребнадзора);
- Всероссийская коллекция промышленных микроорганизмов (ВКПМ);
- Всесоюзная коллекция непатогенных микроорганизмов (ИБФМ);
- Из международных коллекций:
- Американская коллекция типовых культур (АТСС);
- Английская национальная коллекция типовых культур (NCTC);
- Другие коллекции (см. прилож. 3).
Изоляты микроорганизмов, выделенные из клинического материала и используемые для контроля, должны по свойствам соответствовать микроорганизмам признанных национальных и международных коллекций.
Полученные лабораторией музейные тест-штаммы и свежевыделенные культуры хранят при температуре 2 - 8 °С в лиофилизированном состоянии или на среде хранения (см. «Хранение культур»).
Набор тест-штаммов, необходимый для контроля качества каждой питательной среды, определяется ее назначением, т.е. должен состоять как правило, из нескольких штаммов, моделирующих натурные условия применения среды. Применяемые для контроля тест-штаммы (из лиофилизированного состояния или со среды хранения) не должны проходить более 3-х последовательных пересевов на питательные среды, а свежевыделенные штаммы (при отсутствии музейных для новых возбудителей) с момента выделения и получения их в виде чистых культур не должны проходить более 3 - 5 последовательных пересевов.
Используемые для контроля БПС тест-штаммы должны быть типичными по культурально-морфологическим, биохимическим и серологическим свойствам, а также проверяться на отсутствие диссоциации.
Тест-штаммы необходимые для контроля наиболее распространенных питательных сред (см. прилож. 2) могут быть получены из Государственной коллекции патогенных микроорганизмов ФГУН ГИСК им. Л.А. Тарасевича.
7.2.1. Подготовка тест-штаммов для контроля
7.2.1.1. Восстановление культур
Восстановление культур (из лиофилизированного состояния, со среды хранения) проводят с использованием плотной и жидкой* питательных сред, принятых для определенной группы микроорганизмов.
________
*В случае отсутствия первичного роста культуры на плотной среде необходимые исследования проводят с бульонными культурами.
Микроорганизмы после I пассажа (пересева) обладают пониженной жизнеспособностью, в связи с чем рекомендуется использовать для работы культуру II или III пассажа.
Для большинства микроорганизмов используют сухие питательные среды (СПБ, СПА, ГРМ-бульон, ГРМ-агар) либо готовые к применению коммерческие препараты, имеющие pH 7,2 ± 0,2 (МПА, МПБ, агар и бульон Хотгингера), а также питательные среды лабораторного приготовления:
- для стрептококков, энтерококков - МПА с 0,2 %-й глюкозой, pH 7,6;
- для коринебактерий - СПА с сывороткой (20 %) pH 7,6;
- для анаэробов - среда Тароцци, pH 7,0 ± 0,2;
- для бифидобактерий - среда Блаурокка pH 7,05 ± 0,25
Питательные среды лабораторного приготовления
Бульон Хотгингера:
|
гидролизат Хотгингера |
20,0 г |
|
натрия хлорид |
5,0 г |
|
вода дистиллированная по ГОСТ 6709-72 |
1 л |
|
pH 7,2 ± 0,2 |
|
Приготовление. Гидролизат Хотгингера смешивают с дистиллированной водой из расчета содержания в 1 л среды 20 г сухих веществ, вносят такое количество натрия хлорида, чтобы содержание его в среде составляло 5 г/л. Устанавливают pH 8,0 - 8,2 с помощью 10 %-го р-ра гидроксида натрия, кипятят в течение 2 - 3 мин, фильтруют через фильтровальную бумагу, устанавливают pH 7,2 - 7,4 с помощью 5 %-го р-ра соляной кислоты. Разливают по 10 мл в стерильные пробирки и стерилизуют автоклавированием при температуре 121 °С в течение 15 мин. Бульон годен к применению в течение 2-х месяцев при условии хранения при температуре 2 - 8 °С.
Используется гидролизат Хотгингера (панкреатический гидролизат мясного фарша), предварительно освобожденный от балластных белков, удаляемых подкислением до pH 4,5 - 4,7 раствором соляной кислоты (соотношение с водой 1:1), последующего кипячения в течение 1 - 2 мин и фильтрации через ватно-марлевый фильтр.
Агар Хотгингера:
|
гидролизат Хотгингера |
20,0 г |
|
натрия хлорид |
5,0 г |
|
агар микробиологический |
13,0 - 20,0 г |
|
pH 7,2 ± 0,2 |
|
Приготовление. Гидролизат Хотгингера смешивают с дистиллированной водой из расчета содержания в 1 л среды 20 г сухих веществ, вносят такое количество натрия хлорида, чтобы содержание его в среде составляло 5 г/л. Устанавливают pH 8,0 - 8,2 с помощью 10 %-го р-ра гидроксида натрия, кипятят при постоянном помешивании в течение 3 - 5 мин, фильтруют через ватно-марлевый фильтр, устанавливают pH 7,2 - 7,4 с помощью 5 %-го р-ра соляной кислоты. Разливают по 5 мл в стерильные пробирки и стерилизуют автоклавированием при температуре 121 °С в течение 15 мин. Готовый агар Хоттингера годен к применению в течение 2 месяцев при условии хранения при температуре 2 - 8 °С.
Среда Тароцци:
|
гидролизат Хотгингера |
25,0 г |
|
глюкоза |
5,0 г |
|
натрия хлорид |
5,0 г |
|
агар микробиологический |
1,0 г |
|
фарш мясной (на 1 пробирку с 10 мл среды) |
0,3 - 0,5 г |
|
вода дистиллированная по ГОСТ 6709-72 |
1 л |
|
pH 7,2 ± 0,2 |
|
Приготовление: гидролизат Хоттингера смешивают с дистиллированной водой из расчета содержания в 1 л среды 25,0 г сухих веществ (см. «Определение сухих веществ»), затем вносят такое количество хлорида натрия, чтобы содержание его в среде составляло 5 г/л, устанавливают pH 8,0 - 8,2 с помощью 1 %-го раствора гидроокиси натрия. Смесь кипятят до расплавления агара в течение 2 - 3 мин, фильтруют и устанавливают pH 7,4 - 7,6 с помощью 5 %-го раствора соляной кислоты. Разливают по 10 мл в пробирки, содержащие мясной фарш, и стерилизуют автоклавированием при температуре 110 °С в течение 30 мин. Готовая среда годна к применению в течение месяца со дня приготовления при условии хранения ее при температуре 2 - 8 °С.
Приготовление мясного фарша. Мясной фарш заливают питьевой водой в соотношении 1:5 (по объему) и кипятят в течение 1 - 2 мин, затем сливают воду, а фарш промывают водой и отжимают. Фарш заливают дистиллированной водой и повторяют операцию до получения полностью обезжиренного фарша. (В случае использования сырого фарша его предварительно кипятят в воде в течение 30 мин.) Отжатый с помощью ручного пресса и подсушенный на фильтровальной бумаге фарш закладывают в стерильные флаконы, стерилизуют автоклавированием при температуре 120 °С в течение 30 мин и хранят при температуре 18 - 25 °С.
По мере необходимости фарш раскладывают по стерильным пробиркам (из расчета 0,3 - 0,5 г на 10 мл среды), стерилизуют автоклавированием при температуре 120 °С в течение 30 мин и выдерживают при температуре 37 - 45 °С до полного высыхания фарша.
Следует иметь в виду, что при использовании недостаточно обезжиренного и высушенного фарша в среде может наблюдаться опалесценция.
Среда Блаурокка:
|
печеночный бульон |
1 л |
|
пептон сухой ферментативный для бактериологических целей (ГОСТ 13805-76) |
10,0 г |
|
лактоза |
10,0 г |
|
натрий хлористый |
5,0 г |
|
цистин (ТУ 6-09-235-80) |
0,1 г |
|
агар микробиологический |
0,75 г |
|
PH 7,05 ± 0,25 |
|
Для приготовления печеночного бульона 500 г говяжьей печени кипятят в 1 л дистиллированной воды в течение 2 ч, после фильтрации через марлевый фильтр количество отвара доводят до 1 л дистиллированной водой.
Восстановление аэробов
I пассаж
Лиофилизированные культуры из ампул или со среды хранения пересевают:
- со среды хранения культуру штамма бактериологической петлей переносят в пробирку с питательным бульоном, перемешивают до получения однородной микробной взвеси, 2 - 3 капли которой затем пастеровской пипеткой высевают в пробирку и на чашку Петри (ГОСТ 25336-82Е) с питательным агаром. Пробирку обкатывают, а на чашке Петри посевной материал распределяют шпателем методом истощения для получения отдельных колоний;
- ампулу с лиофилизированной культурой вскрывают согласно инструкции, вносят в нее пастеровской пипеткой 0,4 - 0,6 мл питательного бульона или 0,9 %-го раствора натрия хлорида, перемешивают до получения однородной микробной взвеси и этой же пипеткой засевают в пробирку и на чашку Петри с питательным агаром.
Посевы инкубируют при температуре (37 ± 1) °С в течение 18 - 20 ч*.
Выросшую на питательном агаре культуру каждого тест-штамма проверяют визуально на чистоту роста (отсутствие колоний других микроорганизмов) и отсутствие диссоциации. В случае необходимости проводят изучение культурально-морфологических и биохимических свойств. Тест-штаммы должны находиться в типичной для данного микроорганизма форме. При обнаружении более 25 % полиморфных колоний культура не может быть использована для контроля БПС.
II пассаж
Отдельную типичную колонию культуры I пассажа переносят в пробирку с питательным бульоном, перемешивают и пастеровской пипеткой высевают в 2 - 3 пробирки и чашку Петри с питательным агаром.
После инкубации посевов в течение 18 - 20 ч при температуре (37 ± 1) °С выросшие культуры тест-штаммов проверяют визуально на чистоту роста и используют для контроля среды.
Восстановление анаэробов
I пассаж
Лиофилизированную культуру из ампул или со среды хранения, пересевают в пробирки (посевной материал вносят в нижнюю часть пробирки) с предварительно регенерированной** средой Тароцци и осторожно перемешивают***.
Посевы инкубируют в течение 24 - 48 ч при температуре (37 ± 1) °С до отчетливо видимого роста культуры в виде диффузного помутнения среды с четко выраженной прозрачной зоной. Для получения споровой культуры на среде хранения, время инкубации увеличивают до 48 ч, а затем высевают на споровую среду хранения по п. 7.2.2.
II пассаж
Культуру пересевают в 2 - 3 пробирки со средой Тароцци, а для контроля чистоты культуры - в пробирку со скошенным питательным агаром**** (агар Хоттингера, СПА с 0,5 % глюкозы).
________
*Возможно предварительное подращивание культуры в питательном бульоне в течение (4,0 ± 0,5) ч до посева на питательный агар.
**Регенерацию среды осуществляют перед посевом путем выдерживания пробирок со средой в кипящей водяной бане в течение 10 - 15 мин и последующего быстрого охлаждения в воде.
***При работе с анаэробной культурой перемешивание осуществляют с помощью пипетки; во избежание аэрации пипетку не вынимают из жидкости и содержимое из пипетки не выдувают до конца.
*****Рост должен отсутствовать.
После инкубации посевов в течение 17 - 19 ч при температуре (37 ± 1) °С выросшую на среде Тароцци культуру используют для контроля свойств среды.
7.2.1.2. Контроль тест-штаммов на отсутствие диссоциации
Проверка тест-штаммов на отсутствие диссоциации проводится по
следующим тестам:
а) визуальный просмотр колоний на чашках и под микроскопом в «проходящем» свете;
б) проба кипячением 2 млрд микробных клеток (выращенных на плотной среде) в физиологическом растворе на водяной бане в течение 1 ч. Взвесь должна быть гомогенной;
в) эмульгирование культуры на стекле в 0,9 и в 4,0 %-м растворах NaCl, а также в растворе трипофлавина 1:1000 (для культур, не содержащих поверхностных К-антигенов). Культура не должна образовывать хлопьевидный осадок.
г) реакция агглютинации специфическими сыворотками или в развернутой реакции агглютинации с неадсорбированными сыворотками. Реакция агглютинации должна быть не менее, чем на 3+ при отрицательном контроле в растворе натрия хлорида.
7.2.1.3. Приготовление рабочей культуры и посев
Восстановленные культуры тест-штаммов II пассажа используют для контроля БПС. В качестве инокулята может быть использована одна бактериологическая петля (d = 2 мм) культуры, выросшей на плотной питательной среде, или по 0,1; 0,5; 1,0 мл или 1 бак. петле из суспензии культуры. Используя стерильный 0,9 %-й раствор натрия хлорида готовят взвесь культуры, оптическая плотность которой должна соответствовать 10 ед. по стандартному образцу мутности ГИСК им. Л.А. Тарасевича (ОСО-42-28-85 П-соответствующего года выпуска)*. Из полученной суспензии готовят 10-кратные разведения (10-3 - 10-8) путем последовательного переноса 0,5 мл взвеси культуры в пробирки с 4,5 мл стерильного 0,9 %-го раствора натрия хлорида (или 1 мл микробной взвеси и 9 мл 0,9 %-го раствора натрия хлорида).
_______
*Отраслевой стандартный образец мутности (ОСО-42-28-85 П) выпускается ФГУН ГИСК им. Л.А. Тарасевича для визуального определения мутности бактерийных взвесей методом сравнения. Мутность стандарта, равная 10 единицам мутности, эквивалентна 10 международным единицам мутности, которые ориентировочно соответствуют следующим концентрациям клеток в 1 мл:
0,93×109 клеток/мл для микробов кишечной группы;
11,0×109 клеток/мл для микробов коклюшной группы;
1,7×109 клеток/мл для микробов бруцеллезной группы;
2,2×109 клеток/мл для холерного вибриона;
5,0×109 клеток/мл для туляремийных микробов.
Проводить измерения с помощью ОСО необходимо при температуре от 10 до 30 °С. Для приготовления микробной взвеси обычно пользуются 18 - 20-часовыми микробными культурами, выращенными на скошенном мясо-пептонном агаре или другой плотной среде. Сравнение степени мутности в опытной и эталонной пробирках производят визуально.
В процессе разведения перенос взвеси в следующую пробирку производят со сменой стерильной пипетки вместимостью 1 мл (ГОСТ 29227-91) (2 класс точности).
Для полуколичественной или качественной оценки свойств среды и определения продуктивности целевого микроорганизма следует использовать концентрацию суспензии, обеспечивающую от 10 до 100 КОЕ на чашку или пробирку (разведения 10-5 - 10-7).
Для оценки селективности на чашку или в пробирку высевается по 0,1 или 1,0 мл суспензии нецелевого микроорганизма из разведения не более 10-5.
Посев
В пробирки с бульоном культуру вносят стерильной пипеткой, с последующим перемешиванием содержимого в закрытой пробирке*.
В пробирки с полужидким агаром культуру вносят стерильной пипеткой в столбик среды без дальнейшего перемешивания.
В пробирки с плотным агаром культуру вносят бактериологической петлей уколом в столбик среды, не доводя до дна пробирки, или штрихом на поверхность, микробную взвесь в пробирках со скошенным агаром распределяют путем обкатывания.
На чашки с агаром стерильной пипеткой вносят по 0,1 мл суспензии соответствующего разведения, затем с помощью стерильного шпателя равномерно распределяют суспензию по поверхности, пока она не адсорбируется агаром, либо по 1 мл - обкатыванием.
Посевы помещают в соответствующие условия инкубации.
Инкубация
Температура**, время*** и другие условия инкубации определяются потребностями тест-штаммов, необходимыми для их оптимального роста, а также особенностями питательной среды.
________
*При посеве анаэробов избегать интенсивной аэрации.
**Для большинства микроорганизмов температура инкубации (37 ± 1) °С, для грибов - 20 - 25 °С.
***Минимальное время инкубации, достаточное для выявления микроорганизмов (выражается в часах) после посева культур.
После восстановления культуру лиофильно высушивают в большом количестве ампул. Лиофилизированные культуры необходимо хранить при температуре от 2 до 8 °С. Жизнеспособность их сохраняется не менее 10 лет. Хранение штаммов при температуре от -30 до -69 °С увеличивает этот срок до 30 лет. Транспортирование допускается при температуре до 25 °С в течение 14 суток.
При необходимости восстановленную культуру пересевают на среду хранения.
Среды
хранения
Для большинства аэробов
1. Среда Романова:
|
гидролизат казеина панкреатический |
8,0 г |
|
натрия хлорид 5,0 г |
|
|
агар микробиологический |
5,0 - 10,0 г* |
|
вода дистиллированная по ГОСТ 6709-72 |
1 л |
|
pH 7,2 ± 0,2 |
|
________
*Варьирование величины связано с различной прочностью студня агара. Прочность студня готовой среды должна быть (175 ± 18) г
Разлить по 5 мл в пробирки, стерилизовать автоклавированием при температуре 121 °С в течение 15 мин или 2. Питательная среда следующего состава:
|
питательный бульон, сухой (СПБ) |
15,0 г |
|
или ГРМ-бульон сухой |
20,0 г |
|
агар микробиологический (ГОСТ 17206-96) |
3,0 г |
|
вода дистиллированная (ГОСТ 6709-72) |
1 л |
|
pH 7,2 ± 0,2 |
|
Разлить по 5 мл в пробирки, стерилизовать автоклавированием при температуре 121 °С в течение 15 мин.
Для энтерококков, стрептококков, коринебактерий
1,1 %-й агар Мартена
|
пептон Мартена |
0,5 л |
|
мясная вода |
0,5 л |
|
агар микробиологический (ГОСТ 17206-96) |
1,0 г |
|
pH 7,6 ±0,1, |
|
с добавлением 12,5 % нормальной лошадиной сыворотки или сыворотки крупного рогатого скота.
Разлить по 10 мл в пробирки, стерилизовать автоклавированием при температуре 121 °С в течение 15 мин.
Приготовление пептона Мартена. Фарш свиных желудков заливают подогретой до 50 °С водопроводной водой из расчета: на 1 л воды 300 - 500 г измельченной массы, добавляют 1 % химически чистой соляной кислоты (уд. вес 1,19). Массу хорошо перемешивают и ставят в термостат на 15 - 18 ч (и более) при 37 °С. Действие фермента останавливают нагреванием массы в водяной бане при 80 °С в течение 10 мин. Бутыли тщательно взбалтывают, закрывают ватно-марлевой пробкой и ставят для отстаивания при температуре не выше 12 °С. Через 7 дней пептон готов к применению. Для консервирования необходимо добавить 20 мл хлороформа на 1 л пептона и закрыть бутыль резиновой пробкой. В таком виде пептон может храниться без стерилизации при комнатной температуре в течение 1 г
или 2. МПА 0,1 %-й полужидкий, pH 7,6 ± 0,1;
или 3. Сывороточный агар (питательный агар содержащий 10 % лошадиной сыворотки или СКРС) pH 7,6 ± 0,1;
Для анаэробов
Среда для получения спор («споровая» среда):
|
гидролизат казеина неглубокой степени расщепления ферментативный сухой |
15,0 г |
|
глюкоза |
2,0 г |
|
натрия хлорид |
5,0 г |
|
агар микробиологический |
1,0 г |
|
казеин хлоркальциевый (на 1 пробирку с 10 мл среды) |
0,3 - 0,5 г |
|
вода дистиллированная по ГОСТ 6709-72 |
1 л |
|
натрия хлорид |
5,0 г |
Разлить по 10 мл в пробирки, стерилизовать автоклавированием при температуре 121 °С в течение 15 мин.
Культуру аэробов, прошедшую 2 пассажа (см. «Восстановление культур»), снимают бактериологической петлей. Затем уколом петли ее вносят в столбик агаровой среды хранения.
При недостаточном количестве посевного материала (энтерококки, стрептококки, коринебактерии) бульонную культуру пастеровской пипеткой можно засеять на среду Мартена.
Посевы инкубируют в течение 24 ч при температуре (37 ± 1) °С. Пересевы со среды хранения на питательный бульон, питательный агар и вновь на среду хранения проводят через каждые 3 мес., но не более 4 раз.
Культуру анаэробов, прошедшую 2 пассажа (см. «Восстановление культур»), со среды Тароцци, соблюдая правила асептики, переносят без кусочков мяса во флакон вместимостью 20 - 30 мл, центрифугируют при 3000 об./мин в течение 20 мин. Пипеткой осторожно удаляют надо-садочную жидкость, а к полученной биомассе добавляют небольшое количество стерильного раствора для разведения культуры - («разводящая» жидкость)*. Осторожно перемешивают и переносят в стандартную пробирку (из набора ОСО 42-28-85 П). Готовят взвесь культуры, соответствующую 10 единицам по стандартному образцу мутности ОСО 42-28-85 П, с использованием разводящей жидкости. По 1 мл взвеси, не перемешивая, высевают на казеин в 10 - 15 пробирок с 10 мл предварительно регенерированной среды для получения споровой культуры («споровая» среда). Для определения чистоты культуры при всех пересевах рекомендуется производить высев на агар Хоттингера.
________
Состав раствора для разведения культуры («разводящая» жидкость) : натрия хлорид 8,5 г
кислота тиогликолевая 0,3 мл
вода дистиллированная 1 л pH 7,2 ± 0,2
Раствор стерилизуют при 121 °С 15 мин. Использовать раствор можно в течение 7 дней со дня приготовления. При хранении раствора более суток перед посевом его необходимо регенерировать выдерживанием флаконов в кипящей водяной бане 15 мин и последующим быстрым охлаждением в воде.
Пробирки с посевами инкубируют в течение 44 - 48 ч при температуре (37 ± 1) °С. Содержимое пробирок осторожно перемешивают стерильной пипеткой, делают мазки полученной культуры (окрашивание 1 %-м раствором генцианвиолета), микроскопируют и определяют количество спор (М) в процентах по формуле:
|
|
n - число спор в 3 - 5 полях зрения;
N - общее число (не менее 100) клеток (палочек и спор) в 3 - 5 полях зрения.
Для хранения отбирают пробирки, содержащие не менее 5 % спор**. Пробирки накрывают полиэтиленовой пленкой и хранят при температуре от 2 до 8 °С не более 6 месяцев в условиях, предохраняющих культуру от высыхания. Используют по мере необходимости.
________
**Для получения большего количества пробирок с культурой, закладываемых на хранение, полученную споровую культуру следует вновь пересеять на среду Тароцци (5 - 6 пробирок), инкубировать в течение 48 ч при температуре (37 ± 1)°С и затем на «споровую» среду, как описано выше.
Из одной ампулы лиофилизированной культуры допускается не более трех последовательных пересевов на споровую среду хранения с промежуточными пассажами на среде Тароцци.
7.3. Определение показателя стабильности
основных
биологических свойств микроорганизмов
Показатель стабильности основных биологических свойств микроорганизмов - отношение числа атипичных по морфологии, биохимическим, серологическим, фаголизабельным и другим свойствам колоний к общему числу колоний на чашках (%). Определение этого показателя проводят на чашках, где выросло не менее 25 и не более 150 колоний. Изучают свойства культур, выращенных на питательных средах, по культурально-морфологическим, биохимическим, серологическим, фаголизабельным и другим признакам. При этом оцениваются:
а) характер роста культур (равномерное помутнение среды, формирование пленки на поверхности среды, придонно-пристеночный рост, рост в виде осадка и другое в жидких средах. Равномерное, зональное помутнение среды, рост по уколу, сталактитовый рост, в виде ёлочки и другое - в полужидких средах; форма, структура, характер роста колоний, диаметр - на плотных средах;
б) морфология микроорганизмов - форма (кокки, палочки, отсутствие полиморфизма в размерах, окраске и др.), расположение (одиночное, парное, гроздевидное, цепочки и др.), строение (наличие капсулы, жгутиков, спор, включений и др.), подвижность;
в) серологические свойства изучают в реакции агглютинации на стекле с типовыми агглютинирующими сыворотками. Проверяют физико-химическое состояние клеток - стабильность взвеси микробов (отсутствие спонтанной агглютинации) в пробе с кипячением 1 млрд микробных клеток в 0,9 %-й NaCl;
г) биохимические свойства (ферментация углеводов, образование H2S, индола, токсинообразование, гемолиз и др.), пигментообразование;
д) фаголизабельность.
Данные свойства определяют по общепринятым методикам. По п.п. в), г), д) изучают не менее, чем 3 колонии с каждой чашки.
7.4. Определение показателей чувствительности
среды и
скорости роста микроорганизмов
Чувствительность среды - максимальное разведете культуры, обеспечивающее визуально обнаруживаемый рост* колоний искомого штамма в течение определенного времени и температуры на всех засеянных чашках (пробирках) с питательной средой.
По 0,1 мл микробной суспензии из каждого разведения (см. раздел «Приготовление рабочей культуры и посев») высевают на 3 подсушенные чашки Петри (или пробирки) с плотной средой или в 3 пробирки с 10 мл жидкой (полужидкой) питательной среды**.
________
*О наличии роста микроорганизма Судет как по формированию видимых колоний, так и по изменениям самой среды (помутнение, газообразование, появление осадка, пленки, изменение цвета).
**При посеве в жидкие (полужидкие) питательные среды обогащения посевная доза может составлять 0,5 или 1,0 мл микробной взвеси в каждую пробирку с 9,5 или 9,0 мл среды соответственно.
Посевы помещают в соответствующие условия.
После инкубации производят учет результатов.
Учет результатов:
для плотных сред - через 12 - 24 - 48 ч инкубации;
для жидких (среды обогащения) и транспортных (до посева на среду выращивания) - через 3 - 6 ч и далее.
В случае отсутствия визуально обнаруживаемого роста (для подтверждения его наличия) в жидких средах обогащения после соответствующей инкубации посевов, из каждой пробирки производят высев на чашки с питательным агаром, разделённым на 4 - 8 секторов, на каждый из которых засевают по одной петле культуры из каждой пробирки со средой.
Скорость роста (ч) определяют по минимальному времени инкубации посевов, за которое при соответствующем разведении обеспечивается отчетливый (не менее 100 жизнеспособных клеток) видимый невооруженным глазом рост культуры (помутнение, наличие пленки, осадка, роста по уклону и др.) во всех засеянных пробирках с жидкими (полужидкими) питательными средами или формирование типичных, легко дифференцируемых колоний на чашках (пробирках) с плотной средой.
7.5. Определение дифференцирующих свойств среды
Дифференцирующие свойства среды - выраженность отличительных признаков патогенных микроорганизмов от непатогенных видов и естественных ассоциантов (по структурным особенностям колоний, их окраске, изменению цвета и другим признакам).
Дифференцирующие свойства сред для выделения микроорганизмов определяют по следующим тестам:
а) выраженность дифференцирующего признака - структура колоний, цвет колоний, изменение цвета среды под колониями, ореол вокруг них, диаметр последнего, появление диффузного изменения цвета среды;
б) четкость дифференциации колоний группы патогенных микроорганизмов от непатогенных, входящих в тот же систематический таксон, и от естественных ассоциантов при посеве смесей.
Ход определения
Для оценки дифференцирующих свойств среды готовят смесь из штамма возбудителя и непатогенного штамма (или ассоцианта). Испытывают два варианта смесей патогенного и непатогенного штаммов в количественном соотношении микробных клеток 1:1 (для учета четкости дифференциации) и 1:10 (для оценки возможности выделения единичных патогенных возбудителей из смеси с другими микроорганизмами) (рекомендуемые разведения см. прилож. 2). Высев из каждой смеси производят по 0,1 мл на 3 чашки с опытной средой.
Дифференцирующие свойства сред для идентификации чистых культур определяют качественно, используя набор штаммов с положительными и отрицательными признаками по соответствующим тестам.
Ход определения
Посев производят по одной бактериологической петле (d = 2 мм) культуры каждого тест-штамма или взвеси каждого тест-штамма, соответствующей 10 ед. мутности ОСО, в 3 пробирки с питательной средой.
Посев в пробирки с плотной средой осуществляют уколом в столбик и штрихом по скошенной части.
7.6. Определение ингибирующих свойств среды
Ингибирующие свойства среды - степень подавляющего воздействия на рост и (или) проявление типичных свойств сопутствующей микрофлоры.
Показатель ингибирующих свойств выражают как:
- минимальное разведение культуры, при посеве из которого полностью отсутствует рост и (или) проявление типичных свойств посторонней микрофлоры на испытуемой среде при его наличии на среде выращивания (ингибирующие свойства);
- величину отношения среднего числа сформировавшихся колоний тест-штамма на «неингибиторной» среде (среда выращивания) к среднему числу колоний на испытуемой «ингибиторной» среде (показатель ингибиции) с учетом разведения.
Ход определения
Ингибирующее действие плотных сред в отношении микробов-ассоциантов определяют путем посева по 0,1 мл микробной взвеси из соответствующего разведения* культуры на 3 чашки с испытуемой средой и на 3 чашки со средой выращивания используемого штамма.
________
*Выбор разведения культуры зависит от штамма и степени ингибиции конкретной среды.
Ингибирующее действие жидких (полужидких) селективных (элективных) питательных сред определяют, используя монокультуры и смеси. Оценку действия таких сред проводят в сравнении с «нулевым» посевом, т.е. посевом из контролируемой среды без соответствующей инкубации на среду выращивания.
1. После добавления в 2 - 3 пробирки с испытуемой питательной средой по 0,1 мл** микробной взвеси из определенного разведения культуры микроба-ассоцианта и последующего перемешивания суспензии, осуществляют посев по 0,1 мл взвеси из каждой пробирки на 3 чашки с плотной питательной средой, оптимальной для используемого штамма («нулевой посев»),
________
**При посеве в жидкие (полужидкие) питательные среды посевная доза может составлять 0,5 или 1,0 мл микробной взвеси в каждую пробирку с 9,5 или 9,0 мл среды соответственно.
2. Посевы (и в чашках, и в пробирках) инкубируют при соответствующих условиях в зависимости от назначения среды, после чего содержимое каждой из 3-х засеянных пробирок с жидкой (полужидкой) средой перемешивают и повторно высевают по 0,1 мл на 3 чашки с плотной питательной средой. Посевы инкубируют в тех же условиях.
Показатель ингибиции для жидких (полужидких) селективных сред выражают отношением среднего числа колоний, образовавшихся на плотной среде при «нулевом посеве», к среднему числу колоний на той же среде после инкубирования посевного материала в жидкой (полужидкой) питательной среде.
7.7. Определение эффективности среды
Эффективность среды - выход микробных клеток с 1 мл питательной среды (в млрд/мл) и прирост числа микроорганизмов относительно засеянного (показатель эффективности).
Оценку качества накопительных питательных сред по показателю эффективности производят путем определения концентрации микробных клеток в среде после соответствующей инкубации.
Для плотной питательной среды эффективность определяют по следующей методике: 18 - 20-часовую культуру смывают с плотной среды 0,9 %-м раствором натрия хлорида и взвесь доводят до 10 единиц по оптическому стандарту мутности ОСО 42-28-85 П соответствующего года выпуска. Полученную взвесь разводят 0,9 %-м раствором натрия хлорида в 2 раза, что соответствует приблизительно 500 млн микробных клеток в 1 мл, и высевают по 0,1 мл (50 млн м.к.) на 2 пробирки с испытуемой средой, скошенной таким образом, чтобы в нижней части пробирки не было столбика. Через 20 ч инкубации при 37 °С культуру полностью смывают с поверхности среды 2,5 мл 0,9 %-го раствора хлорида натрия, переносят в стандартную пробирку (из набора ОСО) и добавляют такой объем 0,9 %-го раствора натрия хлорида, чтобы полученная суспензия соответствовала 10 единицам по стандартному образцу мутности (109 м.к./мл). Учитывая разведение, определяют выход микробных клеток (млрд) с 1 мл среды.
Пример:
Смывают культуру с 5 мл питательного агара 2,5 мл 0,9 %-го раствора хлорида натрия, т.е. на 1 мл питательного агара приходится 0,5 мл взвеси культуры. Для разведения 0,5 мл взвеси культуры до содержания 1 млрд микробных тел (10 ед. по стандарту мутности) пошло 3,5 мл 0,9 %-го раствора хлорида натрия. Следовательно, в пробирке будет содержаться 3,5 мл 0,9 %-го раствора хлорида натрия плюс 0,5 взвеси культуры, т.е. всего 4,0 мл микробной взвеси с концентрацией 1 млрд м.к./мл, степень разведения составляет 8 (4,0/0,5), а выход микробных клеток с 1 мл среды составит соответственно 8 млрд. Показатель эффективности составит 800 (5×8 млрд/50 млн).
В жидких (полужидких) средах обогащения определение эффекта накопления проводят по методике, описанной для определения показателя ингибиции. Из соответствующего разведения культуры (10-4, 10-5, 10-6, 10-7)* по 1 мл взвеси вносят в 3 пробирки с 9 мл жидкой (полужидкой) испытуемой накопительной средой.
________
*Выбор разведения для конкретного штамма определяется возможностью подсчета колоний до и после накопления культуры в среде.
Содержимое пробирок перемешивают и из каждой пробирки производят высев по 0,1 мл взвеси культуры на 3 чашки с питательной средой, оптимальной для данного микроорганизма («нулевой посев»).
После соответствующей инкубации посевов в накопительной среде (3 - 6 ч и более), независимо от видимых изменений, из каждой пробирки после перемешивания производят аналогичный высев на чашки с плотной питательной средой (по 0,1 мл на чашку). В случае обильного роста культуры в жидкой среде, её перед посевом на чашки необходимо развести. Степень разведения учитывают при обработке результатов.
Через 18 - 20 и более часов инкубации производят подсчет сформировавшихся колоний на чашках, засеянных из исходных взвесей культур («нулевой» посев) и после обогащения в жидкой (полужидкой) среде в течение определенного времени.
Прирост числа микроорганизмов в накопительной среде в процессе инкубации посевов в течение соответствующего времени (t) определяют по формуле (%):
|
|
Э - показатель эффективности (прирост);
nt - среднее число колоний на чашках после инкубации культуры в жидкой (полужидкой) накопительной среде;
n0 - среднее число колоний при «нулевом посеве»;
K - степень разведения.
7.8. Определение показателя прорастания микроорганизмов
Данный показатель определяют для плотных питательных сред.
Подготовку тест-штаммов для контроля, их посев в среду осуществляют по аналогии с методикой определения показателей чувствительности и скорости роста. Посев осуществляют параллельно на испытуемую и контрольную среду*, как правило из 2-х разведений, обеспечивающих формирование на чашке Петри не менее 25 и не более 150 колоний.
________
*В качестве контрольной может быть использована среда, на которой формируется максимальное число колоний из числа засеянных, а также ранее отконтролированная по всем показателям среда с требуемыми свойствами.
Показатель прорастания микробных клеток определяют как отношение среднего числа колоний, образовавшихся на испытуемой среде, к среднему числу колоний на контрольной среде, выраженное в процентах.
7.9. Определение нейтрализующих свойств среды
Нейтрализующие свойства среды - способность среды нейтрализовать действие консервантов, т.е. обеспечивать 100 %-е прорастание засеянной культуры.
Данный показатель определяют для сред, используемых при контроле стерильности МИБП. Питательная среда должна нейтрализовать действие консерванта, и ее чувствительность по отношению к тест-штаммам не должна зависеть от его присутствия. К таким средам, в частности, относится тиогликолевая среда, нейтрализующая действие ртутного консерванта - мертиолята.
Ход определения
Для определения нейтрализующих свойств в пробирки с 10,0 мл тиогликолевой среды вносят раствор мертиолята в максимально используемой концентрации - 0,5⋅10-5 г/мл среды, а затем микробную взвесь тест-штамма A. faecalis 415 из разведений (показательных для чувствительности сред) 10-6, 10-7, 10-8 (см. «Определение чувствительности и скорости роста»).
Среда считается пригодной в случае визуального обнаружения роста культуры не менее чем в 2 из 3 засеянных пробирок при посеве тест-штамма из разведения 10-7 или не менее, чем в одной пробирке из разведения 10-8, не позднее 5 суток инкубации при температуре 34 - 35 °С.
7.10. Определение показателя чувствительности
микроорганизмов
к антимикробным препаратам диск-диффузионным методом
Показатель чувствительности микроорганизмов к антимикробным препаратам - способность среды обеспечивать рост микроорганизмов в виде газона с образованием чётких зон угнетения роста вокруг дисков с соответствующими препаратами.
Данный показатель определяют для сред специального назначения, используемых для выявления чувствительности микроорганизмов к антимикробным препаратам (АМП), нанесенным на диски. Их наименование и концентрация определяется для конкретной среды.
Ход определения
Для получения газонного роста на чашки высевают по 2 мл микробной взвеси каждого тест-штамма из разведения 10-1, посевной материал распределяют обкатыванием (избыток удаляют с помощью пастеровской пипетки), подсушивают 15 мин на воздухе в условиях асептики, а затем стерильным пинцетом раскладывают диски с антимикробными лекарственными средствами (ТУ 9398-001-39484474-2000), слегка прижимая их к агару. Инкубируют посевы с дисками 18 - 20 ч при температуре (37 ± 1) °С.
При измерении зон задержки роста учитывают диаметр только зоны просветления.
Контроль содержания двухвалентных катионов (Са2+, Mg2+)
Поскольку действие АМП зависит от скорости их диффузии в агаровую среду, а также антагонистического воздействия на них компонентов питательной среды, в частности, тимина и тимидина (ингибиторы сульфаниламидов и триметоприма) и катионов Са2+ и Mg2+ (ингибиторы аминогдикозидов, фторхинололов, карбапенемов, тетрациклинов и др.), то среды необходимо стандартизовать по этим показателям.
О содержании в среде двухвалентных катионов (Са2+ и Mg2+) косвенно можно судить по результатам тестирования чувствительности синегнойной палочки к аминогликозидам, определяя чувствительность тест-штамма Р. aeruginosa АТСС 27853 (диаметр зоны подавления роста вокруг диска с гентамицином должен составлять от 16 до 21 мм, минимальная подавляющая концентрация (МПК) - в пределах 0,5 - 2,0 мкг/мл).
Контроль содержания тимина и тимидина
О пригодности среды для определения чувствительности микроорганизма к сульфаниламидам и триметаприму (антифолатам) можно косвенно судить по результатам тестирования контрольного штамма Е. faecalis АТСС 29212. Среда считается удовлетворительной по качеству при МПК триметоприм/сульфометоксазола в отношении данного штамма < 0,5/9,5 мг/мл и диаметре зоны подавления роста вокруг диска с этим препаратом ≥ 20 мм.
7.11. Определение показателей сохранения
жизнеспособности и
стабильности основных биологических свойств микроорганизмов
в транспортных средах
Сохранение жизнеспособности и стабильности основных биологических свойств микроорганизмов - основные требования для транспортных (консервирующих) сред, в течение определенного времени задерживающих размножение и рост микроорганизмов (см. также раздел «Определение показателя стабильности биологических свойств микроорганизмов»).
Ход определения
По 1 мл микробной взвеси тест-штаммов соответствующих видов из разведений (обычно 10-5 и 10-6) высевают на 4 пробирки с транспортной средой. Из 2 пробирок сразу после посева, тщательно перемешав содержимое, производят высев по 0,1 мл взвеси на чашки Петри со средой выращивания («нулевой» посев). Посевы на чашках инкубируют в условиях, необходимых для роста тест-штаммов. Посевы в пробирках выдерживают при температуре 18 - 24 °С в течение 24 ч, а затем из них производят высев, который инкубируют при тех же условиях, что и «нулевой» посев.
Среднее количество колоний, выросших на среде выращивания при «нулевом» посеве и после 24 ч выдерживания в транспортной среде, не должно различаться более чем в 10 раз.
Приложение 1
Перечень показателей, необходимых для контроля
основных групп питательных сред*
|
Показатели |
Тип среды |
|||||||
|
неселективные среды |
селективные среды |
|||||||
|
основы и добавки |
среды для предварительной идентификации |
среды для культивирования |
накопительные среды |
транспортные среды |
среды для идентификации |
среды для выделения и дифференциации |
накопительные среды |
|
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
|
Внешний вид препарата |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
|
Растворимость |
Для сухих препаратов |
|||||||
|
Прозрачность и цветность |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
|
pH |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
|
Белок |
+ |
- |
- |
- |
- |
- |
- |
- |
|
Пептиды по биуретовой реакции |
+ |
- |
- |
- |
- |
- |
- |
- |
|
Общий азот с реактивом Несслера |
+ |
- |
- |
- |
- |
- |
- |
- |
|
Аминный азот |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
|
Хлориды |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
|
Потери в массе при высушивании |
Для сухих препаратов |
|||||||
|
Сухой остаток |
+** |
|
||||||
|
Стерильность |
Для готовых к применению препаратов |
|||||||
|
Прочность студня |
- |
для агаровых сред |
- |
- |
для агаровых сред |
- |
||
|
Температуры плавления студня среды |
- |
Для готовых к применению агаровых сред |
- |
- |
Для готовых к применению агаровых сред |
- |
||
|
Продолжительность плавления студня среды |
- |
Для готовых к применению агаровых сред |
- |
- |
Для готовых к применению агаровых сред |
- |
||
|
Срок годности |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
|
Контроль чистоты розлива |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
|
Чувствительность среды |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
|
|
Дифференцирующие свойства среды |
- |
+ |
- |
- |
- |
+ |
+ |
- |
|
Ингибирующие свойства среды (показатель ингибиции) |
- |
- |
- |
- |
- |
+ |
+ |
+ |
|
Эффективность среды (показатель эффективности) |
- |
- |
- |
+ |
- |
- |
- |
+ |
|
Показатель прорастания |
Для препаратов, содержащих агар |
|||||||
|
Показатель стабильности основных биологических свойств микроорганизмов |
+ |
+ |
+ |
+ |
+ |
+ |
|
+ |
|
Нейтрализующие свойства среды |
Для сред, используемых при контроле стерильности МИБП |
|||||||
|
Чувствительность микроорганизмов к АМП |
Для сред, используемых для определения чувствительности микроорганизмов к антимикробным препаратам |
|||||||
|
Показатели жизнеспособности и сохранения основных биологических свойств микроорганизмов в транспортных средах |
- |
- |
- |
- |
+ |
- |
- |
- |
|
*Определяющим показателем при оценке качества питательной среды является соответствие по специфической активности. **Для готовых к применению препаратов. |
||||||||
Приложение 2
|
Среды и добавки |
Тип* |
Назначение |
Специфическая активность |
Тест-штаммы (коллекция |
Разведение |
Инкубация |
Результаты роста |
|||||||||||||||||||||||||||||||||||||||||||
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
|||||||||||||||||||||||||||||||||||||||||||
|
Неселективные среды для культивирования микроорганизмов |
||||||||||||||||||||||||||||||||||||||||||||||||||
|
Питательный бульон для культивирования микроорганизмов (сухие: СПБ, ГРМ-бульон, ГМФ-бульон; готовые к употреблению: бульон Хоттингера, мясо-пептонный бульон) |
ЖИДКАЯ |
Для культивирования различных микроорганизмов |
Чувствительность среды и стабильность основных биологических свойств микроорганизмов |
С. xerosis 1911 S. aureus Wood-46** |
10-6 |
44 - 48 ч (37 ± 1) °C |
Рост С. xerosis, S. aureus, Е. coli, P.aeruginosa в виде диффузного помутнения, S. pyogenes в виде придонно-пристеночного роста (возможно слабое диффузное помутнение) |
|||||||||||||||||||||||||||||||||||||||||||
|
S. pyogenes Dick I |
10-4 |
|||||||||||||||||||||||||||||||||||||||||||||||||
|
E. coli (O55:K59) 3912/41** P. aeruginosa 27/99** |
10-7 |
20 - 24 ч (37 ± 1) °С |
||||||||||||||||||||||||||||||||||||||||||||||||
|
Стабильность основных биологических свойств микроорганизмов |
S. flexneri 1a 8516*** S. typhi H-901 ГДР/ГИСК**** |
1 бак. петля |
Образование индола (S. flexneri) и сероводорода (S. typhi) определяемое по индикатору |
|||||||||||||||||||||||||||||||||||||||||||||||
|
Питательный агар для культивирования микроорганизмов, сухой (СПА, ГРМ-агар, ГМФ-агар; готовые к употреблению: агар Хоттингера, мясо-пептонный агар) |
ПЛОТНАЯ |
Для культивирования различных микроорганизмов |
Чувствительность среды и стабильность основных биологических свойств микроорганизмов |
S. flexneri 1a 8516 S. sonnei «S-form» |
10-6 |
18 - 20 ч (37 ± 1) °С |
Рост в виде изолированных колоний, бесцветных, прозрачных |
|||||||||||||||||||||||||||||||||||||||||||
|
Стабильность основных биологических свойств микроорганизмов |
P. aeruginosa 27/99 S. marcescens 303 (или S. plymuthica 1) |
101 |
18 - 20 ч (37 ± 1)°С S. marcescens 1 при (22 ± 2) °С |
Образование сине-зеленого или зеленого пигмента Р. aeruginosa 27/99 и оранжево-красного S. marcescens 1 |
||||||||||||||||||||||||||||||||||||||||||||||
|
* - тип (консистенция) питательной среды, подготовленной к применению; ** - тест-штамм для контроля ГРМ-бульона; *** - тест-штамм не обязателен для контроля мясо-пептонного бульона; ****Тест-штамм не обязателен для контроля мясо-пептонного бульона и бульона Хоттингера |
||||||||||||||||||||||||||||||||||||||||||||||||||
|
Дифференциально-диагностические селективные среды для выделения микроорганизмов |
||||||||||||||||||||||||||||||||||||||||||||||||||
|
Питательная среда для выделения и дифференциации возбудителей аэробной инфекции, сухая |
ПЛОТНАЯ |
Для выделения и дифференциации возбудителей аэробной инфекции/стафилококка, синегнойной палочки, кишечной палочки/из раневого содержимого |
Чувствительность среды и стабильность основных биологических свойств микроорганизмов |
S. aureus «Виотко» Р. aeruginosa 89 Е.coli 3912/41 (O55:K59) Р. mirabilis 3177 |
10-7 |
18 - 22 ч (37 ± 1) °С |
Рост в виде единичных колоний. Колонии S. aureus - круглые, оранжевые с черным центром или без него, Е. coli - серые или серо-голубые, Р. aeruginosa - розового цвета |
|||||||||||||||||||||||||||||||||||||||||||
|
Дифференцирующие свойства |
Смеси (1:1): 1. S. aureus + Е. coli 2. Р. aeruginosa + Е. coli 3. Р. aeruginosa +S. aureus |
из 10-5 разбавленное в 5 раз (условно 10-6) |
|
Четкая дифференциация: S. aureus - в виде оранжевых колоний с черным центром или без него; Е. coli в виде серых или серо-голубых колоний; Р. aeruginosa в виде колоний розового цвета |
||||||||||||||||||||||||||||||||||||||||||||||
|
Ингибирующие свойства |
Р. mirabilis 3177 |
10-6 |
На среде подавляется «роение» Р. mirabilis, колонии в О-форме, прозрачные красноватого цвета, на питательном агаре «роение» наблюдается |
|||||||||||||||||||||||||||||||||||||||||||||||
|
Питательная среда для выделения и дифференциации энтеробактерий, сухая (среда Кода, SDS-бульон) |
ЖИДКАЯ |
Для выделения и дифференциации энтеробактерий по признаку ферментации лактозы при санитарном обследовании пищевых продуктов (среда Кода), объектов внешней среды/вода, смывы и др./ (SDS-бульон) |
Чувствительность среды и стабильность основных биологических свойств микроорганизмов |
Е. coli Ewing (0124:K72) 227; K. pneumoniae 3534/51; С. freundii 101/57; S. marcescens 1; S. flexneri 1a 8516 |
10-6 |
44 - 48 ч (37 ± 1) °C |
Рост в виде диффузного помутнения среды с изменением цвета с зеленого на желтый |
|||||||||||||||||||||||||||||||||||||||||||
|
Дифференцирующие свойства |
E. coli 675; E. aerogenes 10006 |
10-6 |
20 - 24 ч (37 ± 1) °C |
Диффузное помутнение среды без изменения цвета |
||||||||||||||||||||||||||||||||||||||||||||||
|
Ингибирующие свойства |
P. vulgaris HX19222 S. aureus Wood-46 |
10-1 |
44 - 48 ч (37 ± 1) °C |
На среде подавляется рост стафилококка и протея. Среда остается прозрачной без изменения цвета, в питательном бульоне наблюдается диффузное помутнение |
||||||||||||||||||||||||||||||||||||||||||||||
|
Питательная среда для обнаружения бактерий группы кишечной палочки, сухая (среда Кесслера-ГРМ) |
ЖИДКАЯ |
Для обнаружения бактерий группы кишечной палочки по признаку ферментации лактозы при санитарно-бактериологическом обследовании пищевых продуктов и объектов внешней среды |
Чувствительность среды и стабильность основных биологических свойств микроорганизмов |
Е. coli 675; K. pneumoniae 418; С. freundii 101/57; Е. aerogenes 10006; Р. aeruginosa 27/99 |
10-6 |
22 - 24 ч (37 ± 1) °C Е.coli 675 при (43 ± 1) °С |
Рост Е. coli, K. pneumoniae, С. freundii в виде диффузного помутнения среда и газообразования; Е. aerogenes - в виде диффузного помутнения среда и слабого газообразования; Р. aeruginosa - в виде слабого помутнения среда без газообразования |
|||||||||||||||||||||||||||||||||||||||||||
|
Ингибирующие свойства |
Р. vulgaris НХ19222; |
10-4 |
44 - 48 ч (37 ± 1) |
На среде подавляется рост стафилококка и протея. Среда остается прозрачной, в питательном бульоне наблюдается диффузное помутнение |
||||||||||||||||||||||||||||||||||||||||||||||
|
S. aureus Wood-46 |
10-4 |
|||||||||||||||||||||||||||||||||||||||||||||||||
|
Питательная среда для выделения энтеробактерий, сухая(агар Эндо) |
ПЛОТНАЯ |
Выделение энтеробактерий из исследуемого материала и их дифференциация по признаку ферментации лактозы (лактозоотрицательные шигеллы от лактозоположительных эшерихий) |
Чувствительность среды и стабильность основных биологических свойств микроорганизмов |
S. sonnei «S-form»; S. dysenteriae I 1362; E. coli 3912/41 (O55:K59); E. coli 168/59; (О111:K58) |
10-6 разбавленное 1:1 (условно 10-7) |
18 - 20 ч (37 ± 1) °C |
Рост в виде изолированных колоний. Колонии S. dysenteriae I прозрачные, бесцветные, S. sonnei бесцветные или могут быть слегка розовыми, со слабовыраженным центром Е. coli 3912/41 - красные с металлическим блеском, Е. coli 168/59 - металлический блеск может быть менее выраженный |
|||||||||||||||||||||||||||||||||||||||||||
|
Дифференцирующие свойства |
Смеси (1:1): 1. S. sonnei «S-form» и E. coli 168/59 (O111:K58); 2. S. dysenteriae I 1362 и E. coli 3912-41 (O55:K59) |
10-6 |
Лактозоотрицательные энтеробактерии образуют прозрачные или полупрозрачные бесцветные колонии (могут образовывать колонии бледно-розового цвета). Лактозоположительные энтеробактерии образуют колонии красного цвета с металлическим блеском или без него |
|||||||||||||||||||||||||||||||||||||||||||||||
|
Ингибирующие свойства |
S. aureus Wood-46 |
10-1 |
На среде подавляется рост стафилококка, на питательном агаре наблюдается газонный рост |
|||||||||||||||||||||||||||||||||||||||||||||||
|
Питательная среда для выделения и дифференциации энтеробактерий селективная сухая (типа Макконки агара) |
ПЛОТНАЯ |
Выделение энтеробактерии из исследуемого материала (моча, фекалии, пищевые продукты, вода) и их дифференциация по признаку ферментации лактозы |
Чувствительность среды и стабильность основных биологических свойств микроорганизмов |
Е. coli 3912/41 (O55:K59); S. typhimurium 79; S. flexneri 1a 8516 |
10-6 |
18 - 20 ч (37 ± 1) °C |
Рост в виде изолированных колоний. Колонии Е. coli ярко-розовые, S. flexneri - полупрозрачные, бесцветные, S. typhimurium - полупрозрачные, бесцветные. Колонии Р. mirabilis F-392 изолированные, бесцветные в О-форме колонии без «роения». На питательном агаре «роение» наблюдается |
|||||||||||||||||||||||||||||||||||||||||||
|
Дифференцирующие свойства |
Смесь (1:1): E.coli 3912/41 (O55:K59) с S. typhimurium 79 |
10-6 |
|
Лактозоположительные энтеробактерии растут в виде ярко-розовых колонии, лактозоотрицательные - в виде бесцветных |
||||||||||||||||||||||||||||||||||||||||||||||
|
Ингибирующие свойства |
S. aureus 209-P |
10-1 |
На среде подавляется рост стафилококка, на питательном агаре наблюдается газонный рост. На среде подавляется «роение» протея, на питательном агаре «роение» наблюдается |
|||||||||||||||||||||||||||||||||||||||||||||||
|
P. mirabilis F-392 |
10-6 |
|||||||||||||||||||||||||||||||||||||||||||||||||
|
Питательная среда для выделения бактерий родов Proteus, Providencia, Morganella, сухая |
ПЛОТНАЯ |
Для выделения бактерий родов Proteus, Providencia, Morganella из инфицированного материала |
Чувствительность среды |
P. mirabilis 3177; P. alcalifaecins 1035-49; |
10-7 |
20 - 22 ч (37 ± 1) °C |
Рост в виде единичных колоний |
|||||||||||||||||||||||||||||||||||||||||||
|
P. vulgaris HX19; M. morganii 1707 |
10-6 |
Рост в виде изолированных колоний |
||||||||||||||||||||||||||||||||||||||||||||||||
|
Стабильность основных биологических свойств микроорганизмов |
P. mirabilis 3177; P. alcalifaecins 1035-49; |
10-6 |
Наблюдается формирование колоний в О-форме, без «роения» голубоватого цвета Возможна Н-форма колоний Р. vulgaris и Р. Mirabilis с зоной роения не более 5 мм |
|||||||||||||||||||||||||||||||||||||||||||||||
|
P. vulgaris HX19; M. morganii 1707 P. rettgeri I (Титов) |
10-5 |
|||||||||||||||||||||||||||||||||||||||||||||||||
|
Ингибирующие свойства |
E. coli 3912/41 (O55:K59); S. aureus 209-P; P. aeruginosa 08 Habs |
10-1 |
44 - 48 ч (37 ± 1) °C |
На среде подавляется рост кишечной палочки, стафилококка, синегнойной палочки, на питательном агаре наблюдается газонный рост этих микроорганизмов |
||||||||||||||||||||||||||||||||||||||||||||||
|
Питательная среда для выделения сальмонелл и шигелл, сухая (SS-агар, бактоагар Плоскирева) |
ПЛОТНАЯ |
Для выделения сальмонелл и шигелл из исследуемого материала (фекалии, моча и др.) и их дифференциация от других энтеробактерий по признаку ферментации лактозы |
Чувствительность среды и стабильность основных биологических свойств микроорганизмов |
S.typhi H-901 ГДР/ГИСК; S. paratyphi А 225; S. flexneri 1a 8516; S. sonnei «S-form» |
10-6 разбавленное 1:1 (условно 10-7) |
18 - 20 ч (37 ± ) °С |
Рост в виде изолированных колоний. Колонии S. typhi, S. paratyphi, S. flexneri - бесцветные; S. sonnei - бесцветные или слегка розовые, E.coli - красные |
|||||||||||||||||||||||||||||||||||||||||||
|
Дифференцирующие свойства |
Смеси (1:1): 1. S.typhi H-901 ГДР/ГИСК и E.coli 3912/41 (O55:K59); 2. S. paratyphi A 225 и E. coli 3912/41 (O55:K59); 3. S. flexneri 1a 8516 и E. coli 3912/41 (O55:K59); 4. S. sonnei «S-form» и E. coli 3912/41 (O55:K59) |
шигеллы и сальмонеллы 10-6; E.coli 3912/41 (055:K59) 10-4*, 10-5 |
|
Хорошая дифференциация: колонии сальмонелл - бесцветные; шигелл - бесцветные или слегка розовые, эшерихий - красные |
||||||||||||||||||||||||||||||||||||||||||||||
|
Ингибирующие свойства |
S. aureus Wood-46; |
10-1 |
На средах подавляется рост стафилококка, на питательном агаре наблюдается газонный рост. На средах подавляется рост эшерихий не менее, чем в три раза по отношению к числу колоний на питательном агаре. На SS-агаре подавляется «роение» протея, на бактоагаре Плоскирева и питательном агаре «роение» наблюдается |
|||||||||||||||||||||||||||||||||||||||||||||||
|
E.coli 3912/41 (O55:K59); |
10-5 10-6** |
|||||||||||||||||||||||||||||||||||||||||||||||||
|
P. mirabilis 3177*; P. vulgaris HX19222* |
10-5 |
|||||||||||||||||||||||||||||||||||||||||||||||||
|
* - тест-штамм не обязателен для контроля бактоагара Плоскирева; ** - разведение не обязательно для контроля SS-агара |
||||||||||||||||||||||||||||||||||||||||||||||||||
|
Питательная среда для выделения и дифференциации Е. coli O157:Н7 и др. энтеробактерий по признаку ферментации сорбита, сухая (сорбитол E.coli O157:Н7 агар, ЭДКС-агар) |
ПЛОТНАЯ |
Выделение и идентификация Е. coli O157:Н7 и др. энтеробактерий из исследуемого материала (фекалии, питьевая и сточные воды, пищевые продукты и др.) по признаку ферментации сорбита |
Чувствительность среды и стабильность основных биологических свойств микроорганизмов |
Е. coli 4 (O157:Н7); Е. coli 3912/41 (O55:K59); S. typhimurium 79; S. flexneri 1a 8516 |
1:1 из 10-6 (условно 10-7) |
18 - 20 ч (37 ± 1) °C |
Рост в виде изолированных колоний. На сорбитол агаре колонии E.coli 4 (O157:Н7) и S. flexneri - бесцветные или светло-розовые, Е. coli 3912/41 (O55:K59) - малиновые со слабовыраженным металлическим блеском или без него, S.typhimurium - малиновые с металлическим блеском. На ЭДКС- агаре колонии Е. coli 4 (O157:Н7) полупрозрачные, бесцветные, колонии Е. coli 3912/41 (O55:K59) желтого цвета, S. flexneri, полупрозрачные, бесцветные, S. typhimurium желтого цвета |
|||||||||||||||||||||||||||||||||||||||||||
|
Дифференцирующие свойства |
Смеси (1:1) 1. E. coli 4 (O157:H7)c E. coli 3912/41 (O55:K59); 2. E. coli 4 (O157:H7) c S. typhimurium 79 |
10-6 |
На средах сорбитотрицательные энтеробактерии, в том числе Е. coli 4 (O157:Н7) образуют полупрозрачные, бесцветные или светло-розовые колонии. Сорбитположительные колонии на Сорбитол Е coli O157:Н7 агаре образуют колонии розовато-малинового или малинового цвета с металлическим блеском или без него, на ЭДКС-агаре - желтые |
|||||||||||||||||||||||||||||||||||||||||||||||
|
Ингибирующие свойства |
S. aureus Wood-46 |
10-1 |
На средах ингибируется рост стафилококка, на питательном агаре - газонный рост. На среде ЭДКС-агар подавляется «роение» протея, на среде Сорбитол Е. coli O157:Н7 агар и питательном агаре «роение» наблюдается |
|||||||||||||||||||||||||||||||||||||||||||||||
|
P. vulgaris HX19222* |
10-5 |
|||||||||||||||||||||||||||||||||||||||||||||||||
|
* - тест-штамм не обязателен для контроля Сорбитол E. coli O157:H7 агара |
||||||||||||||||||||||||||||||||||||||||||||||||||
|
Питательная среда для выделения сальмонелл, сухая (висмут-сульфит агар) |
ПЛОТНАЯ |
Сальмонеллы |
Чувствительность среды и стабильность основных биологических свойств микроорганизмов |
S.typhi H-901 ГДР/ГИСК; S. typhimurium 79; S. london 3496; S. paratyphi A 225; S. gallinarum 665; S. typhibismuth |
10-6 разбавленное 1:1 (условно 10-7) |
44 - 48 ч (37 ± 1) °С |
Рост в виде изолированных колоний. Колонии S. typhi, S. typhimurium, S. london черные с блестящей зоной вокруг и черным цветом среды подними; S. paratyphi - зеленые с темным центром; S. gallinarum - зеленые; S. typhibismuth - полиморфные черные с окрашиванием среды под ними в черный цвет |
|||||||||||||||||||||||||||||||||||||||||||
|
Дифференцирующие свойства |
Смеси (1:1) S. typhimurium 79 и E.coli 3912/41 (O55:K59) |
10-6 10-3 и 10-4 |
Рост сальмонелл в виде черных колоний с блестящей зоной вокруг них и окрашиванием в черный цвет среды под колониями. S. paratyphi и S. gallinarum образуют зеленые колонии. Эшерихии растут в виде зеленовато-коричневых колоний |
|||||||||||||||||||||||||||||||||||||||||||||||
|
Ингибирующие свойства |
S. aureus Wood-46; |
10-1 |
На среде подавляется рост стафилококков, клебсиелл и «роение» протея. На питательном агаре наблюдается газонный рост стафилококка, густой рост клебсиелл и «роение» протея |
|||||||||||||||||||||||||||||||||||||||||||||||
|
K. rhinoscleromatis NCTC 5046; |
10-5 |
|||||||||||||||||||||||||||||||||||||||||||||||||
|
P. vulgaris HX19222 |
10-6 |
|||||||||||||||||||||||||||||||||||||||||||||||||
|
Среда для выделения сальмонелл-ПД, сухая (питательная среда с бриллиантовым зеленым и феноловым красным) |
ПЛОТНАЯ |
Для выделения сальмонелл из исследуемого материала для санитарно-бактериологического контроля пищевых продуктов и лекарственных средств |
Чувствительность среды и стабильность основных биологических свойств микроорганизмов |
S. paratyphi S. typhimurium 301 E. coli ATCC 25922 |
10-6 |
18 - 20 ч (37 ± 1) °С |
Рост в виде изолированных колоний. Колонии S. paratyphi А 225 розового цвета с розовым ореолом, S. typhimurium 301 - розово-красного цвета с розово-красным ореолом, E. coli АТСС 25922 желто-зеленые с желто-зеленым ореолом |
|||||||||||||||||||||||||||||||||||||||||||
|
Дифференцирующие свойства |
Смесь (1:1) S. typhimurium 301 и E. coli ATCC 25922 |
10-6 |
Хорошая дифференциация сальмонелл (колонии розового или розово-красного цвета) от эшерихий (колонии желто-зеленые) |
|||||||||||||||||||||||||||||||||||||||||||||||
|
Ингибирующие свойства |
S. aureus 209 P |
10-3 |
На среде подавляется рост стафилококка, на питательном агаре наблюдается густой рост |
|||||||||||||||||||||||||||||||||||||||||||||||
|
Питательная среда для выделения стафилококков сухая (солевой агар-М, элективный солевой агар) |
ПЛОТНАЯ |
Для выделения стафилококков из исследуемого материала (пищевые продукты, грудное молоко, смывы, вода, кровь, кал и др.) |
Чувствительность среды и стабильность основных биологических свойств микроорганизмов |
S. epidermidis АТСС 14990; S. saprophyticus АТСС 15305; |
10-6
|
48 ч (37 ± 1) °C |
Рост в виде изолированных и единичных колоний. Колонии S. aureus «Виотко» желтого цвета, S. epidermidis и S. saprophyticus белого цвета |
|||||||||||||||||||||||||||||||||||||||||||
|
S. aureus «Виотко» |
10-6, 10-7 |
|||||||||||||||||||||||||||||||||||||||||||||||||
|
Ингибирующие свойства |
Е. coli 168/59 (O111:K58); Р. aeruginosa 273; Р. vulgaris НХ19222 |
10-2 |
На среде подавляется рост эшерихий, протея, сине гнойной палочки, на питательном агаре наблюдается газонный рост этих микроорганизмов |
|||||||||||||||||||||||||||||||||||||||||||||||
|
Питательная среда для выделения синегнойной палочки, сухая (ЦПХ-агар) |
ПЛОТНАЯ |
Для селективного выделения культуры Pseudomonas aeruginosa из инфицированного материала (отделяемое ожоговых и хирургических ран, кал, моча) |
Чувствительность среды |
Р. aeruginosa 08 (Habs); Р. aeruginosa 26; Р. aeruginosa 165 |
10-7 |
23 - 25 ч (37 ± 1) °C |
Рост в виде единичных колоний |
|||||||||||||||||||||||||||||||||||||||||||
|
Стабильность основных биологических свойств микроорганизмов |
Р. aeruginosa 08 (Habs); Р. aeruginosa 26; P. aeruginosa 165 |
10-6 |
Колонии Р. aeruginosa полупрозрачные с окрашиванием среды в зеленый или сине-зеленый цвет |
|||||||||||||||||||||||||||||||||||||||||||||||
|
Ингибирующие свойства |
E. coli 3912/41 (O55:K59); S. aureus 209-P; P. vulgaris HX19222 |
10-2 |
46 - 50 ч (37 ± 1) °C |
На среде подавляется рост стафилококка, протея, кишечной палочки, на питательном агаре наблюдается газонный рост этих микроорганизмов |
||||||||||||||||||||||||||||||||||||||||||||||
|
Питательная среда для выделения и дифференциации коринебактерий, сухая (среда Бучина) |
ПЛОТНАЯ |
Для выделения и дифференциации коринебактерий из инфицированного материала |
Чувствительность среды и стабильность основных биологических свойств микроорганизмов |
C. diphtheriae mitis 6765; C. diphtheriae gravis 665; C. xerosis 1911; C. ulcerans 675 |
10-6, 10-7 |
44 - 48 ч (37 ± 1) °C |
Рост в виде изолированных и единичных колоний. Колонии С. diphtheriae mitis и С. ulcerans темно-синие, гладкие, С. diphtheriae gravis темно-синие шероховатые, С. xerosis - серовато-голубые |
|||||||||||||||||||||||||||||||||||||||||||
|
Дифференцирующие свойства |
Смесь (1:1) C. diphtheriae mitis 6765 и C. xerosis 1911 |
10-6 |
Четкая дифференциация. На среде коринебактерии дифтерии растут в виде темно-синих колоний, дифтероиды образуют колонии серовато-голубого цвета |
|||||||||||||||||||||||||||||||||||||||||||||||
|
Ингибирующие свойства |
S. aureus Wood-46 |
10-3 |
На среде подавляется рост стафилококка, на питательном агаре наблюдается густой рост |
|||||||||||||||||||||||||||||||||||||||||||||||
|
Питательная среда для выделения коринебактерий, сухая (Коринебак-агар) |
ПЛОТНАЯ |
Выделение коринебактерий из инфицированного материала |
Чувствительность среды и стабильность основных биологических свойств микроорганизмов |
С. diphtheriae mitis 6765; С. diphtheriae gravis 665; С. xerosis 1911; C. ulcerans 675 |
10-6, 10-7 |
20 - 48 ч (37 ± 1) °С |
Рост с образованием через 20 - 24 ч не менее 20 колоний на одной чашке, через 44 - 48 ч - не менее 30 колоний. Через 48 ч колонии С. diphtheriae mitis темно-серые, гладкие; С. diphtheriae gravis - темно-серые, шероховатые; С. ulcerans и С. xerosis - серовато-черные, гладкие |
|||||||||||||||||||||||||||||||||||||||||||
|
Ингибирующие свойства |
S. aureus Wood-46; S. pyogenes Dick I |
10-3 |
46 - 48 ч (37 ± 1) °C |
На среде подавляется рост стафилококков и стрептококков, на питательном агаре наблюдается густой рост |
||||||||||||||||||||||||||||||||||||||||||||||
|
Питательная среда для выделения грибов рода Candida, сухая (Кандида-агар) |
ПЛОТНАЯ |
Для выделения грибов Candida из патологического материала, а также при санитарном обследовании объектов внешней среды |
Чувствительность среды и стабильность основных биологических свойств микроорганизмов |
C. albicans 259/NCTC/885/653; C. brumptii 530/ИБФМ-J-40 |
10-5, 10-4 |
23 - 25 ч (37 ± 1) °C |
Рост в виде изолированных и единичных колоний. Колонии С. albicans плотные, с ровными краями, белого цвета, выпуклые, блестящие; С. brumptii - плотные с ровными или волнистыми краями, беловато-кремового цвета, плоские, с неровной поверхностью. На среде подавляется рост кишечной папочки, протея, стафилококка, на питательном агаре наблюдается газонный рост этих микроорганизмов |
|||||||||||||||||||||||||||||||||||||||||||
|
Ингибирующие свойства |
E. coli 3912 (O55:K59); S. aureus 209-P; P. vulgaris HX 19222 |
10 ед. |
47 - 49 ч (37 ± 1) °C |
|||||||||||||||||||||||||||||||||||||||||||||||
|
Основа питательной среды для выделения уреплазм, сухая (сульфат-марганцевый агар) |
ПЛОТНАЯ |
Для выделения уреплазм из патологического материала после добавления нормальной лошадиной сыворотки, пенициллина и амфотерицина В, мочевины |
Чувствительность среды и стабильность основных биологических свойств микроорганизмов |
U. urealyticum (YIII) |
10-3 |
47 - 49 ч (37 ± 1) °C в атмосфере углекислого газа (5 - 10 %) |
Рост в виде типичных изолированных колоний |
|||||||||||||||||||||||||||||||||||||||||||
|
Дифференцирующие свойства |
U. urealyticum (YIII) |
10-3 |
(37 ± 1) °C в атмосфере углекислого газа (5 - 10 %) 47 - 49 ч |
Колонии U. urealyticum коричневые, под микроскопом напоминают яичницу-глазунью. |
||||||||||||||||||||||||||||||||||||||||||||||
|
M. hominis H 31 |
10-3 |
166 - 170 ч |
Колонии М hominis бесцветные, под микроскопом напоминают яичницу-глазунью |
|||||||||||||||||||||||||||||||||||||||||||||||
|
Селективные среды для идентификации микроорганизмов |
||||||||||||||||||||||||||||||||||||||||||||||||||
|
Питательная среда для родовой идентификации энтеробактерий, сухая (цитратный агар Симмонса) |
ПЛОТНАЯ |
Для родовой идентификации энтеробактерий по способности утилизировать цитрат |
Дифференцирующие свойства |
S. paratyphi В 506; С. freundii 34/57; Е. aerogenes ССМ 2531; К. pneumoniae 5055; Р. mirabilis 3177 |
1 бак. петля из (1 петля + 1 мл физ. р-ра) |
48 ч (37 ± 1) °С |
Густой рост микроорганизмов, способных утилизировать цитрат в качестве единственного источника углерода, сопровождается изменением цвета среды с зеленого на синий |
|||||||||||||||||||||||||||||||||||||||||||
|
Р. alcalifaciens 1035-49; |
72 ч (37 ± 1) °С |
|||||||||||||||||||||||||||||||||||||||||||||||||
|
Н. alvei 1 |
120 ч (21 ± 1) °С |
|||||||||||||||||||||||||||||||||||||||||||||||||
|
Ингибирующие свойства |
Р. morganii 417 |
120 ч (37 ± 1) °С |
Отсутствие роста микроорганизмов, не способных утилизировать цитрат в качестве единственного источника углерода, цвет среды не изменяется |
|||||||||||||||||||||||||||||||||||||||||||||||
|
Питательная среда для идентификации энтеробактерий, сухая (ацетатный агар) |
ПЛОТНАЯ |
Для идентификации энтеробактерий по их способности утилизировать ацетат натрия |
Дифференцирующие свойства |
Е. coli 3912/41 (O55:K59); K. pneumoniae K 2 NCTC 5055; |
1 бак. петля из (1 петля +1 мл физ. р-ра) |
48 ч (37 ± 1) °С |
Рост микроорганизмов, способных утилизировать ацетат, сопровождается изменением цвета среды с зеленого на синий |
|||||||||||||||||||||||||||||||||||||||||||
|
Е. coli Ewing «O124:K72» 227 |
72 ч (37 ± 1) °С |
|||||||||||||||||||||||||||||||||||||||||||||||||
|
Ингибирующие свойства |
S. sonnei «S-form» |
48 ч (37 ± 1) °С |
Отсутствие роста микроорганизмов не способных утилизировать ацетат, цвет среды не изменяется |
|||||||||||||||||||||||||||||||||||||||||||||||
|
Основа питательной среды для индикации Ureplasma urealyticum, сухая |
ЖИДКАЯ |
Для индикации U. urealyticum в клиническом материале после добавления к основе питательной среды сыворотки крупного рогатого скота, мочевины, амфотерицина В и пенициллина |
Дифференцирующие свойства |
U. urealyticum (YIII) |
10-3 |
46 - 50 ч (37 ± 1) °С |
Диффузный рост в пробирках с изменением цвета среды от зеленого (исходный) до красно-фиолетового |
|||||||||||||||||||||||||||||||||||||||||||
|
Неселективные среды для предварительной идентификации микроорганизмов |
||||||||||||||||||||||||||||||||||||||||||||||||||
|
Питательная среда с эозинметиленовым синим, сухая (среда Левина) |
ПЛОТНАЯ |
Для выделения энтеробактерий из исследуемого материала и их дифференциации по признаку ферментации лактозы. На среде можно выделить коагулазоположительные стафилококки |
Чувствительность среды и стабильность основных биологических свойств микроорганизмов |
S. flexneri 1a 8516; Е. coli 168/59 (O111:K58); |
10-6, 10-7 |
18 - 20 ч (37 ± 1) °С |
Рост в виде изолированных и единичных колоний. S. flexneri 1a 8516 в виде бесцветных, E. coli 168/59 (O111:K58) в виде фиолетовых колоний. S. aureus 209-Р образует бесцветные или светло-сиреневые колонии |
|||||||||||||||||||||||||||||||||||||||||||
|
S. aureus 209-Р |
10-5 |
(S. aureus 209-Р 48 ч) |
||||||||||||||||||||||||||||||||||||||||||||||||
|
Дифференцирующие свойства |
Смесь (1:1) S. flexneri 1a 8516 и Е. coli 168/59 (O111:K58) |
10-6 |
|
Четкая дифференциация. Лактозоотрицательные образуют прозрачные или полупрозрачные бесцветные колонии (могут образовывать колонии бледно-розового цвета). Лактозоположительные энтеробактерии - не прозрачные от светло-сиреневого до фиолетового цвета с металлическим блеском или без него |
||||||||||||||||||||||||||||||||||||||||||||||
|
Питательная среда для первичной идентификации энтеробактерий, сухая (среда Ресселя) |
ПЛОТНАЯ |
Для первичной идентификации энтеробактерий по признаку ферментации лактозы и глюкозы |
Дифференцирующие свойства |
S. flexneri 1a 8516; S. paratyphi А 225; E. coli 339 (O55:K59); A. faecalis 415 |
1 бак. петля из 10 ед. |
18 - 20 ч (37 ± 1) °С |
При росте микроорганизмов ферментирующих лактозу наблюдается пожелтение скошенной части агара, глюкозы - пожелтение столбика среды. Газообразование сопровождается образованием пузырьков, разрывов, отслоением от стенок. Рост микроорганизмов, не ферментирующих лактозу и глюкозу, сопровождается посинением среды, либо сохраняется исходный зеленый цвет. S. flexneri - пожелтение столбика и посинение скошенной части; S. paratyphi - пожелтение столбика с образованием газа и посинение скошенной части; Е. coli - пожелтение всей среды с газообразованием; A. faecalis - посинение всей среды или только скошенной части |
|||||||||||||||||||||||||||||||||||||||||||
|
Питательная среда для первичной идентификации энтеробактерий, сухая (агар Клиглера) |
ПЛОТНАЯ |
Для идентификации энтеробактерий по их способности ферментировать лактозу, глюкозу, образовывать газ и сероводород |
Дифференцирующие свойства |
S. typhibismuth; S. paratyphi В № 8006; S. sonnei «S-form»; E. coli (O55:K59) 3912/41; P. inconstans 1068-50; P. mirabilis Сиднеев; P. aeruginosa 613-60 |
1 бак. петля |
48 ч (37 ± 1) °С |
При росте микроорганизмов, ферментирующих лактозу, наблюдается пожелтение скошенной части агара, глюкозы - пожелтение столбика среды. Газообразование сопровождается образованием пузырьков, разрывов, отслоением от стенок. Образование H2S сопровождается почернением среды в столбике, а при слабом образовании - почернением на грани столбика и «косяка» или, реже, на дне пробирки. Рост микроорганизмов, не ферментирующих лактозу и глюкозу, не влияет на исходный (красный) цвет среды. Лактоза, глюкоза, газ, H2S: S. typhibismuth: - + - + слабо; S. paratyphi: - + (маскируется) + +; S. sonnei: - + - -; Е. coli; + + + -; Р. inconst.: - + +слабо -; Р. mirabilis: - +(маскируется) + +; Р. aeruginosa: - - - - |
|||||||||||||||||||||||||||||||||||||||||||
|
Питательная среда для идентификации энтеробактерий, сухая (цитратный агар Кристенсена) |
ПЛОТНАЯ |
Для идентификации энтеробактерий по их способности утилизировать цитрат натрия в присутствии органического азота |
Дифференцирующие свойства |
S. sonnei «S-form»; |
1 бак. петля |
72 ч (37 ± 1) °С |
Рост микроорганизмов, утилизирующих цитрат (E. coli и Р. alcalifaciens), сопровождается изменением цвета среды с желтого на розово-красный. При росте микроорганизмов, не утилизирующих цитрат (S. sonnei), цвет среды не изменяется |
|||||||||||||||||||||||||||||||||||||||||||
|
E. coli Ewing 0124 K72 227; |
72 ч (37 ± 1) °C |
|||||||||||||||||||||||||||||||||||||||||||||||||
|
P. alcalifaciens 1068-50 |
24 ч (37 ± 1) °C |
|||||||||||||||||||||||||||||||||||||||||||||||||
|
Питательная среда для идентификации энтеробактерий, сухая (железо-глюкозолактозный агар, двухслойный) |
ПЛОТНАЯ |
Для первичной идентификации энтеробактерий по их способности ферментировать глюкозу и лактозу, образовывать сероводород и расщеплять мочевину (мочевину добавляют к среде ех tempore) |
Дифференцирующие свойства |
S. flexneri 1a 8516; Е. coli (O55:K59) 3912/41; Р. vulgaris НХ19222; С. freundii 58/57; S. typhi H-901 ГДР/ГИСК |
1 бак. петля |
20 - 24 ч (37 ± 1) °С |
При росте микроорганизмов, ферментирующих глюкозу, наблюдается пожелтение столбика среды (для некоторых культур, например шигелл и некоторых сальмонелл, возможно пожелтение «по уколу» или оранжевое окрашивание столбика). Газообразование сопровождается разрывами (появлением пузырьков) в столбике среды. В случае ферментации лактозы происходит пожелтение скошенной части среды. В случае образования сероводорода наблюдается почернение верхней части столбика. Расщепление мочевины (при добавлении ее ex tempore) сопровождается изменением в малиновый цвет всей среды или только скошенной ее части. При этом может наблюдаться маскировка ферментации глюкозы и лактозы. Глюкоза, лактоза, H2S, мочевина: S. flexneri: + - - -; Е. coli: + газ + - -; Р. vulgaris: + (маскируется) + (маскируется) + +; С. freundii: + (газ) + + -; S. typhi: + - + - |
|||||||||||||||||||||||||||||||||||||||||||
|
Питательная среда для родовой идентификации энтеробактерий, сухая (фенилаланин агар) |
ПЛОТНАЯ |
Для родовой идентификации энтеробактерий по способности дезаминировать фенилаланин |
Дифференцирующие свойства |
Р. vulgaris НХ 19222; Е. coli (O55:K59) 3912/41 |
1 бак. петля |
20 - 24 ч (37 ± 1) °С |
Внесение 2 - 3 капель 10 % FeCl3 на выросшую культуру микроорганизмов, дезаминирующих фенилаланин (Р. vulgaris), изменяет цвет среды с желтого на зеленый, не дезаминирующих (Е. coli) - не изменяет цвет среды |
|||||||||||||||||||||||||||||||||||||||||||
|
Питательная среда для идентификации энтеробактерий, сухая (среда Гисса) с: а/лактозой; б/глюкозой; в/сахарозой; г/мальтозой; д/маннитом |
ПЛОТНАЯ |
Для идентификации энтеробактерий по тесту ферментации одного из углеводов (лактозы, глюкозы, сахарозы, мальтозы) или многоатомного спирта маннита |
Дифференцирующие свойства |
S. flexneri 1a 8516; Е coli 3912/41 (O55:K59); S. dysenteriael 1362; P. vulgaris HX19222; K, pneumoniae 3534/51; S. typhi 65; S. aureus «Виотко» |
1 бак. петля из 10 ед. |
18 - 20 ч (37 ± 1) °С |
При росте микроорганизмов, ферментирующих углевод, наблюдается изменение цвета среды с розового на синий или голубой. Газообразование сопровождается появлением пузырьков в столбике среды или на ее поверхности. Рост микроорганизмов, не ферментирующих углевод, не изменяет цвет среды.
|
|||||||||||||||||||||||||||||||||||||||||||
|
Питательная среда для родовой идентификации энтеробактерий, сухая (малонат агар) |
ПЛОТНАЯ |
Для родовой идентификации энтеробактерий по тесту утилизации малоната натрия |
Дифференцирующие свойства |
E. aerogenes 3/43; K. pneumoniae 204; E. coli 3912/41 (O55:K59); P. inconstans 1035-49 |
1 бак. петля |
18 - 20 ч (37 ± 1) ° С |
Рост микроорганизмов, утилизирующих малонаг натрия (Е. aerogenes и K. pneumoniae), сопровождается изменением цвета среды с зеленого на синий. Рост микроорганизмов, не утилизирующих малонат натрия (Е. coli и Р. inconstans), не изменяет цвет среды |
|||||||||||||||||||||||||||||||||||||||||||
|
Питательная среда для родовой идентификации энтеробактерий, сухая (глюкозо-фосфатный бульон) |
ЖИДКАЯ |
Для родовой идентификации энтеробактерий по тесту с метиловым красными в реакции Фогеса-Проскауэра |
Дифференцирующие свойства |
E. coli 675; E. aerogenes 2531; |
1 бак. петля |
20 - 24 ч (37 ± 1) °С |
Рост микроорганизмов в виде диффузного помутнения. Проявление признака в последующем тесте с метиловым красным и реакции Фогеса-Проскауэра сопровождается изменением цвета среды из желтого в красный. Отсутствие признака в данных тестах не сопровождается изменением цвета среды
|
|||||||||||||||||||||||||||||||||||||||||||
|
H. alvei 1 |
20 - 24 ч (22 ± 1) °С |
|||||||||||||||||||||||||||||||||||||||||||||||||
|
Питательная среда для определения чувствительности микробов к антибиотикам, сухая (среда АГВ) |
ПЛОТНАЯ |
Для определения чувствительности микробов к антибиотикам |
Чувствительность микроорганизмов к антибиотикам |
E. coli ATCC 25922; S. aureus АТСС 25923; Р. aeruginosa АТСС 27853 |
10-1 |
18 - 20 ч (37 ± 1) °С |
Рост в виде газона с четкими зонами угнетения роста антибиотиками (амикацин, бензилпенициллин, ванкомицин, стрептомицин, гентамицин, тетрациклин, эритромицин, левомицетин, полимиксин-М) соответствующего диаметра |
|||||||||||||||||||||||||||||||||||||||||||
|
Питательная среда для определения чувствительности микроорганизмов к против микробным лекарственным средствам, сухая (Мюллера-Хинтон агар) |
ПЛОТНАЯ |
Для определения чувствительности микроорганизмов к противомикробным лекарственным средствам |
Чувствительность среды и стабильность основных биологических свойств микроорганизмов |
E. coli ATCC 25922, S. aureus АТСС 25923 Р. aeruginosa АТСС 27853 Е. faecalis АТСС 29212 |
10-1 |
18 - 20 ч (37 ± 1) °С |
Рост в виде изолированных колоний |
|||||||||||||||||||||||||||||||||||||||||||
|
Показатель чувствительности микроорганизмов к противомикробным лекарственным средствам |
10-1 |
Рост в виде газона с четкими зонами угнетения роста противомикробными лек. средствами (бензилпенициллин, карбенициллин, стрептомицин, доксициклин, гентамицин, левомицетин, спарфлоксацин, цефуроксим, ципрофлоксацин, эритромицин) соответствующего диаметра |
||||||||||||||||||||||||||||||||||||||||||||||||
|
Двухвалентные катионы (Ca2+Mg2+) |
Р. aeruginosa АТСС 27853 |
10-1 |
Рост в виде газона с черной зоной (16 - 21 мм) угнетения роста гентамицином (МПК 0,5 - 2,0 мкг) |
|||||||||||||||||||||||||||||||||||||||||||||||
|
Тимин и тимидин |
E. coli ATCC 25922, S. aureus АТСС 25923 |
Рост в виед газона с четкой зоной (> 20 мм) угнетения роста сульфометаксазолом (диск 300 мкг) |
||||||||||||||||||||||||||||||||||||||||||||||||
|
Питательная среда для идентификации синегнойной палочки, сухая |
ПЛОТНАЯ |
Для идентификации по признаку пигментообразования вида Р. aeruginosa |
Стабильность основных биологических свойств микроорганизмов |
Р. aeruginosa 165; Р. aeruginosa 5/Перкадзе; Р. aeruginosa 68; Р. aeruginosa 140; Р. aeruginosa 615 |
1 бак. петля из суспенз. (2 петли в 2 мл физ. р-ра) |
23 - 25 ч (37 ± 1) °С |
Рост тест-штаммов сопровождается образованием пигмента (пиоцианина) с окрашиванием среды в зеленый или сине-зеленый цвет |
|||||||||||||||||||||||||||||||||||||||||||
|
Питательная среда д ля выделения и культивирования коклюшного микроба, сухая (КУА) |
ПЛОТНАЯ |
Для выделения коклюшного микроба из инфицированного материала и культивирования штаммов |
Чувствительность среды и стабильность основных биологических свойств микроорганизмов |
В. pertussis № 649; 79; 39; 703; 688; 796; 143 |
10-6 и 10-6, разведенное в 4 раза |
70 - 72 ч (37 ± 1) °С |
Рост тест-штаммов в виде изолированных мелких выпуклых, гладких, круглых с розовыми краями, блестящих («жемчужины») колоний |
|||||||||||||||||||||||||||||||||||||||||||
|
Питательная среда для идентификации грибов вида Candida albicans, сухая (хламидоспор-агар) |
ПЛОТНАЯ |
Для идентификации грибов вида Candida albicans по тесту хламидоспорообразования |
Стабильность основных биологических свойств микроорганизмов |
С. albicans 610/1563; С. albicans 615/1708; С. tropicalis 151/1-017- АТСС-7347 |
1 бак. петля из суспенз. (2 бак. петли в 0,2 мл физ. р-ра) |
23 - 25 ч (27 ± 1) °С |
У С. albicans образование хламидоспор и отсутствие хламидоспор у С. tropicalis. Учет производится при микроскопировании посевов в проходящем свете при увеличении (×100 - ×200). На питательной среде по краям полосок посева выявляются специфические морфологические образования - хламидоспоры, которые четко дифференцируются от дрожжевых клеток правильно-округлой формой, двухконтурной оболочкой, зернистостью в центре, расположением чаще на конце нити псевдомицелия |
|||||||||||||||||||||||||||||||||||||||||||
|
Питательная среда для выделения стрептококков сухая* |
ЖИДКАЯ |
Для выделения стрептококков из крови и другого инфицированного материала |
Чувствительность среды и стабильность основных биологических свойств микроорганизмов |
S. pyogenes гр «А» № 682 S. agalactiae гр «В» O-90R |
10-6 |
24 - 48 ч (37 ± 1) °С |
Стрептококки серогруппы «А» дают рост в виде взвешенных частиц, придонного или придонно-пристеночного осадка с сохранением прозрачности самой среды; стрептококки группы «В» дают рост в виде придонного осадка с диффузным помутнением среды; стрептококки группы «Д» дают рост в виде вязкого слизистого осадка и диффузного помутнения среды |
|||||||||||||||||||||||||||||||||||||||||||
|
S. bovis гр. «Д» NCTC 8177 |
10-7 |
24 ч (37 ± 1) °С |
||||||||||||||||||||||||||||||||||||||||||||||||
|
*Для приготовления селективного варианта к готовой среде необходимо добавить ex tempore генцианвиолет. |
||||||||||||||||||||||||||||||||||||||||||||||||||
|
Питательная среда для идентификации коринебактерий по тесту расщепления цистина, сухая |
ПЛОТНАЯ |
Для идентификации коринебактерий по тесту расщепления цистина ферментом цистиназой |
Стабильность основных биологических свойств микроорганизмов |
С. diphtheriae mitis nontoxigenic 203 АГ; C. diphtheriae gravis 75; C. xerosis 1911; C. pseudodiphtheriticum «Соколов» |
1 бак. петля |
18 - 20 ч (37± 1) °C |
Почернение среды по ходу укола и образование облачка коричневого цвета в глубине столбика среды указывает на наличие фермента цистиназы (положительная реакция) (С. diphtheriae mitis nontoxigenic и С. diphtheriae gravis). При отрицательной реакции цвет среды не меняется (С. xerosis и С. pseudodiphtheriticum) |
|||||||||||||||||||||||||||||||||||||||||||
|
Питательная среда для выделения, дифференциации и количественного определения бактерий а моче электролитдефицитная, сухая (ЭДПА) |
ПЛОТНАЯ |
Для выделения и дифференциации микроорганизмов по признаку ферментации лактозы, определения степени бактериурии при исследовании мочи |
Чувствительность среды и стабильность основных биологических свойств микроорганизмов |
E. coli 3912/41 (O55:K59); S. typhimurium 79; P. mirabilis F-392; P. vulgaris HX19 |
10-6 |
17 - 21 ч (37 ± 1) °C |
Рост в виде изолированных колоний. Колонии Е. coli и Е. faecalis желтые, Р. mirabilis и Р. vulgaris прозрачные, голубые в О-форме без «роения», допускаются отдельные колонии в Н-форме («роение») |
|||||||||||||||||||||||||||||||||||||||||||
|
E. faecalis 775 |
10-5 |
|||||||||||||||||||||||||||||||||||||||||||||||||
|
Дифференцирующие свойства |
Смесь (1:1) E. coli 3912/41 и P. mirabilis F-392 |
10-6 |
Четкая дифференциация. Лактозоположительные микроорганизмы образуют колонии желтого цвета, лактозоотрицательные - прозрачные, голубые |
|||||||||||||||||||||||||||||||||||||||||||||||
|
Питательная среда для контроля стерильности, сухая (тиогликолевая среда) |
ПОЛУЖИДКАЯ |
Для контроля стерильности медицинских иммунобиологических препаратов (МИБП) с целью выявления возможной их контаминации аэробными и анаэробными бактериями и грибами |
Чувствительность среды и стабильность основных биологических свойств микроорганизмов |
A. faecalis 415 |
10-6, 10-7, 10-8 |
24 - 48 ч (34 - 35) °C |
Рост C. novyi 198 в виде отдельных шарообразных колоний через 24 ч и диффузного помутнения с выраженной прозрачной зоной в верхней части столбика через 48 ч, не менее чем в 2 пробирках из разведений 10-4, 10-5. Рост A. faecalis 415 в виде помутнения верхней части столбика среды, менее чем в 2-х пробирках из разведений 10-7, 10-8 |
|||||||||||||||||||||||||||||||||||||||||||
|
С. novyi 198 |
10-3, 10-4, 10-5 |
|||||||||||||||||||||||||||||||||||||||||||||||||
|
Нейтрализующие свойства (при предварительном внесении в каждую пробирку по 0,5 мл 0,01 %-го р-ра мертиолята) |
A. faecalis 415 |
10-6, 10-7, 10-8 |
5 суток 34 - 35 °С |
Рост не менее чем в 2 пробирках из разведения 10-7 |
||||||||||||||||||||||||||||||||||||||||||||||
|
Питательная среда для определения токсигенности дифтерийных микробов, сухая (среда ОТДМ, Коринетоксагар) |
ПЛОТНАЯ |
Для определения токсигенности дифтерийных микробов методом диффузной преципитации в студне среды |
Стабильность основных биологических свойств микроорганизмов |
С. diphtheriae gravis 75; С. diphtheriae mitis Сеньков; С. diphtheriae intermedius 619; С. diphtheriae gravis nontoxigenis 4895; C. diphtheriae mitis nontoxigenic 3689; C. diphtheriae intermedius nontoxigenic 7227 |
1 бак. петля |
22 - 24 ч (37 ± 1) °C |
Рост всех штаммов и образование линий преципитации токсигенными штаммами |
|||||||||||||||||||||||||||||||||||||||||||
|
Селективные накопительные среды |
||||||||||||||||||||||||||||||||||||||||||||||||||
|
Питательная среда для накопления сальмонелл, сухая (селенитовая среда Лейфсона) |
ЖИДКАЯ |
Для накопления сальмонелл при исследовании различного материала (испражнения, моча и др.) |
Показатель эффективности |
S. paratyphi В 506 |
10-6 |
6 ч (37 ± 1) °С |
Не менее чем в 5 раз |
Учет производят по количеству колоний, выросших на чашках со средой Эндо |
||||||||||||||||||||||||||||||||||||||||||
|
Показатель ингибиции |
Смесь (1:1) E. coli 3912/41 (O55:K59) + S. paratyphi В 506 |
10-5 |
Не менее чем в 1,5 раза |
|||||||||||||||||||||||||||||||||||||||||||||||
|
Питательный бульон для элективного накопления сальмонелл, сухой (МА-бульон) |
ЖИДКАЯ |
Для элективного накопления сальмонелл из различного инфицированного материала с последующим высевом на дифференциально-диагностические среды |
Показатель эффективности |
S. paratyphi В 506 |
10-6 |
20 - 24 ч (37 ± 1) °С |
Не менее чем в 10000 раз |
Учет производят по количеству колоний, выросших на чашках со средой Эндо |
||||||||||||||||||||||||||||||||||||||||||
|
Показатель ингибиции |
Смесь (1:1) E. coli 3912/41 (O55:K59) + S. paratyphi В 506 |
10-5 |
|
Не менее чем в 100 раз |
||||||||||||||||||||||||||||||||||||||||||||||
|
Транспортные среды |
||||||||||||||||||||||||||||||||||||||||||||||||||
|
Транспортная среда для различных микроорганизмов, полужидкая, готовая к применению (среда типа Эймса) |
ПОЛУЖИДКАЯ |
Транспортирование исследуемого биоматериала от момента его забора до посева при сохранении жизнеспособности и отсутствии размножения различных микроорганизмов, включая стрептококки, стафилококки, эшерихии, гемофильные бактерии, дрожжеподобные грибы |
Показатели жизнеспособности и стабильности основных биологических свойств микроорганизмов при задержке роста |
S. aureus 25923 Е. coli 25922 Н. influenzae 49247 S. pneumoniae 49619 |
10-5, 10-6 |
24 ч 18 - 25 °С |
Отсутствие размножения. Число колоний после 24 ч хранения не различается более чем на порядок. Типичный рост микроорганизмов при высеве на питательные агары |
|||||||||||||||||||||||||||||||||||||||||||
|
С. albicans 24433 |
10-4, 10-5 |
|||||||||||||||||||||||||||||||||||||||||||||||||
|
Питательная среда для кампилобактерий транспортная, сухая |
ПЛОТНАЯ |
Для хранения и транспортирования исследуемого материала при диагностике кампилобактериоза |
Показатели жизнеспособности при задержке роста и стабильности основных биологических свойств микроорганизмов |
С. jejuni СТС 11168 С. coli IIL24 |
10-5, 10-6 |
70 - 74 ч 2 - 8 °С |
Типичный рост на кровяном эритрит агаре. Число колоний после 74 ч хранения на транспортной среде ниже на один порядок |
|||||||||||||||||||||||||||||||||||||||||||
|
Неселективные основы и добавки |
||||||||||||||||||||||||||||||||||||||||||||||||||
|
Гидролизат казеина неглубокой степени расщепления ферментативный, сухой. Экстракт кормовых дрожжей для микробиологических питательных сред, сухой ЭКД) |
- |
Использование при изготовлении микробиологических питательных сред. Гидролизат казеина в качестве белковой основы. ЭКД в качестве ростового фактора (водорастворимые витамины труппы В, свободные аминокислоты) |
В составе тиогликолевой среды должен обеспечивать качество этой среды в отношении тест-штамма Clostridium novyi198 |
См. «Питательная среда для контроля стерильности, сухая (тиогликолевая среда)» |
||||||||||||||||||||||||||||||||||||||||||||||
|
Гидролизат казеина средней степени расщепления кислотный, сухой |
- |
Использование в качестве белковой основы при изготовлении питательных сред, применяемых для культивирования анаэробов с целью получения токсинов |
- |
- |
- |
- |
- |
|||||||||||||||||||||||||||||||||||||||||||
|
Основа бактериологических питательных сред, сухая (гидролизат мяса ферментативный - ГМФ), пептон для бактериологических питательных сред. сухой |
- |
В качестве питательной основы (по аналогии с пептоном) для приготовления бактериологических питательных сред при выделении, культивировании и идентификации различных микроорганизмов |
Препарат в количестве 15,0 г/л (ГМФ) и 10,0 г/л (пептон)в составе мясо-пептонного бульона и мясо-пептонного агара должен обеспечивать их качество |
См. «Питательный бульон для культивирования микроорганизмов (мясо-пептонный бульон)» и «Питательный агар для культивирования микроорганизмов (мясо-пептонный агар)» |
||||||||||||||||||||||||||||||||||||||||||||||
|
Кровь баранья дефибринированная для питательных сред, стерильная |
ЖИДКАЯ |
Для обогащения бактериологических питательных сред и определения гемолитической активности микроорганизмов |
Препарат в количестве 5 % в составе СПА должен обеспечивать типичный рост тест-штаммов |
S. aureus Wood-46 S. aureus № 5 S. pyogenes Dick-1 E. faecalis 7/62 |
10-6 |
22 - 24 ч (37 ± 1) °C |
Типичный рост |
|||||||||||||||||||||||||||||||||||||||||||
|
S. pneumoniae m3 № 3 |
10-5 |
40 - 48 ч (37 ± 1) °C |
||||||||||||||||||||||||||||||||||||||||||||||||
|
Сыворотка лошадиная нормальная для бактериологических питательных сред. |
ЖИДКАЯ |
Для добавления в бактериологические питательные среды, применяемые для культивирования микроорганизмов (коринебактерий, стрептококков и др.) |
В количестве 20 % в составе СПА pH = 7,6 должна обеспечивать рост и стабильность основных биологических свойств микроорганизмов |
C. diphtheriae mitis nontoxygenic 203-AГ; S. pyogenes Dick I |
10-6, 10-5 |
44 - 48 ч (37 ± 1) °С |
Типичный рост |
|||||||||||||||||||||||||||||||||||||||||||
|
Сыворотка лошадиная нормальная для культивирования микроорганизмов |
В составе среды ОТДМ не должна подавлять образование токсина токсигенными штаммами |
См. «Среда ОТДМ» |
||||||||||||||||||||||||||||||||||||||||||||||||
Приложение 3
Перечень организаций, на базе которых функционируют
специализированные коллекции ПБА I - IV групп
|
№ п/п |
Наименование организации, адрес |
Специализированные коллекции |
|
1 |
Российский научно-исследовательский противочумный институт «Микроб» 410601, г. Саратов, Университетская, 46, тел. 24-21-31 |
Государственная коллекция патогенных микроорганизмов I - II групп с функцией депонирования типовых, патентноспособных и авторских штаммов возбудителей бактериальной природы I - II и III - IV групп, содержащих фрагменты генома ПБА I - II групп |
|
2 |
Ставропольский научно-исследовательский противочумный институт 355106 г. Ставрополь, Советская 13/15, тел. 3-13-12 |
Коллекция сибиреязвенных и бруцеллезных микробов |
|
3 |
Иркутский научно-исследовательский противочумный институт 664047 г. Иркутск, Трилиссера, 78, тел. 23-00-60 |
Коллекция сибиреязвенных и бруцеллезных микробов |
|
4 |
Волгоградский научно-исследовательский противочумный институт 400087 г. Волгоград, ул. Голубинская, 7, тел. 37-37-74 |
Коллекция возбудителей грибковых заболеваний, вызываемых грибами II групп патогенности |
|
5 |
Научно-исследовательский институт эпидемиологии и микробиологии им. Н.Ф. Гамалеи РАМН 123098 г. Москва, ул. Гамалеи, 18, тел. 193-30-01, 190-44-80 |
Коллекция возбудителей боррелиоза, бруцеллеза, клостридиозов, коклюша, лептоспирозов, легионеллеза, микоплазмозов, риккетсиозов, туляремии и хламидиозов |
|
6 |
Национальный центр контроля - Государственный научно-исследовательский институт стандартизации и контроля медицинских биологических препаратов им. Л.А. Тарасевича 121002 г. Москва, Сивцев Вражек, 41, тел. 241-39-22 |
Государственная коллекция патогенных микроорганизмов III - IV групп с функцией депонирования. Центры по токсинам и производственным штаммам I - IV групп |
|
7 |
Центральный научно-исследовательский институт эпидемиологии 111123 г. Москва, ул. Новогиреевская 3а, тел. 176-02-19 |
Коллекции возбудителей менингита, сальмонеллезов, шигеллезов |
|
8 |
Научно-исследовательский институт микробиологии МО РФ 610024 Киров-24, Октябрьский проспект 121, тел. 62-37-10 |
Центр возбудителей бактериальных инфекций, используемых для разработки и оценки эффективности медицинских средств ПБЗ |