 | Информационная система |  |
МИНИСТЕРСТВО
ПРИРОДНЫХ РЕСУРСОВ
И ЭКОЛОГИИ
РОССИЙСКОЙ ФЕДЕРАЦИИ
Федеральная
служба по гидрометеорологии
и мониторингу окружающей среды (Росгидромет)
|
РЕКОМЕНДАЦИИ |
Р 52.24.701-2008 |
РЕКОМЕНДАЦИИ
МЕТОДИКА ОЦЕНКИ ЧАСТИЧНОЙ БУФЕРНОЙ
И ЧАСТИЧНОЙ МГНОВЕННОЙ БУФЕРНОЙ
ЕМКОСТИ ВОДНЫХ ОБЪЕКТОВ К ЗАЧИСЛЕНИЮ
Ростов-на-Дону
2008
Предисловие
1 РАЗРАБОТАНЫ Государственным учреждением «Гидрохимический институт» (ГУ «ГХИ») Росгидромета
2 РАЗРАБОТЧИК М.Г. Тарасов, канд. геол.-минер. наук
3 СОГЛАСОВАНЫ с УМЗА и ГУ «НПО «Тайфун» Росгидромета
4 УТВЕРЖДЕНЫ Заместителем Руководителя Росгидромета 25.08.2008 г.
5 ЗАРЕГИСТРИРОВАНЫ ЦМТР ГУ «НПО «Тайфун» за номером Р 52.24.701-2008 от 5.09.2008 г.
6 ВВЕДЕНЫ ВПЕРВЫЕ
СОДЕРЖАНИЕ
Введение
Антропогенное закисление окружающей среды, происходящее в течение последних десятилетий, приобрело глобальный (трансграничный) характер, что приводит к ухудшению состояния ряда природных оболочек Земли (био-, гидро-, литосфера, почвы). Наибольшее негативное воздействие данные процессы оказывают на речные и озерные системы в различных географо-климатических и геолого-структурных условиях. Закисление водных объектов характеризуется многообразием и сложностью протекающих процессов, влияющих на все компоненты водных экосистем (ионно-солевой состав водной толщи, взвешенные вещества, донные отложения, гидробионты).
Кислотные осадки изменяют геохимические циклы элементов как на водосборе, так и в водном объекте. Многочисленные исследования показывают, что закисление приводит к увеличению концентрации многих металлов (Al, Fe, Mn, Pb, Hg, Cd, Zn, Cu и др.) в водах и их уменьшению в поверхностных слоях донных отложений. Общей закономерностью поведения металлов является увеличение их содержания в природных водах и перераспределение в наиболее токсичную ионную форму.
Несмотря на тенденцию к снижению выбросов кислотообразующих веществ в развитых странах Европы и Северной Америки, проблема закисления природных вод в глобальном масштабе, остается чрезвычайно острой и в настоящее время.
В мировой практике в качестве критериев закисления вод используются различные показатели [1]: динамика рН, содержание SO42-, Al3+, щелочность, показатель кислотонейтрализующей способности (ANC в латинской транскрипции или КНС в русской), соотношение концентраций различных ионов и другие. Анализ существующих критериев закисления и обоснование необходимости разработки новых методов оценки буферной емкости природных вод к антропогенному закислению приведены в приложении А.
Р 52.24.701-2008
РЕКОМЕНДАЦИИ
МЕТОДИКА ОЦЕНКИ
ЧАСТИЧНОЙ БУФЕРНОЙ И
ЧАСТИЧНОЙ МГНОВЕННОЙ БУФЕРНОЙ ЕМКОСТИ
ВОДНЫХ ОБЪЕКТОВ К ЗАКИСЛЕНИЮ
Дата введения - 2009-01-01
1 Область применения
1.1 Настоящие рекомендации устанавливают метод определения и требования к порядку проведения определения частичной буферной емкости и частичной мгновенной буферной емкости (далее - буферная емкость)* водных объектов к антропогенному закислению в составе системы мониторинга состояния поверхностных водных объектов (ПВО).
___________
* При изложении общих требований для определения частичной буферной емкости и частичной мгновенной буферной емкости применяется их сокращенное название «буферная емкость».
1.2 Рекомендации предназначены для оперативно-производственных подразделений территориальных управлений по гидрометеорологии и мониторингу окружающей среды Росгидромета, осуществляющих организацию и проведение наблюдений за состоянием ПВО в рамках Государственной службы наблюдений России.
1.3 Настоящие рекомендации могут быть использованы в качестве методического пособия специалистами и практическими работниками других природоохранных организаций, осуществляющих наблюдения за загрязнением окружающей среды.
2 Нормативные ссылки
В настоящих рекомендациях использованы ссылки на следующие нормативные документы:
ГОСТ 12.1.005-88 ССБТ. Общие санитарно-гигиенические требования к воздуху рабочей зоны
ГОСТ 12.1.007-76 ССБТ. Вредные вещества. Классификация и общие требования безопасности
ГОСТ 17.1.5.04-81 Охрана природы. Гидросфера. Приборы и устройства для отбора, первичной обработки и хранения проб природных вод. Общие технические условия
ГОСТ 17.1.5.05-85 Охрана природы. Гидросфера. Общие требования к отбору проб поверхностных и морских вод, льда и атмосферных осадков
ГОСТ Р 51592-2000 Вода. Общие требования к отбору проб
Примечание - Ссылки на остальные нормативные и технические документы приведены в разделе 4.
3 Термины и определения
В настоящих рекомендациях применены следующие термины с соответствующими определениями:
3.1 полная буферная емкость водных объектов к закислению: Способность водной экосистемы к нейтрализации кислот за счет всех компонентов экосистемы (растворенные в воде и взвешенные вещества, донные отложения, гидробионты).
3.2 частичная буферная емкость водных объектов к закислению: Способность водной экосистемы к нейтрализации кислот за счет растворенного и взвешенного вещества в воде.
3.3 частичная мгновенная буферная емкость водных объектов к закислению: Способность водной экосистемы к нейтрализации кислот за счет взвешенного вещества в воде.
3.4 допустимое воздействие: Воздействие, в результате которого экосистема может вернуться в исходное состояние.
3.5 критическое воздействие: Воздействие, при котором прежде существующая экосистема преобразуется в менее продуктивную (упрощенную).
4 Средства измерений, вспомогательные устройства, реактивы, материалы
4.1 Средства измерений, вспомогательные устройства
При выполнении измерений применяют следующие средства измерений и другие вспомогательные устройства:
4.1.1 рН-метр или иономер любого типа с комплектом электродов для измерения рН (Экотест-2000, рН-150, рН-155, Анион-410 и др.).
4.1.2 Цилиндры мерные исполнения 1, 3 по ГОСТ 1770-74 вместимостью 100 см3 - 1 шт.
4.1.3 Колбы мерные 2-го класса точности исполнения 2, 2а по ГОСТ 1770-74 вместимостью 500 см3 - 2 шт.
4.1.4 Бюретки 2-го класса точности исполнения 1, 3 по ГОСТ 29251-91 вместимостью 25 см3 - 2 шт.
4.1.5 Пипетка с одной отметкой 2-го класса точности исполнения 2 по ГОСТ 29169-91 вместимостью 50 см3 - 1 шт.
4.1.6 Стаканы В-1, ТХС по ГОСТ 25336-82 вместимостью 100 см3 - 2 шт.
4.1.7 Магнитная мешалка ПЭ-6100 по ТУ-3615-009-23050963-98.
4.1.8 Палочка стеклянная по ГОСТ 27460-87.
4.1.9 Посуда стеклянная для хранения проб и растворов вместимостью 0,5 и 1,0 дм3.
4.1.10 Посуда полиэтиленовая (полипропиленовая) для хранения проб и растворов вместимостью 0,25 дм3 и 1,0 дм3.
4.1.11 Устройство для фильтрования проб с использованием мембранных фильтров. Прибор вакуумного фильтрования ПВФ-35 по ТУ-3616-001-32953279-97.
4.1.12 Насос вакуумный любого типа. Технические характеристики насоса НВМ-5: быстродействие - 5 м3/час, предоставляемый вакуум - 30 - 60 мм ртутного столба, мощность главного двигателя 150 - 200 Вт, напряжение питания 220 вольт.
Примечание - Допускается использование других типов средств измерений, вспомогательных устройств, в том числе импортных, с характеристиками не хуже, чем у приведенных в 4.1.
4.2 Реактивы и материалы
При выполнении измерений применяют следующие реактивы и материалы:
4.2.1 Кислота серная, стандарт-титр по ТУ 6-09-2540-72.
4.2.2 Вода дистиллированная по ГОСТ 6709-72.
4.2.3 Фильтры мембранные «Владипор МФАС-ОС-2», 0,45 мкм по ТУ 6-55-221-1-29-89 или другого типа, равноценные по характеристикам.
Примечание - Допускается использование реактивов, изготовленных по другой нормативной и технической документации, в том числе импортных, с квалификацией не ниже указанной в 4.2.
5 Метод измерений
Определение буферной емкости (КНС) водного объекта достигается титрованием пробы воды раствором серной кислоты до исчерпания КНС (резкого перегиба кривой титрования). Серная кислота выбрана потому, что является преобладающей в кислотных атмосферных осадках. Подробно определение буферной емкости водных объектов к закислению описано в приложении Б.
6 Требования безопасности, охраны окружающей среды
6.1 При выполнении определения буферной емкости водных объектов к антропогенному закислению в пробах природных вод соблюдают требования безопасности, установленные в национальных стандартах и соответствующих нормативных документах.
6.2 По степени воздействия на организм вредные вещества, используемые при выполнении измерений, относятся ко 2-му, 3-му классам опасности по ГОСТ 12.1.007.
6.3 Содержание используемых вредных веществ в воздухе рабочей зоны не должно превышать установленных предельно допустимых концентраций в соответствии с ГОСТ 12.1.005.
6.4 Вредно действующие вещества подлежат сбору и утилизации в соответствии с установленными правилами.
7 Требования к квалификации операторов
К выполнению измерений и обработке их результатов допускаются лица со средним профессиональным образованием, имеющие стаж работы в лаборатории не менее года и освоившие методику.
8 Условия выполнения измерений
При выполнении измерений в лаборатории должны быть соблюдены следующие условия:
- температура окружающего воздуха (22 ± 5) °С;
- атмосферное давление от 84,0 до 106,7 кПа (от 630 до 800 мм рт. ст.);
- влажность воздуха не более 80 % при 25 °С;
- напряжение в сети (220 ± 10) В;
- частота переменного тока в сети питания (50 ± 1) Гц.
9 Отбор и хранение проб
9.1 Отбор проб для определения буферной емкости водных объектов к закислению производят в соответствии с ГОСТ 17.1.5.05 и ГОСТ Р 51592. Оборудование для отбора проб должно соответствовать ГОСТ 17.1.5.04 и ГОСТ Р 51592. Пробы отбирают в склянки вместимостью 0,25 дм3, предварительно ополоснув их 2 - 3 раза отбираемой водой. Если требуется определять частичную мгновенную буферную емкость, пробу сразу после отбора фильтруют через мембранный фильтр с размером пор 0,45 мкм.
Мембранные фильтры перед употреблением очищают двух- трехкратным кипячением в течение 15 - 20 мин в 100 см3 деионированной воды. Чистые фильтры хранят в плотно закрытом бюксе. Первую порцию фильтрата отбрасывают. При необходимости определения частичной буферной емкости, отбирают нефильтрованную пробу.
9.2 Пробы воды не консервируют.
10 Подготовка к выполнению измерений
Перед выполнением измерения следует приготовить раствор серной кислоты.
Для приготовления раствора серной кислоты с молярной концентрацией количества вещества эквивалента (КВЭ) 0,02 моль/дм3 используют стандарт-титр (см. 4.2.1), который переносят в мерную колбу вместимостью 500 см3, растворяют в дистиллированной воде и доводят до метки. Затем пипеткой с одной отметкой отбирают 50 см3 полученного раствора, переносят его в мерную колбу вместимостью 500 см3 и доводят объем дистиллированной водой до метки. Хранят в стеклянной или полиэтиленовой герметичной посуде.
11 Выполнение измерений
11.1 Для определения частичной буферной емкости водного объекта из нефильтрованной пробы воды отбирают 50 см3, переносят в химический стакан и помещают его на магнитную мешалку. Пробу воды титруют раствором серной кислоты 0,02 моль/дм3 КВЭ при постоянном перемешивании (при включенной магнитной мешалке). После добавки кислоты определяется равновесная концентрация ионов водорода, т.е. рН-метром фиксируется значение рН. Как следует из экспериментальных данных, численное значение рН на приборе (равновесие) устанавливается в течение 2 - 10 мин (в зависимости от количества и минерального состава взвешенных веществ). Титрование ведется до критического уровня (когда КНС пробы воды будет исчерпана), после чего производят еще 4 - 5 добавок кислоты и снимают показания рН. Экспериментальные данные наносят на график зависимости численных значений рН от концентрации добавленной серной кислоты. Буферная емкость определяется на кривой титрования в точке резкого снижения значений рН (точка перегиба) и численно равна количеству поступившей в пробу кислоты (в ммоль/дм3 КВЭ), даже небольшое превышение которого приводит к резкому снижению рН пробы воды (см. приложение Б).
Данный метод рекомендуется для определения КНС всех водных объектов, особенно для южных рек с высокой мутностью, а также эвтрофных водных объектов. Частичная буферная емкость более полно отражает кислотонейтрализующую способность водного объекта и не требует проведения коррекции величины буферной емкости на содержание взвешенных веществ в воде.
11.2 Для определения частичной мгновенной буферной емкости водной экосистемы, взвешенные вещества отделяют фильтрованием пробы воды через мембранный фильтр с диаметром пор 0,45 мкм. Из фильтрованной воды отбирают 50 см3, переносят в химический стакан и помещают его на магнитную мешалку. Далее определение частичной мгновенной буферной емкости водной экосистемы проводится аналогично 11.1.
Этот метод может применяться для озер и равнинных рек, не испытывающих значительных сезонных колебаний КНС за счет изменения содержания взвешенных веществ. Определение частичной мгновенной буферной емкости водной экосистемы необходимо в том случае, когда необходимо сопоставить буферную емкость с ANC, определенную методом Хенриксена (см. приложение А).
11.3 Преимуществом предлагаемой методики оценки буферной емкости к антропогенному закислению является то, что нет необходимости определения всего компонентного состава растворенных неорганических и органических веществ воды, участвующих в нейтрализации сильной кислоты, а сама буферная емкость оценивается количеством кислоты, затраченной на достижение критического или допустимого значения рН. Данный метод является прямым, а не расчетным, как применяемый в мировой практике метод определения ANC, и не требует проведения коррекции на устранение доли элементов, поступающих в составе морских аэрозолей и введения поправок на присутствие в воде взвешенных веществ.
12 Обработка результатов
Результаты титрования пробы воды серной кислотой обрабатывают графоаналитическим методом. Строят график зависимости рН пробы от концентрации серной кислоты и по точке резкого снижения рН (в точке перегиба) устанавливают значение буферной емкости водного объекта в ммоль/дм3 (КВЭ) серной кислоты, пошедшей на титрование. По величине буферной емкости оценивают КНС пробы воды.
Приложение А
(справочное)
Критерии закисления природных вод, используемые в мировой практике
Критерии закисления природных вод, используемые в мировой практике различными исследователями включают следующие гидрохимические параметры: динамика рН, содержание SO42-, Al3+, щелочность, показатель ANC (КНС), соотношение концентраций различных ионов и другие. Анализ существующих критериев закисления приведен в работах [1] - [5] и др.
Низкие значения рН и высокие концентрации SO42- и Al3+ являются следствием антропогенного закисления водных объектов, но не могут служить мерой буферной емкости водных экосистем к антропогенному закислению.
Щелочность характеризует буферную емкость вод, не содержащих органических кислот, и обусловлена присутствием в воде гидрокарбонат-иона. Однако расчет буферной способности пресноводных экосистем только по щелочности будет не полным, так как кислото-нейтрализующей способностью обладают слабые ионы других неорганических и органических кислот, а также метаболиты гидробионтов, присутствующие практически повсеместно в поверхностных водах.
Симптомом закисления вод и признаком переходного состояния озер к закисленым могут служить соотношения ионов в эквивалентной форме - HCO3-/SO42-, SO42-/(Ca2+ + Mg2+), НСО3-/(Са2+ + Mg2+). Данные показатели наиболее информативны при изучении сезонной динамики и многолетнего тренда на одних и тех же объектах, поскольку эти параметры достаточно легко определяемые и по ним часто имеются длинные ряды наблюдений [1], однако они не могут служить оценкой буферной емкости пресноводных экосистем на данный момент времени.
Общепринятым критерием закисления вод в мировой практике является их показатель ANC, который отражает буферную способность вод, то есть способность водной системы к нейтрализации техногенных кислот. Данный метод предложен Хенриксеном и др. [2].
Показатель ANC находят двумя методами по формулам:
ANC1 = Ca2+ + Mg2+ + Na+ + K+ - SO42- - NO3-; (A.1)
ANC2 = HCO3- + An- - H+ - Aln+. (A.2)
При достоверном химическом определении всех составляющих химического состава вод и хорошем показателе баланса ионов значения ANC1 и ANC2 совпадают.
Содержание элементов представляют в эквивалентной форме и корректируется на устранение доли элементов, поступающих в составе морских аэрозолей по их отношению к хлор-иону. Принимается, что в природных водах, где преобладает атмосферное питание, хлориды имеют только морское происхождение, а другие ионы добавляются в пропорциях, соответствующих морским водам.
Концентрации основных ионов (например, кальция) с коррекцией на морские аэрозоли, поступающие в водные объекты, рассчитывают следующим образом:
Са2+* = Са2+ - 0,037[Cl-].
Аналогично рассчитывают и другие ионы.
Однако при проведении подобной коррекции возможна грубая ошибка, так как для многих рек существенен вклад подземных вод, привносящих ион хлора. Кроме того, определение всех компонентов воды, участвующих в нейтрализации сильных кислот (слабые анионы неорганических и органических кислот, гуминовые, фульвокислоты, полифенолы, аминокислоты, белки, полипептиды и др.), чрезвычайно трудоемко и практически невозможно, так как приведет к большим затратам времени и средств [6] и [7].
Недостатком всех существующих методов оценки буферной емкости водных объектов к закислению является и то, что они не учитывают кислотонейтрализующую способность взвешенных веществ. По литературным данным [8] для многих рек необходимо проводить коррекцию величины буферной емкости на присутствие в воде взвешенных веществ. Однако для каждого водного объекта такая поправка будет сугубо индивидуальной, и определить ее заранее, исходя из общих теоретических соображений, невозможно.
Поэтому при разработке предлагаемого метода принята известная предпосылка, что при изучении сложных и многофакторных процессов следует отдавать предпочтение моделированию перед расчетными аналитическими методами.
Приложение Б
(справочное)
Пример определения частичной буферной емкости реки Дон
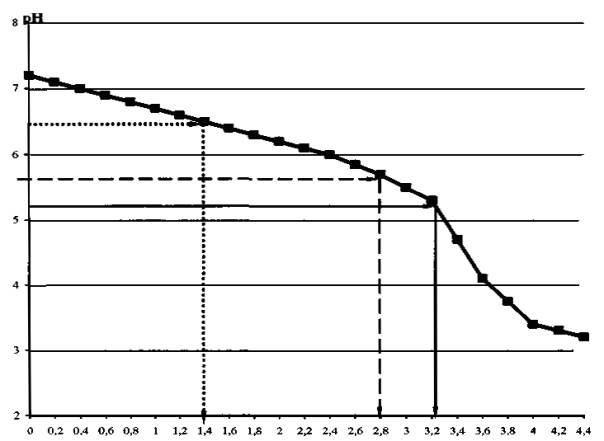
В качестве примера рассмотрим определение частичной буферной емкости реки Дон к антропогенному закислению. На основе полученных данных (таблица Б.1) строим график (рисунок Б.1) изменения значений рН воды в зависимости от концентрации добавленной в пробу серной кислоты.
Таблица Б.1 - Данные титрования серной кислотой пробы воды реки Дон
|
Добавки Н2SO4, ммоль/дм3 КВЭ |
Значения рН пробы воды |
|
0 |
7,2 |
|
0,2 |
7,1 |
|
0,4 |
7,0 |
|
0,6 |
6,9 |
|
0,8 |
6,8 |
|
1,0 |
6,7 |
|
1,2 |
6,6 |
|
1,4 |
6,5 |
|
1,6 |
6,4 |
|
1,8 |
6,3 |
|
2,0 |
6,2 |
|
2,2 |
6,1 |
|
2,4 |
6,0 |
|
2,6 |
5,85 |
|
2,8 |
5,7 |
|
3,0 |
5,5 |
|
3,2 |
5,3 |
|
3,4 |
4,7 |
|
3,6 |
4,1 |
|
3,8 |
3,75 |
|
4,0 |
3,4 |
|
4,2 |
3,3 |
|
4,4 |
3,2 |
Концентрация серной кислоты, ммоль/дм3 КВЭ
![]() соответствующая
определенной методом Хенриксена;
соответствующая
определенной методом Хенриксена;
![]() допустимое
значение;
допустимое
значение;
![]() критическое
значение.
критическое
значение.
Рисунок Б.1 - Определение частичной буферной емкости реки Дон
При оценке буферной емкости, отвечающей критической кислотной нагрузке на водный объект в целом, на графике определяется точка перегиба (резкое снижение рН при исчерпании ANC воды) и опускается перпендикуляр на ось абсцисс. В месте его пересечения с осью абсцисс снимается значение добавленной (нейтрализованной) серной кислоты (ммоль/дм3 КВЭ), отвечающее частичной мгновенной буферной емкости водной экосистемы. Это значение соответствует величине ANC, определенной методом Хенриксена [2].
На рисунке Б.1 проведение данной операции показано сплошной линией со стрелкой. Для реки Дон частичная мгновенная буферная емкость к антропогенному закислению, определенная предлагаемым методом, составляет 3,2 ммоль/дм3 КВЭ.
При оценке буферной емкости к закислению исследуемого водного объекта, определение точки перегиба на графике не обязательно. Можно оценить буферную емкость водного объекта, отвечающую допустимой и критической кислотным нагрузкам. Известно [3], что биологические эффекты закисления водоемов начинают проявляться уже при значении рН < 6,5. В озерах и ручьях уменьшается видовое разнообразие организмов, нарушаются пищевые цепи. Это значение рН является предельно допустимым для водного объекта в целом. По данным ряда исследователей [4], рН = 5,6 является предельным критическим значением, ниже которого могут возникать необратимые биологические последствия для водных экосистем. На рисунке Б.1 определение допустимой и критической буферной емкости показано штриховыми линиями со стрелками. В этом случае для реки Дон буферная емкость, отвечающая допустимому значению рН, составит 1,4 ммоль/дм3 КВЭ, критическому - 2,85 ммоль/дм3 КВЭ.
Большим преимуществом предлагаемого метода является то, что на этой же кривой можно легко определить буферную емкость водного объекта для случая, когда жестко заданы предельные значения рН. Например - буферную емкость, при превышении которой водные объекты переходят в разряд кислых (рН < 5,0) или к превышению ПДК питьевой воды по рН (рН < 5,5). В этом случае из заданного значения рН на оси ординат восстанавливается перпендикуляр до пересечения с кривой титрования и от точки пересечения опускается перпендикуляр до пересечения с осью абсцисс, в точке пересечения с осью абсцисс и снимаются значения буферной емкости.
Весьма перспективным является возможность определения «допустимой» и «критической» буферной емкости для какого-либо вида гидробионтов (например, для рыб, чувствительных к закислению). Так, при снижении рН менее 6,7 - 6,8 отмечается уменьшение численности популяции лосося, арктического гольца, форели, гольяна, плотвы (допустимое значение), а при рН < 6,0 - 5,8 отмечается массовая гибель рыб, и популяции этих видов рыб исчезают (критическое значение) [5]. Определение буферной емкости в данном случае проводится аналогично, как и для случая с жестко заданным значением рН.
Следует отметить, что для районов со слабой кислотонейтрализующей способностью водных объектов к антропогенному закислению как в нашей стране (Кольский полуостров, Карелия, север Западной Сибири, Забайкалье и др.), так и за рубежом для титрования проб воды следует использовать раствор серной кислоты 0,01 моль/дм3 КВЭ. Это необходимо для того, чтобы получить достаточное число точек и построить детальный график изменения рН воды в зависимости от добавок серной кислоты.
Библиография
[2] Henriksen A., Kamari I., Posch M., Wilander A. Critical loads of acidity: Nordic surface waters // AMBIO. 1992, Vol. 21, - P. 356 - 363.
[4] Ecological impact of acid precipitation. Proc. Intern. Conf. Sandfjord, Norway, 1980. - 383 p.
[6] Никаноров A.M., Тарасов М.Г. Устойчивость водных экосистем к закислению: экспериментальное моделирование и расчет буферной емкости // Экологическое нормирование и моделирование антропогенного воздействия на водные экосистемы. Вып. 2. - С.-Пб.: Гидрометеоиздат, 1999. - С. 239 - 269.
[7] Tarasov M.G. Nikanorov A.M. Aquatic ecosystem stability to acidification: experimental modeling and capacity calculation // Hydro-logical, Chemical and Biological Processes of Transformation and Transport of contaminants in Aquatic Enviroments. - IAHS publ. 1994. № 219. - P. 105 - 120.