| Информационная система |  |
ГОСУДАРСТВЕННЫЙ КОМИТЕТ РФ
ПО ОХРАНЕ ОКРУЖАЮЩЕЙ СРЕДЫ
«Утверждаю»
Заместитель Председателя
А.А. Соловьянов
23.10.1996 г.
МЕТОДЫ САНИТАРНО-БИОЛОГИЧЕСКОГО КОНТРОЛЯ
МЕТОДИЧЕСКОЕ РУКОВОДСТВО
ПО ГИДРОБИОЛОГИЧЕСКОМУ КОНТРОЛЮ
НИТЧАТЫХ МИКРООРГАНИЗМОВ АКТИВНОГО ИЛА
ПНД Ф СБ 14.1.92-96
Методическое руководство допущено для целей
государственного экологического контроля
Москва 1996
Методическое руководство рассмотрено и одобрено Главным управлением аналитического контроля и метрологического обеспечения природоохранной деятельности (ГУАК) при Госкомитете РФ по охране окружающей среды.
СОДЕРЖАНИЕ
НАЗНАЧЕНИЕ И ОБЛАСТЬ ПРИМЕНЕНИЯ
Настоящий документ устанавливает методику контроля сточных вод при развитии вспухания активного ила. Вспухание нарушает осаждаемость ила и приводит к избыточному выносу взвешенных веществ из вторичных отстойников, значительному ухудшению качества биологической очистки. Гидробиологический контроль состояния биоценоза активного ила в период вспухания имеет существенное значение для правильного определения его причин и разработки оперативных мероприятий по ликвидации с целью предотвращения загрязнения водоема, принимающего сточные воды.
1. Принцип методов прямого микроскопического учета нитчатых организмов
Наиболее часто вспухание возникает по причине чрезмерного развития нитчатых микроорганизмов, систематическая принадлежность которых определяется с помощью различных методов окрашивания.
Нитчатые микроорганизмы, присутствующие в активном иле, определяются путем предварительного окрашивания и прямого микроскопирования методом живой капли под покровным стеклом или в счетных камерах с помощью световой и фазовоконтрастной микроскопии.
Методы окрашивания основаны на способности микроорганизмов поглощать определенные красители, часть из которых активно люминесцирует, в результате чего микроорганизмы приобретают четкие очертания, выявляется наличие и форма трихом, строение оболочки, присутствие зерен волютина и устанавливается их родовая принадлежность.
На основании физиологических свойств определенных родов уточняются причины, вызвавшие вспухание ила, и разрабатываются методы борьбы, учитывающие экологические условия развития конкретных родов нитчатых микроорганизмов.
2. Средства измерений, вспомогательные устройства, материалы, реактивы для окрашивания нитчатых микроорганизмов
Средства измерений, вспомогательные устройства, материалы:
микроскоп люминесцентный серии «Люмам» ТУ 3-3-1320;
устройство фазово-контрастное (для малоконтрастных объектов) тип КФ-5, ТУ 3-3-1354;
винтовой окулярный микрометр ТУ 3-3-1211;
объект микрометр ГОСТ 7513;
весы лабораторные общего назначения ГОСТ 24104;
холодильник бытовой для хранения (+ 2 + 4 °С) и замораживания (- 20 °С) проб ила;
сушильный шкаф общелабораторного назначения ГОСТ 13474;
часы сигнальные ТУ 25-07-547-77;
оксиметр любого типа с ошибкой измерения не более 0,5 мг О2 / дм3;
рН-метр типа рН 155 ГОСТ 25.7416.0171 или аналоги;
ящики для переноски проб (облегченного типа) с гнездами и уплотнением для перевозки проб в машине;
спиртовая горелка;
штативы для окрашивания и сушки препаратов;
пинцет по Корнету (для окраски препаратов);
пробоотборник любого типа объемом 500 - 700 см3;
чашки Петри ГОСТ 25336;
предметные стекла для микропрепаратов ГОСТ 9284;
покровные стекла размером 18×18 мм, 24×24 мм ГОСТ 6672;
камера для счета форменных элементов крови по Горяеву, 0,1 мм глубины ТУ 42-816 (можно использовать другие модификации: камеры Кольвитца, Тома);
груши резиновые (разные);
иглы для препарирования;
пинцеты мягкие и жесткие;
лабораторные стаканы Н-2-100, В-2-100 ГОСТ 25336;
колбы мерные 2-25-2, 2-50-2, 2-100-2, 2-500-2, 2-1000-2 ГОСТ 1770;
пипетки стеклянные вместимостью 1, 2, 5 см3 2 класса точности ГОСТ 20292;
микропипетки 0,1 см3, 0,2 см3 ГОСТ 20292;
бумажные фильтры обеззоленные для количественного весового анализа типа ФОБ ТУ 6-09-1678 (красная, белая ленты);
вода дистиллированная ГОСТ 6709;
цилиндры мерные объемом 100, 1000 см3 ГОСТ 1770;
стаканчики для взвешивания (бюксы) ГОСТ 7148;
склянки и банки стеклянные с винтовым горлом, с прокладкой и крышкой или с притертой пробкой для отбора и хранения проб и реактивов вместимостью 250, 500 см3 ТУ 6-19-6-70;
флаконы и банки цилиндрические полиэтиленовые с навинчивающимися крышками для отбора и хранения проб и реактивов вместимостью 250, 500 см3 ТУ 6-19-45-74;
спирт этиловый 96° (этанол) х.ч. ТУ 6-091710;
формалин, 4 %-ный водный раствор ТУ 6-09-3011;
уксусная кислота х.ч. ГОСТ 61;
новокаин, 2 %-ный водный раствор.
Красители:
нейтральный красный индикатор ТУ 6-09-4120;
йод ч.д.а., 0,3 %-ный и 1 %-ный спиртовой растворы ГОСТ 4159;
акридиновый оранжевый гидрохлорид (акридиновый оранжевый) - витальный люминесцентный краситель ТУ 6-09-2604;
метиленовый голубой (синоним метиленовый синий) ч.д.а. ТУ 6-09-29;
кристаллический фиолетовый ч.д.а. ТУ 6-09-4119;
везувин [синонимы основной коричневый 4К, Бисмарк коричневый P(R)] ч.д.а. ТУ 6-09-4182;
хризоидин индикатор ч.д.а. ТУ 6-09-716;
карболовая кислота кристаллическая (синоним фенол) ч.д.а. ГОСТ 6417.
3. Требования к квалификации операторов
Гидробиологический анализ в соответствии с настоящей методикой выполняется гидробиологом, имеющим высшее образование, или химиком, получившим специальную квалификацию, овладевшим техникой микроскопирования и методикой определения организмов активного ила.
4. Условия выполнения гидробиологического анализа
Гидробиологический анализ производится в нормальных лабораторных условиях в соответствии с ГОСТ 15150.
Температура окружающего воздуха от 18 до 25 °С.
Относительная влажность воздуха 80 ± 5 %.
Атмосферное давление 84 - 106 кПа (630 - 800 мм рт. ст.).
При использовании осветителей микроскопов частота переменного тока 50 ± 1 Гц. Напряжение в сети 220 ± 10 В.
При выполнении гидробиологических анализов необходимо соблюдать требования техники безопасности при работе с химическими реактивами по ГОСТ 12.4.021, а также соблюдать антисептические меры предосторожности при работе с активным илом, который содержит потенциально патогенные организмы.
Электробезопасность при работе с электроустановками обеспечивается по ГОСТ 12.1.019, безопасность труда - по ГОСТ 12.0.004. Помещение гидробиологического отдела должно соответствовать требованиям пожарной безопасности по ГОСТ 12.1.004 и иметь средства пожаротушения по ГОСТ 12.4.009.
Работа гидробиологов имеет следующие профессиональные особенности:
соприкосновение с потенциально загрязненными материалами (сточные воды, активный ил);
напряжение зрения при микроскопировании;
возможность отравления ядовитыми веществами;
возможность повреждений при работах с некоторыми аппаратами (центрифугами).
Поэтому при биологических исследованиях следует соблюдать дополнительные меры предосторожности:
работать в спецодежде;
следить за состоянием кожи на лице и руках, раны и ссадины смазывать йодом;
не допускать разбрызгивания или попадания сточных вод на руки, поверхность стола, оборудование, одежду;
пользоваться резиновыми перчатками, тщательно убирать и вытирать рабочее место, дезинфицировать руки спиртом после работы;
своевременно мыть горячей водой с мылом бывшие в употреблении стеклянные предметы.
Меры против переутомления и порчи зрения при микроскопировании:
микроскопировать двумя глазами или попеременно то одним, то другим глазом, не закрывая неработающий глаз.
Меры против рассеивания потенциально заразного материала из лаборатории в окружающую среду:
фильтровальная бумага и вата, употребляющиеся в лаборатории при работе со сточными водами, должны перед утилизацией стерилизоваться в сушильном шкафу в специальной герметической посуде при температуре 105 °С в течение 1 часа.
5. Подготовка к выполнению анализа
Предварительная подготовка к отбору проб должна обеспечивать полную безопасность работ, подготовку посуды, пробоотборников, места хранения отобранных проб, а также рабочего места для обработки доставленных в лабораторию проб.
5.1. Подготовка посуды, предметных и покровных стекол
Посуду, предназначенную для проб и гидробиологического анализа, тщательно моют синтетическим моющим средством, промывают водопроводной водой, обрабатывают смесью бихромата калия и серной кислоты (хромовой смесью), промывают водопроводной водой, затем 3 - 4 раза - дистиллированной водой. Посуду для отбора проб сушат на воздухе, а используемую для гидробиологического анализа, за исключением мерной, стерилизуют 1 час в сушильном шкафу при 160 °С. Посуда должна быть пронумерована несмываемой краской или карандашом по стеклу.
Счетные камеры, стандартные предметные и покровные стекла перед употреблением необходимо обезжирить, для чего используют один из предлагаемых способов:
а). Стекла погружают, в концентрированную серную кислоту и выдерживают одни сутки, после чего их тщательно промывают водопроводной водой, ополаскивают дистиллированной, заливают 96° этиловым спиртом и хранят в нем или в сухом виде до употребления.
б). Стекла погружают в хромовую смесь на 2 - 3 суток, затем тщательно промывают водопроводной водой и ополаскивают дистиллированной, сушат. Хранят в сухом виде или в этиловом спирте.
в). Стекла после иммерсионного масла на 3 - 5 суток погружают в концентрированный раствор кальцинированной соды, затем тщательно промывают водопроводной водой, ополаскивают дистиллированной и 96° спиртом.
Покровные стекла, не бывшие в употреблении, обрабатывают смесью равных частей спирта и эфира (смесь Никифорова), такой же смесью следует регулярно обрабатывать открытые оптические части микроскопа. Перед употреблением покровные и предметные стекла вытирают мягким полотенцем.
Химически чистая посуда для гидробиологического анализа должна храниться с закрытыми стеклянными пробками или завинчивающимися крышками в таре, защищенной от пыли: ящиках лабораторного стола или закрытых полках, стеллажах и т.п.
5.2. Отбор и хранение проб
Гидробиологическое исследование активного ила гидробиолог очистных сооружений проводит 1 раз в декаду. В период развития вспухания ила или угрозы его возникновения - ежедневно.
Проба иловой смеси в аэротенках - вытеснителях отбирается в сборных каналах аэротенков или на водосливах, т.е. перед поступлением на отстаивание во вторичные отстойники; в конце аэротенков - 0,5 - 1,5 м от перелива с противоположной стороны от зоны подачи воздуха (только в случае безопасного прохода). Если безопасные условия для отбора не обеспечены, пробы отбирают со стороны фильтросных пластин. В аэротенках - смесителях пробы отбираются в сборных каналах. Пробы необходимо отбирать из мест интенсивного перемешивания иловой смеси.
Для получения репрезентативных данных о состоянии флокулообразования активного ила, его седиментационных свойств, получения точных количественных характеристик нитчатых организмов необходимо, чтобы такие показатели, как концентрация активного ила по объему и весу, иловой индекс, прозрачность надиловой воды, подсчет индикаторных организмов активного ила выполнялись в одной пробе (см. ПНД Ф СБ 14.1.77-96 «Методическое руководство по гидробиологическому и бактериологическому контролю процесса биологической очистки на сооружениях с аэротенками»).
Для отбора проб используют ковш объемом 500 см3, который предварительно погружают в воду на 3 мин, чтобы его температура сравнялась с температурой воды. Приготовленную посуду для отбора проб вначале ополаскивают отобранной иловой смесью, затем отбирают пробу с глубины 0,5 м. Иловую смесь переливают в стеклянную бутыль объемом 3 дм3 так, чтобы все содержимое ковша было вылито. Отбор повторяют до тех пор, пока не наберется 2,8 - 2,9 дм3 иловой смеси. Отобранная проба снабжается этикеткой, на которой указывается дата, место отбора. Бутыль не закупоривают и немедленно доставляют в лабораторию, где ее содержимое тщательно перемешивается и разливается следующим образом:
а). 1 дм3 - в литровый мерный цилиндр, калиброванный от самого дна для определения дозы ила по объему;
б). 1,5 дм3 - в склянку для отстаивания и определения прозрачности надиловой воды;
в). 100 см3 - в цилиндр объемом 100 см3 для определения дозы ила по весу;
г). 100 см3 - в стакан для гидробиологического анализа и хранения.
При взятии проб измеряют температуру воды. Для этого используют термометры с делением 0,1 °С. Для определения температуры на месте взятия пробы 1 дм3 воды наливают в склянку, нижнюю часть термометра погружают в воду и через 5 мин снимают показания, держа его вместе со склянкой на уровне глаз. Точность определения ± 0,5 °С.
Время от отбора пробы до ее анализа необходимо сократить до минимума, к гидробиологическому анализу следует приступать не позднее 30 - 40 мин с момента взятия пробы, после того как температура смеси активного ила сравняется с температурой помещения. При невозможности проведения анализа в указанный срок пробы активного ила отбирают в бутыли, заполняя их на 2/3 объема, при транспортировке постоянно встряхивают, охлаждают до + 4 °С. Хранить пробы следует не более 24 часов после отбора при температуре 3 - 4 °С. Консервация проб не допускается.
Вся грязная посуда после отбора проб и проведения анализов должна подвергаться стерилизации кипячением в течение 1 часа.
6. Техника микроскопирования
Гидробиологический анализ активного ила выполняется поэтапно в соответствии с требованиями, изложенными в ПНД Ф СБ 14.1.1.77-96.
При специфическом исследовании на развитие в активном иле нитчатых микроорганизмов дополнительно выполняются следующие этапы:
а). окрашивание нитчатых микроорганизмов;
б). определение их размеров;
в). определение родовой принадлежности;
г). количественный учет нитчатых микроорганизмов.
Для выяснения основных причин, вызывающих вспухание ила, и разработки мероприятий, его подавляющих, необходимо правильно определить хотя бы родовую принадлежность чрезмерно развившихся нитчатых микроорганизмов.
Использование техники выращивания нитчатых микроорганизмов на селективных средах представляется достаточно сложной и долговременной процедурой.
Наилучшим методом исследования остается прямое микроскопирование с применением метода фазового контраста при увеличении не менее 100х с использованием различных методик окрашивания.
6.1. Фиксация и окрашивание акридиновым оранжевым нитчатых микроорганизмов активного ила
Нитчатые микроорганизмы способны к скользящему движению, что может оказывать мешающее влияние на результаты количественного счета. В этом случае для фиксации лучше использовать этанол (1 - 2 капли у покровного стекла) или формалин 4 - 10 %-ный водный раствор.
Окрашивание препаратов активного ила производится в пробах без фиксаторов и консервантов. Для прижизненного окрашивания оболочек нитчатых микроорганизмов при выявлении их трихомного строения применяют витальный люминесцентный краситель акридиновый оранжевый. Для исследования окрашенных бактерий используется люминесцентный микроскоп. Раствор акридинового оранжевого готовится непосредственно перед окрашиванием (не хранится): к стерильной дистиллированной воде объемом 10 см3 добавляется 3 мг акридинового оранжевого, затем в 100 см3 тщательно перемешанной иловой смеси вносится 1 см3 приготовленного раствора. Следует обращать внимание на опасность перекрашивания препаратов при избытке красителя, поскольку избыточное свечение препарата в этом случае затрудняет счет нитчатых микроорганизмов. Техника окрашивания занимает 10 - 12 мин.
Акридиновый оранжевый хорошо окрашивает оболочку нитчатых микроорганизмов и четко выявляет форму и расположение трихом.
6.2. Техника приготовления мазков активного ила
Для определения родовой, а в некоторых случаях и видовой принадлежности нитчатых микроорганизмов, кроме прижизненного окрашивания акридиновым оранжевым, применяют стандартную технику окрашивания бактерий. Для этого делают мазок, высушивают, фиксируют его и затем окрашивают.
Для приготовления тонкого мазка необходимо хорошо обезжирить предметные стекла (раздел 5.1). Иловая смесь тщательно перемешивается, микропипеткой отбирается объем не более 0,01 см3 и наносится на предметное стекло. Бактериологической петлей круговыми движениями иловая смесь распределяется равномерным слоем в виде круга диаметром в 10-рублевую монету. Правильно приготовленный мазок имеет одинаковую толщину на всем своем протяжении. В том случае, если чрезмерное количество нитчатых микроорганизмов мешает приготовлению мазка с их равномерным распределением и небольшой плотностью, необходимо перед приготовлением мазка разбавить иловую смесь отфильтрованной надиловой водой.
Приготовленный таким образом мазок высушивают 30 - 40 мин на воздухе и после полного высыхания фиксируют. Фиксирование необходимо для закрепления организмов на стекле, чтобы они не смывались при последующей окраске и промывании препарата. Для фиксации предметное стекло берут пинцетом (мазком верх) и 2 - 3 раза проводят над верхней частью пламени горелки. Непосредственному воздействию огня мазок подвергается не более 2 секунд. После этого он окрашивается.
6.3. Техника окрашивания по методу Грама
Окраска по Граму основывается на неодинаковом отношении микроорганизмов к красителям трифенилметановой группы: генцианвиолету, метилвиолету, кристалвиолету. Нитчатые микроорганизмы, входящие в группу положительных по Граму, например, Nocardia sp., Microthrix parvicella, дают прочное соединение с указанными красителями и йодом. Окрашенные нитчатые не обесцвечиваются при воздействии на них спиртом, вследствие чего при дополнительной окраске фуксином положительные по Граму нитчатые микроорганизмы не изменяют первоначально принятый фиолетовый цвет. Отрицательные по Граму микроорганизмы (Sphaerotilus natans, тип 021N и др.) образуют с генцианвиолетом, кристалвиолетом или метилвиолетом и йодом соединение, легко разрушающееся под действием спирта, в результате чего они обесцвечиваются и затем окрашиваются фуксином, приобретая красный цвет.
Отношение микроорганизмов к окрашиванию по Граму имеет основное диагностическое значение при определении нитчатых микроорганизмов.
Дополнение к разделу 6.3. Техника окрашивания по методу Грама
Окрашивание по Граму может дать неправильные или неожиданные результаты, что связано с:
а) использованием недоброкачественных красителей;
б) приготовлением слишком толстого мазка и затруднением обесцвечивания.
6.3.1. Предварительная подготовка необходимых растворов
Раствор № 1: кристалвиолет - карболовый раствор. Состав:
кристаллический фиолетовый - 1 г;
карболовая кислота кристаллическая - 2 г;
спирт этиловый 96° - 10 см3;
вода дистиллированная - 100 см3.
Приготовление: 2 г карболовой кислоты растирают в фарфоровой ступке и прибавляют небольшими порциями спирт во время растирания. После того, как состав хорошо разотрется, приливают при постоянном помешивании 100 см3 дистиллированной воды. Раствор краски фильтруют через предварительно смоченный дистиллированной водой бумажный фильтр «белая лента». После фильтрации добавляют 1 г кристаллического фиолетового. Раствор хранится не более 3 месяцев. Доброкачественность окраски нитчатых микроорганизмов устанавливается при микроскопическом исследовании.
Раствор № 2 - фуксин-спирто-водный раствор готовится из фуксин насыщенного спиртового раствора (8 г основного фуксина, растворенного в 100 см3 этилового 96° спирта), для чего 1 см3 насыщенного раствора разбавляют в 10 см3 дистиллированной воды.
Окраску по Граму производят следующим образом:
а). Мазок, фиксированный на огне, окрашивают через фильтровальную бумагу основным красителем - раствором основного карболового кристалвиолета (раствор № 1). Прокрашивание длится 1 - 2 минуты.
б). Снимают бумагу, сливают избыток краски и, не промывая препарата водой, наливают раствор Люголя (см. раздел 2) на 1 - 2 минуты до почернения препарата.
в). Раствор Люголя сливают. Предметное стекло для обесцвечивания мазка погружают несколько раз в стаканчик со спиртом. Процесс обесцвечивания считается завершенным, когда от мазка перестают отделяться струйки жидкости, окрашенные в фиолетовый цвет.
г). Препарат тщательно промывают водопроводной водой.
д). Докрашивают спиртоводным раствором фуксина (раствор № 2) 2 минуты.
ж). Промывают водой, высушивают, микроскопируют.
Оценка результатов окраски: положительные по Граму нитчатые микроорганизмы окрашиваются основной краской в темно-фиолетовый цвет; отрицательные по Граму, воспринимая дополнительную окраску, приобретают ярко-малиновый цвет.
Окрашивание по Граму может дать неправильные или неожиданные результаты, что связано с:
а) использованием недоброкачественных красителей;
б) приготовлением слишком толстого мазка и затруднением обесцвечивания.
Дополнение к разделу 6.3.1. Предварительная подготовка необходимых растворов
Раствор Люголя (Lugol). Состав:
кристаллический йод - 1,0 г;
йодистый калий - 2,0 г;
дистиллированная вода - 300 см3.
Приготовление раствора Люголя. Йодистый калий растворяют в 5 - 10 см3 холодной дистиллированной воды, затем прибавляют кристаллический йод, оставляют на сутки до полного растворения йода и после этого приливают остальное количество воды.
Если не удается добиться хороших результатов окрашивания, можно использовать более концентрированный раствор йода по Бурке вместо раствора Люголя (техника окрашивания используется та же).
Раствор йода по Бурке. Состав:
йодистый калий - 2,0 г;
йод - 1,0 г;
дистиллированная вода - 100 см3.
Приготовление раствора йода по Бурке. В ступке растереть пестиком 2,0 г йодистого калия и 1,0 г йода. При растирании добавлять дистиллированную воду по 2 - 5 см3. После тщательного растирания промыть пестик и ступку, вылить в склянку и довести объем красителя до 100 см3 остатками дистиллированной воды.
6.4. Техника окрашивания по методу Нейссера
Окраску нитчатых микроорганизмов по способу Нейссера производят для обнаружения включений гранул полифосфатов в виде зерен волютина.
Предварительная подготовка синьки Нейссера. Готовят отдельно два основных раствора.
Раствор № 1. Состав:
метиленовая синь - 0,1 г;
этиловый спирт 96° - 2 см3;
ледяная уксусная кислота - 5 см3;
дистиллированная вода - 100 см3.
Раствор № 2. Состав:
кристалвиолет - 1 г;
этиловый спирт 96° - 10 см3;
дистиллированная вода - 300 см3.
Для окраски зерен волютина непосредственно перед окраской смешивают 2 части первого раствора с 1 частью второго.
Окраску по Нейссеру проводят в следующей последовательности:
а). Фиксированный на пламени горелки мазок окрашивают 1 - 2 минуты синькой Нейссера.
б). Синьку сливают, на препарат наносят на 1 минуту несколько капель раствора Люголя.
в). Мазок промывают водой, подсушивают фильтровальной бумагой.
г). Докрашивают 2 - 3 минуты раствором хризоидина или везувина.
д). Промывают водой, подсушивают и микроскопируют.
Зерна волютина окрашиваются в темно-синий цвет, тела микробных клеток - в светло-коричневый до светло-желтого цвета. Реакция по Нейссеру положительная, если зерна обнаруживаются, отрицательная - не обнаруживаются.
Дополнение к разделу 6.4. Техника окрашивания по методу Нейссера
Водный раствор красителя хризоидина. Состав:
хризоидин (сухой порошок) - 1,0 г;
дистиллированная вода - 150 см3.
Приготовление водного раствора хризоидина. В воронку на бумажный фильтр (красная, белая ленты) насыпают 1,0 г хризоидина и выливают на него 150 см3 кипящей дистиллированной воды, полностью растворяя порошок. После охлаждения краситель готов к употреблению.
Спиртовой раствор красителя
Везувина. Состав:
Везувин (сухой порошок) - 2,0 г;
спирт этиловый 96° - 60 см3;
дистиллированная вода - 40 см3.
Приготовление спиртового раствора красителя Везувина. 2,0 г Везувина высыпают во флакон, заливают спиртом и ставят на 24 ч в термостат при 37 °С, периодически взбалтывая. К полученному спиртовому раствору добавляют 40 см3 кипящей дистиллированной воды, перемешивают и фильтруют через бумажный фильтр (белая, красная ленты).
6.5. Окрашивание нитчатых микроорганизмов для обнаружения чехольчатого строения
Фиксированный мазок окрашивают 1 - 2 минуты 0,1 %-ным спиртоводным раствором кристалвиолета, для приготовления которого 1 см3 насыщенного спиртового раствора разбавляют в 10 см3 дистиллированной воды. Состав кристалвиолета насыщенного раствора:
кристаллический фиолетовый - 10 г;
спирт этиловый - 100 см3.
6.6. Измерение размеров нитчатых микроорганизмов
Измерение размеров нитчатых микроорганизмов производят с помощью окуляр-микрометра по масштабной линейке объект-микрометра. Пользуясь окуляр-микрометром, помещают на столик микроскопа объект-микрометр и, достигнув резкости (сильно затемняют), сравнивают число делений окуляр микрометра с таковыми на линейке объект-микрометра при данном увеличении и вычисляют цену деления окуляр-микрометра (абсолютное значение одного деления окуляр-микрометра), затем измеряют нитчатые организмы (диаметр, длина клеток) при непосредственном наблюдении под микроскопом. При изменении увеличения вновь вычисляют цену деления окуляр-микрометра.
7. Методы количественного учета нитчатых микроорганизмов
Для учета нитчатых микроорганизмов применяется метод определения абсолютного количества микроорганизмов в единице объема иловой смеси (с пересчетом на сухой вес активного ила), в результате находят абсолютную частоту встречаемости нитчатых микроорганизмов в активном иле.
Точных результатов можно достичь, используя счетные камеры Горяева, Кольквитца, Нажотта и других. Камеру накрывают покровным стеклом и притирают его до образования радужных колец интерференции, что является признаком достаточно плотно притертого стекла. Пипеткой отбирают произвольное количество тщательно перемешанной иловой смеси и наносят ее капли на нижний и верхний край покровного стекла, заполняя камеру так, чтобы не попадали в нее пузырьки воздуха; избыток иловой смеси вытесняется по канавкам камеры. Просматриваются все квадраты по диагонали или камера целиком (если численность организмов незначительная). Подсчет производят под микроскопом МБИ или МБР при увеличении в 100 и 200 раз.
В каждой пробе подсчитываются нитчатые как минимум в 3-х камерах с последующим вычислением среднего арифметического. Пересчет численности микроорганизмов проводится по формуле:
![]() (1)
(1)
где N - численность, экз/см3;
п - численность микроорганизмов, найденных в секторе сетки камеры, экз;
S - площадь сектора сетки, мм2;
h - глубина счетной камеры, мм;
1000 - коэффициент пересчета мм3 в см3.
После чего численность подсчитанных организмов в 1 см3 необходимо пересчитать на грамм сухого вещества активного ила.
При отсутствии счетных камер можно пользоваться методом «откалиброванной капли». Для этого микропипеткой отбирают 0,1 см3 тщательно перемешанной иловой смеси, наносят каплю на предметное стекло и покрывают покровным стеклом размером 24×24 мм. Необходимо просмотреть не менее 3-х таких препаратов. В каждом препарате по диагонали просматривают 10 полей зрения (увеличение 10х). После подсчета количества нитчатых в 30 полях зрения (10 под тремя стеклами) находят среднее арифметическое для 1 поля зрения. Количество в 1 см3 определяется по формуле:
![]() (2)
(2)
где D - количество микроорганизмов, экз/см3;
d - количество микроорганизмов в одном поле зрения (среднее арифметическое из числа просмотренных полей зрения), экз;
πr2 - площадь поля зрения объектива (r определяется по линейке объект-микрометра), мм2;
S - площадь покровного стекла, мм2 (24×24);
V - объем взятой капли, см3.
Если подсчитывается капля иловой смеси целиком (все поля зрения), то рассчитывается специфическая плотность ρ найденных микроорганизмов, тыс. экз/г ила, по формуле:
где п - численность нитчатых микроорганизмов, экз:
а - доза ила по весу, г/дм3;
V - объем взятой капли равный 0,1 см3.
При чрезмерном накоплении нитчатых микроорганизмов подсчитать их в капле 0,1 см3 достаточно трудно, поэтому можно применить или разбавление ила (подсчет в капле 0,1 см3 и пересчет с учетом разбавления пробы), или использовать для счета каплю объемом 0,01 см3.
Для этого используется увеличение 100х. На предметное стекло микропипеткой наносится калиброванная капля (объем 0,01 см3) иловой смеси, предварительно хорошо перемешанной, и покрывается покровным стеклом размером 9×9 мм (такой размер стекол получаем путем разрезания стандартного стекла 18×18 мм на четыре части). Препарат укрепляется в препаратоводителе. Начиная от левого верхнего угла покровного стекла просматривается весь препарат, осторожно перемещаемый слева направо до конца, затем на одно поле зрения вниз и справа налево. Необходимо внимательно следить за тем, чтобы ни одно поле зрения не было пропущено. Полученные результаты следует разделить на дозу ила в г/дм3 и на просчитанный объем в см3.
Например, на 1 этапе обнаружено 27 нитчатых микроорганизмов, доза ила - 2 г/дм3, просчитана капля 0,01 см3, значит согласно формуле (3):
27 : 2 : 0,01 = 1350 тыс. экз/г.
Так определяется специфическая плотность микроорганизмов, выраженная в тысячах экземпляров на 1 г сухого вещества активного ила.
Нормы погрешности измерений (для всех перечисленных методов):
при численности нитчатых микроорганизмов до 10 тыс. единиц включительно в пересчете на 1 г сухой массы активного ила δ = ± 25 %;
при численности нитчатых микроорганизмов от 10 тыс. до 30 тыс. единиц включительно в пересчете на 1 г сухой массы активного ила δ = ± 45 %.
8. Систематика нитчатых микроорганизмов
Для правильной диагностики причин вспухания ила необходимо определить систематическую принадлежность вызвавших его нитчатых организмов. Определение до вида нитчатых бактерий предполагает высев активного ила на культурные среды и исследование чистой культуры. Однако применение такой сложной методики, как правило, не требуется - достаточно определить родовую принадлежность организмов.
При определении нитчатых микроорганизмов до рода следует учитывать следующие основные признаки:
форму нитчатых (прямая, изогнутая, закрученная);
размер нитей (диаметр 1 - 60 мкм, длина разнообразна: от 30 мкм до нескольких мм);
Краткий определитель нитчатых микроорганизмов [адаптировано по Jenkins et al. (1984), Eikelboom (1975)]

форму и размер клеток внутри нитей (квадратные, круглые, разные по длине);
ветвление нитей истинное у грибов и актиномицетов (Nocardia) и ложное у бактерий (Sphaerotilus natans);
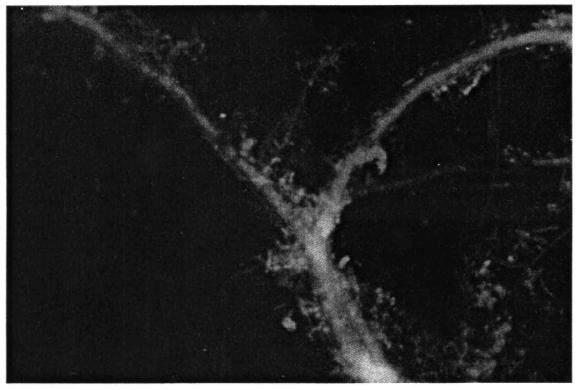
подвижность нитей, их скольжение (Beggiatoa движется, скользя передним концом или петлеобразно, фото 6);
наличие чехла;
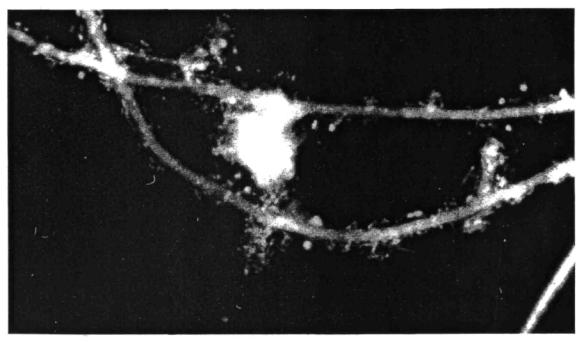
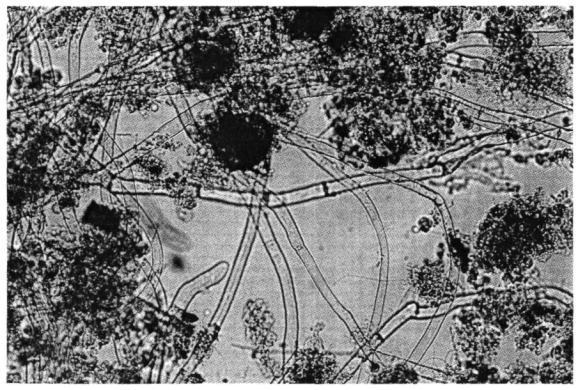
наличие клеток гетеротрофной микрофлоры на поверхности нитчатых микроорганизмов (Sphaerotilus natans, фото 7);
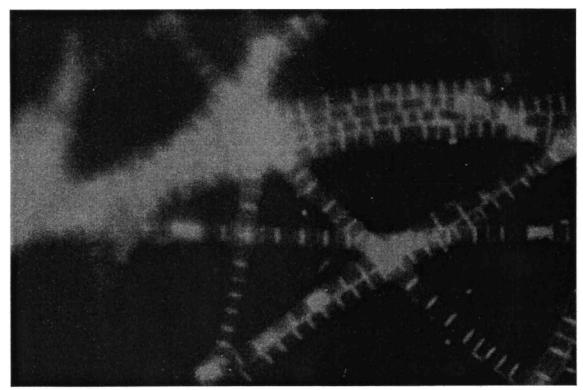
присутствие гранул серы (Beggiatoa, Thiothrix, тип O21N, фото 8, 9);
отношение к окрашиванию по Граму, что зависит от химического состава стенок клеток бактерий;
отношение к окрашиванию по Нейссеру, которое позволяет обнаружить гранулы полифосфатов.
На схеме 1 представлен краткий определитель нитчатых организмов, составленный на основе перечисленных систематических признаков.
9. Нарушение седиментационных свойств активного ила. Виды вспухания
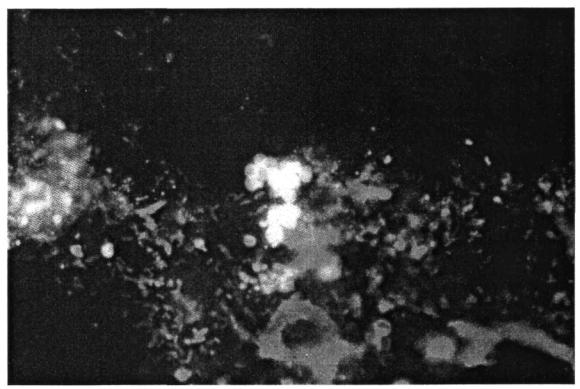
В нормально функционирующем активном иле хлопья компактные (фото 1), удовлетворительно оседающие; после 30-минутного отстаивания в 1000 см3 цилиндре иловая смесь занимает минимальный объем, который не превышает более чем в 40 раз объем его твердых компонентов. Состояние ила и его седиментационные свойства характеризуются иловым индексом. Иловой индекс - это объем, занимаемый одним граммом активного ила за 30 минут отстаивания в литровом цилиндре. В активном иле с пониженными значениями индекса повышена доля зольных, более тяжелых элементов из-за высокой минерализации клеточного вещества или из-за присутствия тяжелых взвесей. Такой ил может давать недостаточный прирост биомассы, излишне переуплотняется во вторичных отстойниках. Нарушение процесса разделения ила от очищенной воды и его избыточный вынос из вторичных отстойников обусловлены возрастанием величины илового индекса.
В зависимости от технических возможностей обеспечения удовлетворительного осаждения и своевременной выгрузки осевшего ила из вторичных отстойников для каждого конкретного сооружения биологической очистки оптимальными будут свои, определенные значения илового индекса. Для удовлетворительной эксплуатации очистных сооружений принятые значения илового индекса составляют от 80 до 120 см3/г, диапазон допустимых отклонений - от 60 до 150 см3/г. Увеличение илового индекса выше допустимых значений, т.е. более 150 см3/г, называется вспуханием активного ила.
Вспухание - это изменение состояния биоценоза активного ила в неблагоприятных экологических условиях обитания, характеризующееся увеличением объема ила и нарушением его седиментационных свойств.
По характеру изменений, происходящих в активном иле, вспухание подразделяется на два основных типа:
а). Гелевое (ненитчатое) - развивается вследствие чрезмерного (избыточного) продуцирования экзополимерного геля гетеротрофными сапрофитными бактериями активного ила в ответ на присутствие в сточных водах трудноокисляемых или биологически неокисляемых веществ промышленного происхождения.
б). Нитчатое (фото 2) - развивается вследствие резкого увеличения численности нитчатых форм организмов (хламидобактерий, сапрофитных грибов, цианобактерий). Увеличение выноса взвешенных веществ из вторичных отстойников, в результате накопления нитчатых микроорганизмов в активном иле, составляет от 30 до 400 % от нормы. Степень выноса зависит от интенсивности вспухания и конструктивных особенностей вторичных отстойников.
9.1. Гелевое вспухание ила
Клетки сапрофитных бактерий активного ила при контакте с загрязняющими веществами сточных вод окружают себя слоем слизисто-тягучего полимерного геля (вязкого коллоидного раствора). Объем выделяемого полимерного геля распределяется вокруг клеток и хлопьев активного ила, защищая их от неблагоприятного воздействия сточных вод, участвуя в флокуляции (слипании) хлопьев между собой, и играет доминирующую роль в процессе сорбции загрязняющих веществ и их трансформации внутрь микробных клеток. Биополимерный гель активного ила имеет высокий молекулярный вес (более 10000), по своему химическому составу чаще всего представлен аминокислотами и полисахаридами, включающими глюкозу, галактозу, аминосахар. В состав полимерного геля кроме гликопротеинов (сложных комплексов Сахаров и белков) входят также экзоферменты клеток ила, полипептиды, клетчатка и др. К полисахаридпродуцирующим бактериям активного ила относятся роды Zoogloea, Pseudomonas, Aeromonas, Acinetobacter, Micrococcus, Paracoccus.
Изъятие активным илом легкоокисляемых органических веществ из сточных вод происходит с высокой скоростью путем обычной диффузии этих веществ через полупроницаемые мембраны клеток микроорганизмов. Сложные трудноокисляемые органические вещества способны проникнуть внутрь бактериальной клетки только после их предварительного гидролиза или присоединения вещества к специфическому белку (экзоферменту), выделяемому клетками ила в составе экзополимерного геля. Чем сложнее состав загрязняющих веществ, присутствующих в сточной воде, тем большее количество разнообразных ферментов выделяется клетками ила, селективно воздействующих на различные виды органических загрязняющих веществ, тем интенсивнее происходит гелеобразование хлопьями ила.
В тех случаях, когда трудноокисляемых органических веществ в очищаемых сточных водах присутствует слишком много или они вообще не могут быть ферментативно окислены, активный ил выделяет избыточное количество экзоферментов для налаживания механизма разложения этих веществ. В результате между бактериальными клетками ила накапливается избыточное количество коллоидного рыхлого вещества, которое значительно увеличивает общий объем хлопьев ила. При этом общий объем иловой массы превышает объем твердых компонентов в 40 - 200 и более раз. Развивается гелевое вспухание ила.
При нормально протекающем процессе биологической очистки выделение полимерного геля бактериями ила повышается (но не чрезмерно) при увеличении времени аэрации за счет продления третьей стадии биологической очистки, стадии эндогенного питания и синтеза бактериальной массы, а также на стадии регенерации ила. Если загрязняющие вещества промышленного происхождения, присутствующие в сточных водах, не только трудноокисляемые, но еще и токсичные, процесс гелеобразования нарушается, хлопья ила диспергируются, ухудшается их осаждаемость, компактность и флокуляция.
Гелевое вспухание легко диагностируется при микроскопировании активного ила, если его вызывают бактерии рода Zoogloea. Развитие вспухания, вызываемое Zoogloea ramigera, было зарегистрировано еще в 1958 г. Н.А. Базякиной, которая связала его возникновение с недостатком растворенного кислорода в иловой смеси. При преобладании других родов гелеобразующих бактерий установить вспухание можно только по ухудшению седиментации ила при отстаивании в цилиндре. Специфической особенностью такого ила является: бедное видовое разнообразие; пониженные окислительные свойства и высокая степень кислородопоглощения; прозрачность хлопьев. Нитчатые бактерии в таком иле присутствуют в незначительном количестве или отсутствуют полностью.
Высокая кислородопоглощаемость активного ила при развитии гелевого вспухания сопровождается пониженными значениями содержания растворенного кислорода в иловой смеси (иногда на фоне удовлетворительной подачи воздуха в аэротенки). Это обусловлено тем, что значительная часть подаваемого кислорода воздуха расходуется на хемоокисление трудноокисляемых загрязняющих веществ, которые, в свою очередь, блокируют дыхательные ферменты организмов активного ила, повышая их потребности в содержании кислорода.
Дефицит кислорода является не первопричиной гелевого вспухания ила, а только следствием механизма действия токсикантов на активный ил.
9.2. Нитчатое вспухание ила
Нитчатое вспухание ила возникает при чрезмерном развитии и накоплении организмов с нитчатой структурой.
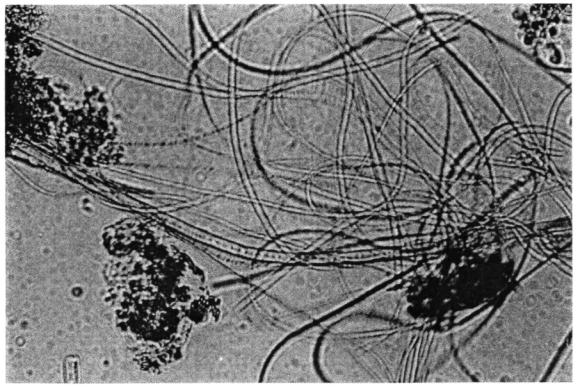
Следует отметить, что вспухший ил, хотя и плохо осаждается, но чистит очень эффективно. Нитчатые образования создают рыхлые (фото 3, 4) открытые хлопья с развитой поверхностью и высокой окислительной способностью. При исследовании вспухшего ила в лабораторном цилиндре легко заметить, что надиловая вода, как правило, очень чистая и прозрачная. Однако, отсутствие надежных конструкций вторичных отстойников, обеспечивающих отделение вспухшего ила от очищенной воды, не позволяет воспользоваться свойством нитчатых организмов хорошо очищать сточные воды.
Вспухание ила вызывают около 30 видов нитчатых организмов. Наиболее распространенные из них представлены в табл. 1. Эти организмы, в основном, являются представителями трех таксономических групп: бактерий, водорослей, грибов. Вспухание вызывают хламидобактерии рода Sphaerotilus, Thiothrix, Beggiatoa, нитчатые синезеленые водоросли и сапрофитные грибы.
Чаще всего встречается вспухание ила, обусловленное развитием хламидобактерий (представители родов Sphaerotilus, Beggiatoa, Thiothrix, тип 021N и т.д.). Это наиболее распространенные нитчатые микроорганизмы, которые занимают пищевую нишу гелеобразующей сапрофитной микрофлоры в биоценозе активного ила, когда она гибнет или повреждается под воздействием неблагоприятных факторов (недостаток кислорода, наличие токсических веществ, высокие концентрации легкоокисляемых органических загрязняющих веществ).
Нитчатые микроорганизмы, наиболее часто вызывающие вспухание ила (в порядке убывания распространенности)
|
Наименование таксонов |
|
|
1 |
Sphaerotilus natans (фото 7) |
|
2 |
тип 021N (фото 5) |
|
3 |
Thiothrix sp. (фото 8) |
|
4 |
Beggiatoa |
|
5 |
Microthrix parvicella |
|
6 |
тип 1701 |
|
7 |
тип 0041 |
|
8 |
Nocardia sp. |
|
9 |
Fungi (фото 10) |
|
10 |
Cyanophyta |
Хламидобактерии характеризуются трихомным строением отдельных особей. Трихомы представляют собой нить, составленную из отдельных клеток, находящихся в таком тесном контакте друг с другом, что отдельные клетки трихомов редко индивидуализируются как самостоятельные организмы (фото 5). Скользящие, подвижные Thiothrix и Beggiatoa различаются толщиной нитей, сегментацией и расположением в них гранул серы. Серобактерии способны окислять минеральные соединения серы, обладают устойчивостью к воздействию токсичных веществ и недостатку кислорода. При движении наблюдается характерный изгиб клетки в форме дуги и движение вперед изогнутой частью (фото 6).
Нитчатые бактерии рода Sphaerotilus наиболее часто, но в незначительном количестве встречаются в обычном активном иле. Неподвижные трихомы Sphaerotilus natans образуют подвижные одноклеточные гонидии, снабженные пучком жгутиков. Нити Sphaerotilus natans одеты слизистым чехлом (фото 7), имеют ложное ветвление (более редкое в условиях обилия легко усвояемых органических веществ и более частое при их низкой концентрации) (Разумов, 1957). По всей длине нити клетка Sphaerotilus natans равного диаметра.
Синезеленые водоросли Cyanophyta, вследствие способности переходить к фотосинтезу, сходному с бактериальным, высокой устойчивости к воздействию неблагоприятных факторов (температура, щелочность среды, токсиканты и т.д.) могут достигать значительной численности в активном иле аэротенков и вызывать вспухание; они же, как правило, вызывают «цветение» водоемов. Нитчатое трихомное строение тела, способность к скользящему движению, отсутствие настоящих ядер, хлоропластов и вакуолей, заполненных клеточным соком, у Cyanophyta настолько морфологически объединяет их с нитчатыми хламидобактериями, что при микроскопическом исследовании их зачастую трудно разделить. Обособляет Cyanophyta от бактерий только наличие оксигенного фотосинтеза и значительная устойчивость к токсикантам, что позволяет им развиваться в условиях непригодных для бактерий. При микроскопическом исследовании можно обнаружить у водорослей газовые вакуоли и врастание внутренних слоев многослойной оболочки внутрь клетки при ее делении. Трудно отделить от рода Sphaerotilus гормогониевые водоросли Tolypothrix. Наиболее часто вызывают вспухание синезеленые водоросли родов Anabaena, Aphanizomenon, Microcystis.
Сапрофитные грибы способны вызывать вспухание активного ила из-за нитчатого строения таллома (фото 11), однако такое вспухание встречается достаточно редко, поскольку обусловлено специфическими причинами, редко присутствующими на сооружениях биологической очистки (см. раздел 10).
10. Причины, вызывающие вспухание активного ила, и основные факторы, способствующие его развитию
Преобладающий рост нитчатых организмов в активном иле происходит в соответствии с принципами конкуренции видов смешанной популяции с высокой плотностью населения. Концентрация микроорганизмов в 1 см3 иловой смеси достигает 1010 - 1011 клеток, что значительно превышает биомассу организмов в природных средах. Хлопья активного ила представляют собой сложные микробные ассоциации, внутри которых складываются разнообразные взаимоотношения, включая конкурентные и антагонистические. Характер конкурентных отношений у бактерий ила различных систематических групп на фоне изобилия пищи и подаваемого кислорода определяется биологическими особенностями микроорганизмов при постоянной смене экологических условий обитания (нагрузки на активный ил, наличие токсикантов и т.д.).
В удовлетворительных экологических условиях, а также при незначительном воздействии неблагоприятных факторов в биоценозе активного ила преимущественное развитие получают гетеротрофные сапрофитные бактерии. Присущая им более высокая скорость размножения и потребления субстрата (табл. 2) позволяет конкурентно вытеснять и ингибировать развитие нитчатых организмов, плотность которых понижается до минимальных значений. В нормально функционирующем иле нитчатые не имеют преобладающего роста, хотя постоянно присутствуют в нем (Eikelboom, 1982; Eikelboorn, Buijsen, 1981; Sezgin et al., 1978). Такая бактериостатическая форма пассивного антагонизма между сапрофитными и нитчатыми организмами активного ила является двусторонней, поскольку они поочередно вытесняют друг друга при смене условий обитания. Условия, угнетающие рост гетеротрофных флокулообразующих сапрофитных бактерий, приводят к их вытеснению и доминированию нитчатых бактерий, более устойчивых к воздействию неблагоприятных факторов. К условиям, способствующим развитию нитчатого вспухания следует, в первую очередь, отнести высокие нагрузки на активный ил, наличие токсикантов в очищаемых сточных водах, их подкисление и дисбаланс питательных веществ.
Развитие вспухания, заключающееся в чрезмерном накоплении нитчатых организмов, - это адаптация биоценоза активного ила к неблагоприятным условиям. Таким образом, в биореакторах непрерывно происходит самопроизвольная селекция организмов ила, формирующая рост, накопление отдельных групп, наиболее приспособленных к конкретным экологическим условиям. Интенсивность селекции зависит от физиологических характеристик отдельных групп организмов. К основным таким характеристикам можно отнести: 1) специфическую скорость размножения, 2) скорость поглощения субстрата, 3) способность к накоплению и сохранению субстрата и продуктов метаболизма, 4) устойчивость к недостатку растворенного кислорода и токсикантам (табл. 2).
Характерными физиологическими особенностями хламидобактерий являются: медленное потребление субстрата и поэтому толерантность к высоким содержаниям растворенных органических загрязняющих веществ в окружающей среде; более высокий уровень метаболизма и устойчивости к воздействию токсикантов (способность быстро выводить токсины) в сравнении с гетеротрофной микрофлорой. Устойчивость к токсикантам особенно выражена у серобактерий. При воздействии токсикантов нарушается флокуляция хлопьев ила и повреждается система образования полисахаридного геля клетками гетеротрофных бактерий, что усугубляет диспергирование хлопьев и повышает возможность доступа токсикантов непосредственно к бактериальным клеткам. В свою очередь, развитие нитчатых бактерий также приводит к нарушению компактности хлопьев ила, что обусловлено способностью гетеротрофной микрофлоры флокулировать вокруг нитей хламидобактерий (фото 3, 4). Кроме того, для нитчатых бактерий характерны тонкие нити диаметром 1 - 60 мкм, поэтому они снабжаются растворенным кислородом лучше, чем бактерии в флокулах ила диаметром от 100 до 400 мкм (Chudoba, 1985). Эта особенность позволяет хламидобактериям успешно конкурировать с гетеротрофной микрофлорой в условиях дефицита растворенного кислорода.
Таблица 2
Основные различия в физиологических характеристиках сапрофитной гелеобразующей микрофлоры и хламидобактерий активного ила*
* Таблица приведена с изменениями по исследованию Sykes J.С. The use of biological selector technology to minimize sludge bulking. In: Biological nitrogen and phosphorus Removal: The Florida Experience. 1989. TREEO Center, University of Florida.
|
Сапрофитные бактерии |
Хламидобактерий |
|
|
Скорость потребления субстрата |
высокая |
низкая |
|
Специфическая скорость размножения |
высокая |
низкая |
|
Эндогенная скорость разложения субстрата (на стадии эндогенного питания с помощью ферментов) |
высокая |
низкая |
|
Снижение специфической скорости размножения в низкоконцентрированных субстратах |
значительное |
умеренное |
|
Устойчивость к голоданию |
низкая |
высокая |
|
Снижение специфической скорости размножения при низких концентрациях растворенного кислорода |
значительное |
умеренное |
|
Способность интенсивно сорбировать органические вещества в среде с избыточным их содержанием |
высокая |
низкая |
|
Способность использовать нитраты как акцептор электронов |
да |
нет |
|
Обильное потребление фосфора, потребность в его достаточном содержании |
да |
нет |
Несмотря на схожие физиологические характеристики всех родов хламидобактерий, указанные в табл. 2, каждый род имеет свои специфические особенности и определенную устойчивость к воздействию разнообразных факторов. Поэтому при доминировании какого-либо фактора возникает вспухание, вызываемое определенным родом хламидобактерий, наиболее приспособленных к конкретным экологическим условиям, что позволяет при определении рода доминирующих нитчатых организмов уточнить причины вспухания и разработать мероприятия по его подавлению.
Способность биоценоза активного ила освобождаться от высоких концентраций легкоокисляемых органических веществ в сточных водах обусловлена активностью нитчатых бактерий рода Sphaerotilus, их бурным ростом. Основная причина чрезмерного развития хламидобактерий рода Sphaerotilus в активном иле - это поступающие на очистку сточные воды, содержащие высококонцентрированные смеси органических загрязняющих веществ при коротком времени контакта их с активным илом, последующий дисбаланс между сорбцией загрязняющих веществ и их окислением биотой ила (Houtmeyers, 1978; Chudoba et al., 1982; Jenkins, 1984).
Этот вид нитчатого вспухания, первый по распространенности, вызываемый хламидобактериями рода Sphaerotilus и возникающий по причине повышенного содержания легкоокисляемых загрязняющих веществ в сточных водах, которые активный ил адсорбирует, но окислить не успевает, наиболее распространен на сооружениях, очищающих сточные воды пищевой, консервной промышленности, пивоваренных и сахарных заводов.
Органические вещества, поступающие в аэротенки, первоначально адсорбируются на поверхности иловых частиц, преобразуются экзоферментами, после чего трансформируются в клетку (Busby, Andrews, 1975; Dold et al., 1980). Адсорбция загрязняющих веществ, как правило, занимает меньше времени, чем их окисление. В течение первых 0,5 - 2 часов контакта большинства растворенных органических загрязняющих веществ с активным илом происходит сорбция примесей активной биомассой. Однако на их окисление требуется значительное время, которого часто недостаточно, поскольку ил находится в аэротенках только 3 - 8 часов. В системах с регенераторами вспухание ила встречается реже из-за улучшения условий для окисления загрязняющих веществ. На фоне перегрузки активного ила по легкоокисляемым загрязняющим веществам и нарушения баланса между их сорбцией и окислением в иловой смеси возникает дефицит кислорода.
Потребление кислорода идет со скоростью, соответствующей высокой степени изъятия субстрата в начальный период сорбции загрязняющих веществ. Затем устанавливается равновесие между скоростью потребления кислорода и скоростью окисления субстрата, что соответствует завершению биоразложения биомассой сорбированного субстрата. Если такого равновесия не наступает, угнетаются гетеротрофные микроорганизмы и их экологическую нишу занимают хламидобактерии аэробы, которым свойственна низкая скорость сорбции и потребления субстрата, а также устойчивость к недостатку кислорода (Sezgin et al., 1978).
Второй по распространенности вид нитчатого вспухания, также вызываемый хламидобактериями, но уже серобактериями родов Thiothrix, Beggiatoa, типом O21N и др., возникает при воздействии токсичных веществ, действие которых не ограничивается только снижением ферментативной активности ила, нарушением процессов продуцирования экзополимерного геля и флокуляции хлопьев ила, но и сопровождается накоплением в иле устойчивых к токсикантам хламидобактерий или, еще более толерантных, синезеленых водорослей (Cyanophyta).
Третий вид вспухания провоцируется составом сточных вод, дисбалансированных по элементам питания для активного ила.
Недостаток азота и фосфора замедляет рост сапрофитных бактерий и способствует массовому развитию нитчатых организмов с низкими потребностями к содержанию биогенных веществ в питательном субстрате. Такое вспухание ила сопровождается снижением его окислительной способности и сокращением прироста ила, следовательно, увеличением удельных нагрузок на него. Для предупреждения голодания ила по причине недостатка биогенных веществ следует обращать внимание на работу первичных отстойников, содержание взвешенных веществ в выходящей из них воде не должно быть менее 100 мг/дм3. А также не должны значительно изыматься лег-коокисляемые вещества в преаэраторах, биокоагуляторах и т.д., т.е. в сооружениях, устанавливаемых до аэротенков.
В тех случаях, когда избыточный ил подается в «голову» сооружений, дисбаланс питания для активного ила вызывается тем, что ил, направляемый в первичные отстойники, потребляет наиболее легко окисляемую органику на стадии первичного отстаивания, в результате сточная вода поступает в аэротенки с изъятой наиболее ценной для питания частью органических загрязнений, что также вызывает бурное развитие в иле аэротенков нитчатых хламидобактерий, устойчивых к недостатку легкоразлагаемой органики в сточных водах. Подача избыточного активного ила в первичные отстойники - достаточно распространенная схема эксплуатации сооружений биологической очистки. Ее использование обусловлено тем, что активный ил - хороший коагулянт и существенно улучшает эффект первичного осветления сточных вод. Кроме того, совместное уплотнение сырого осадка и избыточного ила дает возможность сократить общий объем осадков за счет уменьшения влажности смеси осадков. Однако, при практическом использовании этого метода в подавляющем большинстве случаев наблюдается нарушение процесса очистки по всем звеньям сооружений, поскольку избыточного ила подается в первичные отстойники значительно больше (в норме не более 20 % от общего количества), а в результате осадок загнивает, увеличивается вынос взвешенных веществ из первичных отстойников, в аэротенках развивается вспухание ила и, следовательно, нарушается работа вторичных отстойников.
При подаче избыточного активного ила в первичные отстойники следует учитывать, что эта схема применима только в случае наличия высококонцентрированных сточных вод, поступающих на очистку и их неудовлетворительного осветления. Необходимый объем избыточного ила, направляемого в первичные отстойники, должен быть определен на основании экспериментальных данных. Для сокращения общего объема осадков более эффективно использовать отдельно стоящие уплотнители смеси сырого осадка и избыточного ила.
При хроническом вспухании активного ила следует отказаться от подачи избыточного ила в первичные отстойники для обеспечения удовлетворительной работы очистных сооружений.
Четвертый вид нитчатого вспухания связан со способностью серобактерий окислять соединения серы и накапливать их в виде капелек внутри клеток. Нитчатые формы бесцветных серобактерий родов Beggiatoa, Thiothrix часто чрезмерно развиваются в сточных водах, содержащих восстановленные соединения серы и серосодержащие органические вещества.
Пятый вид нитчатого вспухания, сапрофитно-грибковое (фото 11), развивается в кислых сточных водах (при рН меньше 5,0), возможно также развитие грибкового вспухания при недостатке азота как элемента питания активного ила. Основные причины нитчатого вспухания приведены в табл. 3.
Причины, вызывающие нитчатое вспухание активного ила
|
Сопутствующие факторы |
|
|
1. Высокие нагрузки на активный ил |
1. Недостаток аэробности в аэротенках |
|
2. Недостаток питательных веществ в сточных водах (азот, фосфор) |
2. Отсутствие или недостаточная регенерация ила |
|
3. Токсичные сточные воды |
3. Недостаточный возраст активного ила |
|
4. Сточные воды с рН менее 5,0 |
4. Отсутствие режима вытеснения сточных вод в аэротенках-смесителях |
|
5. Серосодержащие сточные воды |
|
11. Индикаторная оценка процесса биологической очистки в условиях вспухания активного ила
Вспухание активного ила может быть острым и хроническим. Если причины, вызывающие вспухание, действуют непродолжительно, это приводит к острому вспуханию, которое характеризуется внезапным началом, быстрым подъемом, интенсивным, но коротким развитием.
Хроническое вспухание протекает при невысокой интенсивности действия вызывающих его неблагоприятных факторов, долго длится или часто повторяется, что приводит к вырождению биоценоза, постепенному ухудшению и постоянно неудовлетворительному качеству очистки. При развитии вспухания в активном иле можно обнаружить одновременное присутствие различных родов нитчатых хламидобатерий с обязательным количественным преобладанием одного рода, наиболее характерного для данных экологических условий.
Вспухание активного ила не только сопровождается чрезмерным накоплением нитчатых микроорганизмов, но и затрагивает весь биоценоз.
Для более глубокого понимания процесса перестройки биоценоза под влиянием различных неблагоприятных факторов следует обратиться к разделу 1.9 ПНД Ф СБ 14.1.77-96.
При развитии хламидобактериального вспухания реакция со стороны биоценоза, в основном, приспособительная к таким факторам, как: увеличение удельной нагрузки, дисбалансированное питание, воздействие токсических веществ, снижение растворенного кислорода в иловой смеси, сокращение времени контакта загрязняющих веществ с оптимальным количеством активного ила (время контакта предопределено объемом аэротенков при проектировании), отсутствие режима «вытеснения» в аэротенках-смесителях (поршневого потока), т.е. отсутствие стадий последовательного окисления загрязняющих веществ по мере протекания сточных вод от начала к концу коридоров аэротенков.
В табл. 4 представлены биоиндикаторы, численность которых значительно возрастает при воздействии различных неблагоприятных факторов, вызывающих вспухание.
Индикаторная оценка процесса биологической очистки в условиях нитчатого вспухания ила
|
Биоиндикаторы |
|
|
Токсичные сточные воды |
Возрастание численности: |
|
нитчатых серобактерий родов Thiothrix, Beggiatoa, тип O21N; |
|
|
диспергированных бактерий, не связанных с хлопьями ила; |
|
|
зооглейных форм; |
|
|
мелких раковинных планктонных амеб; |
|
|
возможно, нитчатых водорослей; |
|
|
инцистированных форм простейших. |
|
|
Высокие нагрузки на ил по легкоокисляемым органическим загрязняющим веществам |
Возрастание численности: |
|
нитчатых бактерий рода Sphaerotilus natans; |
|
|
всех видов бентосных раковинных амеб. |
|
|
Снижение аэробности |
Возрастание численности: |
|
нитчатых серобактерий; |
|
|
мелких голых амеб; |
|
|
мелких бесцветных жгутиковых; |
|
|
крупных свободноплавающих инфузорий бактериофагов. |
|
|
Дисбалансированное питание для активного ила (нарушение пропорционального соотношения в содержании биогенных веществ в очищаемой воде) |
Возрастание численности: |
|
нитчатых серобактерий; |
|
|
зооглейных форм бактерий. |
|
|
Медленный прирост ила. |
|
|
Кислые сточные воды |
Возрастание численности сапрофитных грибов |
12. Способы борьбы с вспуханием активного ила
Комплекс мероприятий, направленных на подавление вспухания активного ила, должен разрабатываться только после точного установления причин, вызывающих вспухание, что обеспечивается правильной диагностикой родовой принадлежности вызывающих его нитчатых организмов при гидробиологическом анализе ила.
При возникновении гелевого вспухания следует выявить источники поступления в сточные воды трудноокисляемых или неокисляемых биологическим способом промышленных загрязняющих веществ и разработать мероприятия по локальному их удалению непосредственно из сточных вод промышленного предприятия перед сбросом в системы канализации. Для профилактики возникновения гелевого вспухания на стадии проектирования сооружений биологической очистки с аэротенками должно быть соблюдено требование СНиП 2.04.03-85: «отношение ХПК к БПК5 в поступающей на очистку воде должно быть не более 1,5». Если это требование не соблюдается, необходимо предусмотреть локальные очистные сооружения на предприятиях со сложным промышленным составом сточных вод.
Наиболее трудно ликвидировать хроническое вспухание, поскольку требуется или техническая реконструкция очистных сооружений, или предварительная очистка сточных вод до их поступления на сооружения биологической очистки или двухступенчатая очистка с регенерацией не менее 50 % ила.
Широко распространенное применение для борьбы с нитчатым вспуханием убивающих микрофлору средств (Chudoba, 1985) хлорной извести, карболовой кислоты не дает надежного положительного эффекта, поскольку при этом невозможно избирательно уничтожить нитчатых бактерий, страдает весь биоценоз активного ила, что нарушает его окислительную мощность и подавляет весь процесс очистки на 2 - 4 недели. Кроме того, в результате хлорирования активного ила резко возрастает токсичность очищенной воды. Однако, в настоящее время в странах Европейского сообщества и США это наиболее распространенный способ борьбы с нитчатым вспуханием (Switzebaum, 1992). Хлорирование не может дать эффективного результата, поскольку не устраняет основные причины, вызывающие вспухание ила. Под воздействием хлора нитчатые бактерии погибают, однако главная причина, вызывающая вспухание, сохраняется или может периодически возобновлять действие, вспухание регулярно повторяется или постоянно присутствует на БОС. Таким образом, борьба с последствием, а не с причинами, вызывающими вспухание, не может принести положительных результатов.
Поскольку вспухание активного ила является откликом биоценоза на неблагоприятные экологические условия для сапрофитной гелеобразующей микрофлоры (которая замещается более устойчивыми нитчатыми организмами), комплекс мер, разрабатываемых по борьбе с ним, должен предполагать, с одной стороны, стабильное улучшение экологических условий в аэротенках, а, с другой, - активирование ферментативных свойств сапрофитной микрофлоры, что позволит ей антагонистически вытеснить нитчатые организмы из биоценоза активного ила. Так как эти меры направлены как на ликвидацию основных причин вспухания (экологические условия аэротенка), так и на последствия, вызванные их воздействием (чрезмерный рост нитчатых организмов), получаемый эффект стабильно поддерживается, что обеспечивает существенное улучшение качества очистки сточных вод и предотвращает загрязнение природных водоемов.
При хламидобактериальном вспухании, вызванном перегрузкой ила легкоокисляемыми органическими веществами, необходимо, чтобы величина сброса загрязняющих веществ не превышала возможности активного ила их переработать, а это может быть обеспечено увеличением концентрации активного ила и повышением его способности к ферментативному окислению, что в свою очередь должно быть достигнуто достаточной аэробностью системы. Выполнение всех этих условий предполагает (при развитии в активном иле вспухания) проведение мероприятий, включающих три основные части: 1) повышение аэробности системы, 2) снижение нагрузок на активный ил, 3) повышение ферментативной активности микрофлоры стимуляцией ила алкилирующими агентами с последующей его селекцией (метод химического мутагенеза).
Идеальные условия массопереноса растворенного кислорода из жидкости в бактериальную клетку достигаются установкой системы пневматической аэрации с мелким размером пузыря воздуха (500 - 800 мкм). Мелкопузырчатая аэрация (фото 12) позволяет обеспечить высокопроизводительную работу аэротенков, поскольку аэробные условия создаются на всех участках биологической очистки, что способствует благоприятному режиму функционирования дыхательных ферментов сапрофитной микрофлоры, повышается ее устойчивость к высоким нагрузкам по органическим загрязняющим веществам, улучшаются седиментационные свойства активного ила. Мелкопузырчатая аэрация обязательно должна сочетаться с крупнопузырчатой, что увеличивает как перемешивание, так и степень насыщения кислородом иловой смеси.
Для снижения удельных нагрузок на активный ил проводятся мероприятия, улучшающие работу механической части очистных сооружений (более частая отгрузка осадка, преаэрация сточных вод, подключение резервов и т.д.). Рабочая доза активного ила повышается путем сокращения объема ила, направляемого на утилизацию. Для стабильного повышения дозы ила в аэротенки устанавливаются носители биомассы с большой поверхностью для обрастания биопленкой (фото 13, 14), что позволяет повысить эффект биологической очистки за счет возможности увеличения рабочей концентрации активного ила в аэротенке. Очистка осуществляется несколькими различными ценозами ила, подразделяющимися на две основные группы: ценоз активного ила, находящегося во взвешенном состоянии и в фиксированной на носителях биопленке. Возраст активного ила на носителях больше, чем у ила во взвешенном состоянии, непрерывно удаляемом и обновляемом. Такое сочетание разных возрастов позволяет поддерживать в реакторе высокие скорости окисления (молодой ил), улучшить нитрифицирующие и седиментационные свойства активного ила (возраст ила более 10 - 12 суток). Кроме того, прикрепленная биомасса увеличивает общее время пребывания активного ила в системе, что особенно важно для сооружений, очищающих трудноокисляемую органику. Возрастание концентрации ила и общей биомассы приводит к снижению нагрузок на ил, а, следовательно, к подавлению нитчатого бактериального вспухания и улучшению качества очистки.
Эффективным материалом для носителей биомассы, размещаемых в аэротенках, по эколого-физическим характеристикам является ершовая нить из капронового волокна, которая обеспечивает удержание значительного количества биопленки на единицу высокой удельной поверхности. Удельная поверхность адсорбции на ершах составляет 500 м2/м3 (Куликов, 1982). Иммобилизация клеток ила на носителях обычно проходит по типу естественной адгезии, т.е. самопроизвольного прилипания клеток организмов к поверхности носителя.
Для подавления нитчатого вспухания суммарный объем носителей должен составлять от 5 до 15 % от общего объема аэротенков с учетом обеспечения как максимальной окислительной мощности системы и нитрификации (Wanner et al., 1988), так и предупреждения падения удельных скоростей окисления, угнетения метаболизма организмов активного ила, находящегося во взвешенном состоянии.
Итак, использование носителей биомассы позволяет: 1) поддерживать концентрацию активного ила в 3 - 4 раза большую, чем в традиционных системах с активным илом и не создает дополнительной нагрузки на режим возврата и удаления активного ила из вторичных отстойников, поскольку организмы, прикрепленные на биопленке, постоянно находятся в аэротенках, не требуется их непрерывное отделение от очищенной воды и возврат в систему; 2) наращивать дополнительную массу ила на носителях, что приводит к повышению возраста ила и, как следствие, снижению в очищенной воде продуктов метаболизма, улучшению седиментационных влагоотдающих свойств ила, обеспечивает высокую окислительную мощность, более глубокую нитрификацию и повышает адаптационную способность организмов ила к воздействию токсикантов (прикрепляясь к поверхности носителя, организмы выделяют большее, чем обычно количество защитного полисахаридного геля).
Для повышения активности ферментов и избирательности ферментативного окисления у микрофлоры используется метод химического мутагенеза активного ила, при котором ил обрабатывается алкилирующими агентами, специально синтезируемыми веществами (Раппопорт, Васильева, 1980; Силантьева, Замелин, Федосова, 1981; Жмур, Лапшин, 1994). Обработке подвергается малая доля активного ила, имеющегося на очистных сооружениях. В результате активирования формируются популяции гелеобразующих сапрофитных бактерий, хорошо адаптированных к повышенным содержаниям субстратов и способных конкурентно подавлять развитие аллохтонных, патогенных, а также нитчатых бактерий. Смена ценоза активного ила идет в направлении адаптивном к заданному стоку и представляет собой микрофлору, содержащую все ферментные системы, необходимые для деградации присутствующих загрязняющих веществ. Активный ил после обработки улучшает свои седиментационные свойства. Индуцированная активация ила обеспечивает устойчивый эффект увеличения скорости и глубины изъятия загрязняющих веществ и улучшения влагоотдающих свойств ила. Причем обработку ила алкилирующими агентами должен проводить обученный этому специалист.
При возникновении вспухания, вызванного воздействием токсикантов, проводятся те же мероприятия с включением дополнительных:
1. Выявляется и устраняется токсикант.
2. Если поступление токсичных сточных вод зарегистрировано, и установлено, что токсиканты биологически не окисляются актив-
Причины, вызвавшие вспухание активного ила, и рекомендуемые мероприятия его подавления
|
Организмы, вызывающие вспухание |
Мероприятия по подавлению |
|
|
1 |
2 |
3 |
|
Сточные воды, содержащие трудноокисляемые или биологически неокисляемые соединения. |
Гетеротрофные сапрофитные бактерии, продуцирующие избыточное количество внеклеточного полимерного геля, возможно развитие бактерий рода Zoogloea. |
Выявить и локально удалить биологически неокисляемые или трудноокисляемые промышленные загрязняющие вещества, вызывающие гелевое (ненитчатое) вспухание активного ила. |
|
Высокие нагрузки на активный ил по легкоокисляемым органическим загрязняющим веществам и нарушение баланса между их сорбцией и окислением активным илом. Обычно имеет место в сточных водах пищевой промышленности: скотобоен и мясокомбинатов, предприятий переработки животных белков, консервных, молочных, пивоваренных, сахарных, виноперерабатывающих заводов. |
Хламидобактерии рода Sphaerotilus. |
Перейти на режим полного вытеснения в аэротенках с рассредоточенной подачей сточных вод. Применить регенерацию или увеличить объем, выделяемый под регенерацию (не менее 50 % от всех аэрируемых сооружений). Повысить аэробность (при хроническом вспухании установка системы мелкопузырчатой аэрации). Увеличить концентрацию активного ила в аэротенках (при хроническом вспухании установка носителей биомассы в объеме, обеспечивающем увеличение дозы ила в 2 - 3,5 раза от существующего). Трехкратно обработать активный ил мутагеном по методу И.А. Раппопорта (1975), модификация Н.С. Жмур, О.М. Лапшин (1994) в лабораторных условиях с последующим полным разрушением мутагенов и подращиванием на питательном бульоне с витаминными добавками группы В (антистрессовый фактор). |
|
Дисбалансированное питание активного ила (в основном, недостаток азота и фосфора в поступающей воде). Система подачи избыточного ила в первичные отстойники, приводящая к увеличению нагрузок на активный ил и дисбалансированию его питания. |
Хламидобактерии рода Sphaerotilus, или серобактерии. |
Подкормить ил при недостатке азота хлористым аммонием, мочевиной, сульфатом аммония, нитратом аммония; при недостатке фосфора - суперфосфатом простым, 0,1 % раствором ортофосфорной кислоты. Повысить аэробность аэротенков. Исключить подачу избыточного ила «в голову» сооружений или подавать не более 20 % от объема избыточного ила. |
|
Токсичные сточные воды (медь, цинк, никель) или значительное превышение объема промышленных сточных вод над объемом бытовых. |
Нитчатые формы бесцветных серобактерий Thiothrix, Beggiatoa тип O21N, Microthrix parvicella, Nocardia sp. |
Устранить поступление токсиканта (инспекторская деятельность). Улучшить первичное отстаивание (чаще отгружать осадок из первичных отстойников, реагентное осаждение токсикантов в период воздействия). Усилить аэрацию. На период поступления токсикантов исключить их контакт с активным илом регенераторов. Увеличить объем регенерации. Сократить объем ила, удаляемого на утилизацию в восстановительном периоде. Заразить аэротенки здоровым (не испытавшим контакта с токсикантом) илом, отобранным из других очистных сооружений (1 дм3 на 1 м3 аэротенка). При хроническом вспухании выполнить дополнительную установку мелкопузырчатой аэрации и носителей биомассы. |
|
Сточные воды, содержащие восстановленные соединения серы, сульфиды (метилсульфид, диметилсульфид, меркаптан и др.), - целлюлозно-бумажных комбинатов, фабрик по обработке кожи. Сточные воды, включающие серосодержащие органические вещества (например, белки). Сточные воды животноводческих комплексов, консервное производство. Недостаточная аэрация. |
Нитчатые формы бесцветных серобактерий Thiothrix, Beggiatoa, тип O21N. |
Повысить аэробность системы. Удалить серосодержащие вещества преаэрацией или реагентным осаждением. |
|
Низкая рН, недостаток азота в очищаемой воде. |
Сапрофитные грибы. |
Подщелачивание сточных вод дозированной подачей Са(ОН)2 перед аэротенками (лучше подщелачивать на локальном источнике). Улучшить аэрацию иловой смеси. Сбалансировать питание ила при наличии дефицита биогенных элементов. |
ЛИТЕРАТУРА
1. СНиП 2.04.03-85. Строительные нормы и правила. Канализация. Наружные сети и сооружения. М.: ЦИТП, 1986.
2. Базякина Н.А. Очистка концентрированных сточных вод. М.: Госстройиздат, 1958.
3. Бриф Р.И. Наблюдения над Sphaerotilus natans в чистой культуре / / Микробиология. 1963. Т. 5. Вып. 4.
4. Гвоздяк П.И., Дмитриенко Т.М., Куликов Н.И. Очистка промышленных сточных вод прикрепленными микроорганизмами // Химия и технология воды. 1985. Т. 7. № 1. С. 64-68.
5. Жмур Н.С. ПНД Ф СБ 14.1.77-96. Методическое руководство по гидробиологическому и бактериологическому контролю процесса биологической очистки на сооружениях с аэротенками. М., 1996.
6. Жмур Н.С., Лапшин О.М. Способ подавления бактериального нитчатого вспухания активного ила // Патент 94028293/13 (028252) от 27.07.94.
7. Куликов Н.И. Интенсификация процессов очистки сточных вод от ксенобиотиков пространственной сукцессией закрепленных микроорганизмов //1 Всесоюзная конф. по микробиологии очистки воды: Тез. докл. Киев: Наукова думка, 1982. С. 29 - 31.
8. Макеева Е.Н., Горемыкина Л.Ф., Шлыгина Т.С. Способ подавления вспухания активного ила / А. с. 1242478 СССР, МКИ С02 F3/34. - № 3852317/23-26: Бюлл. № 25.
9. Разумов А.С. К вопросу о хемосинтезе у железобактерии // Микробиология. 1957. Т. XXVI. Вып. 3. С. 392 - 396.
10. Роговская Ц.И. Биохимический метод очистки производственных сточных вод. М.: Стройиздат, 1967.
11. Усманова Л.П., Вороненко В.В., Наумова Р.П., Воронин A.M., Асадуллина Г.П., Зарипова С.К., Гусев Ю.В., Асадуллин А.З. Способ биологической очистки концентрированных сточных вод от органических загрязнений / А. с. 1231010 СССР, МКИ С02 F3/34. № 3786159/23-26: Бюлл. № 18.
12. Тарадин Я.И., Горемыкина Л.Ф., Сухаренок Б.Л., Суворова В.И., Писаренко Г.И. Способ биологической очистки сточных вод / А. с. 513014 СССР, МКИ С02 С5/10. - № 1874167/23-26: Бюлл. № 17.
13. Тырыгина Г.И., Винников А.И., Бабенко Ю.С. Способ биологической очистки сточных вод / А. с. 1058900, МКИ С02 F3/34. № 3472205/23-26: Бюлл. № 45.
14. Хаммер М. Технология обработки природных и сточных вод. М.: Стройиздат, 1979.
15. Bergey D. Manual of determinative bacteriology. 6-th edition. Baltimore, 1948.
16. Bisogni J.J., Lawrence A.W. Relationships between biological solids detention time and settling characteristics of activated sludge. Water Research. 1971. Vol. 5. P. 753 - 763.
17. Busby Y.B., Andrews Y.E. Dynamic modeling and control strategies for activated sludge process. Water Pollution Control Fed. 1975. Vol. 47, № 5. P. 1055 - 1080.
18. Cashion B.S., Keinath T.M. Influence of three factors on clarification in the activated sludge process. Journal WPCF. 1983. Vol. 55, № 11, P. 1331 - 1337.
19. Chao A.C., Keinath T.M. Influence of process loading intensity of sludge clarification and thickening characteristics. Water Research. 1979. Vol. 13, P. 1213 - 1223.
20. Chiesa S.C., Irvine R.L. Growth and control of filamentous microbes in activated sludge: an integrated hypothesis. Water Research. 1985. Vol. 19, № 4, P. 471 - 479.
21. Chudoba J. Control of activated sludge filamentous bulking. Water Research. 1985. Vol. 19, № 8, P. 1017 - 1022.
22. Chudoba J. et al. Control of activated sludge filamentous bulking. 11. Selection of microorganism by means of a selector. Water Research. 1973. Vol. 7, P. 1389-1400.
23. Chudoba J. et al. Control of activated sludge filamentous bulking. IV. Effect of sludge regeneration. Water Sci. Technol. 1982. № 14, P. 73 - 93.
24. Chudoba J. et al. Control of activated sludge filamentous bulking. Experimental verification of a kinetic theory. Water Research. 1985. Vol. 19, № 2, P. 191 - 195.
25. Clifft R.C., Andrews J.F. Predicting the dynamics of oxygen utilization in the activated sludge process. Journal WPCF. 1981. Vol. 53, № 7, P. 1219 - 1232.
26. Da-Hongli, Ganczarcryk J. Flow through activated sludge floes. Water Research. 1988. Vol. 22, № 6, P. 789 - 792.
27. Daigger G.T., Grady C.P.L. The dynamics of microbial growth on soluble substrates. Water Research. 1982. Vol. 16, P. 365 - 382.
28. Dold P.L., Ekama G.A., Marais G.R. A general model for the activated sludge process. Progr. Water Technol. 1980. Vol. 12, № 6, P. 47 - 77.
29. Ekama G.A., Marais G.R. Sludge settle ability and secondary settling tank design procedures. Water Pollution Control. 1986, P. 101 - 113.
30. Forster C.F. Factors involved in the settlement of activated sludge. 11. The Binding of polyvalent metals. Water Research. 1985. Vol. 19, № 10, P. 1265 - 1271.
31. Forster C.F. et al. Activated sludge settlement - some suppositions and suggestions. Water Pollution Control. 1980. № 3, P. 338 - 351.
32. Goodvin J.A.S., Forster C.F. A further examination into the composition of activated sludge surfaces in relation to their settlement characteristics. Water Research. 1985. Vol. 19, № 4, P. 527 - 533.
33. Hollo J., Toth J., Tengerdy K.P., Johnson J.E. Denitrification and removal of heavy metals from waste water by immobilized microorganisms. Immobilized microbial cells. Washington, 1979, P. 73 - 86.
34. Houtmeyers J. Relation between substrate feeding pattern and development of filamentous bacteria in activated sludge process. Agriculture (Belg.). 1978. Vol. 26, № 1, P. 135.
35. Houtmeyers J. et al. Relation between substrate feeding pattern and development of filamentous bacteria in activated sludge processes. Part 1: Influence of Process Parameters. European J. Appl. Microbiol. Biotechnol. 1980. № 9, P. 63 - 77.
36. Jenkins D. et al. Causes and control of activated sludge bulking. Water Pollution Control. 1984, P. 455 - 472.
37. Palm J.C. et al. Relationship between organic loading, dissolved oxygen concentration and sludge settle ability in the completely mixed activated sludge process. Journal WPCF. 1980. Vol. 52, № 10, P. 2484 - 2506.
38. Pipes W.O. Bulking deflocculation and pinpoint floe. Journal WPCF. 1979. Vol. 51, № 1, p. 62 - 70.
39. Rensink J.H. Cure and prevention of bulking sludge in practice. La Tribune du CEBEDEAU. 1979. № 432, P. 445 - 450.
40. Sezgin M. et al. A unified theory of filamentous activated sludge bulking. Journal WPCF. 1978. Vol. 50, P. 362 - 381.
41. Swizenbaum M.S., Plante T.R., Woodworth B.K. Filamentous bulking in Massachusetts: extent of the problem and case studies. Water Research. 1992. Vol. 25, № 4-5, P. 265 - 271.
42. Van Den Eynde E. et al. Relation between substrate feeding pattern and development of filamentous bacteria in activated sludge. Bulking of Activated Sludge: Preventative and Remedial Methods / Eds: B. Chambers, E.J. Tomlinson. Chichester, England, 1982, P. 128 - 146.
43. Van Veen W.L et al. Some growth parameters of Haliscomenobacter hydrossics (Syn. Sterptothrix Hyalina) a bacterium occurring in bulking activated sludge. Water Research. 1982. Vol. 16, P. 531 - 534.
44. Wanner J., Kucman K., Grau P. Activated sludge process combined with biofilm cultivation. Water Research. 1988. Vol. 22, № 2, P. 207 - 215.
45. Zhmur N.S. The causes and measures of counteraction to excessive wastage of activated sludge from secondary tanks. Biology in Water Management: Abstracts of the International Conference. Budapest, 1987, p. 81.
ПРИЛОЖЕНИЕ 1. ФОТОГРАФИИ АКТИВНОГО ИЛА И ТЕХНИЧЕСКИХ СРЕДСТВ ПОДАВЛЕНИЯ НИТЧАТОГО ВСПУХАНИЯ
Фото 1. Компактные хлопья активного ила, не включающие нитчатых микроорганизмов. Увеличение 1350х
Фото 2. Нитчатое вспухание активного ила. Увеличение 100х, окрашивание флюрамом
Фото 3, 4. Дефлокуляция хлопьев под влиянием нитчатых организмов при вспухании активного ила
Фото 5. Трихомное строение хламидобактерий (тип O21N), контрастируемое акридиновым оранжевым. Увеличение 1350х
Фото 6. Вспухание активного ила, вызванное тионовыми бактериями
Фото 7. Ложное дихотомическое ветвление Sphaerotilus natans. Специфическая особенность: клетки сапрофитных бактерий прикрепляются к чехлу нитчатых микроорганизмов
Фото 8, 9. Нитчатые бактерии с включениями серы. Увеличение 400х
Фото 10, 11. Сапрофитные грибы активного ила в нормальном иле (10) и при развитии вспухания (11)
Фото 12. Мелкопузырчатый аэратор
Фото 13. Установка ершовых носителей биомассы в аэротенки
Фото 14. Носители биомассы в опорожненном аэротенке