| Информационная система |  |
|
ФЕДЕРАЛЬНОЕ АГЕНТСТВО |
||
|
НАЦИОНАЛЬНЫЙ |
ГОСТ Р |
|
ПРОИЗВОДСТВО ЛЕКАРСТВЕННЫХ СРЕДСТВ
СИСТЕМА ОБЕСПЕЧЕНИЯ КАЧЕСТВА
ОБЩИЕ ТРЕБОВАНИЯ
Москва
Стандартинформ
2006
Предисловие
Цели и принципы стандартизации в Российской Федерации установлены Федеральным законом от 27 декабря 2002 г. № 184-ФЗ «О техническом регулировании», а правила применения национальных стандартов Российской Федерации - ГОСТ Р 1.0-2004 «Стандартизация в Российской Федерации. Основные положения»
Сведения о стандарте
1. РАЗРАБОТАН Общероссийской общественной организацией «Ассоциация инженеров по контролю микрозагрязнений» (АСИНКОМ)
2. ВНЕСЕН Техническими комитетами по стандартизации ТК 458 «Правила производства и контроля качества лекарственных средств» и ТК 184 «Обеспечение промышленной чистоты»
3. УТВЕРЖДЕН И ВВЕДЕН В ДЕЙСТВИЕ Приказом Федерального агентства по техническому регулированию и метрологии от 21 апреля 2006 г. № 73-ст
4. ВВЕДЕН ВПЕРВЫЕ
Информация об изменениях к настоящему стандарту публикуется в ежегодно издаваемом информационном указателе «Национальные стандарты», а текст изменений и поправок - в ежемесячно издаваемых информационных указателях «Национальные стандарты». В случае пересмотра (замены) или отмены настоящего стандарта соответствующее уведомление будет опубликовано в ежемесячно издаваемом информационном указателе «Национальные стандарты». Соответствующая информация, уведомления и тексты размещаются также в информационной системе общего пользования - на официальном сайте Федерального агентства по техническому регулированию и метрологии в сети Интернет
СОДЕРЖАНИЕ
Введение
Лекарственные средства являются особым видом продукции. К ним предъявляются высокие требования по безопасности и эффективности, обеспечиваемые на всех этапах разработки, испытаний, производства и реализации.
Требования к производству лекарственных средств установлены системообразующим стандартом ГОСТ Р 52249. Настоящий стандарт входит в комплекс стандартов, относящихся к производству лекарственных средств, и детализирует требования к системе обеспечения качества на этапе производства.
Обеспечение качества является комплексной задачей, в которую входят:
- использование материалов, отвечающих заданным требованиям;
- производство продукции в помещениях и на оборудовании, гарантирующих выпуск продукции в соответствии с заданными требованиями;
- надлежащая подготовка производства;
- соответствие персонала требованиям к профессиональной подготовке, личной гигиене, исполнительности и добросовестности.
Данные условия должны быть указаны в системе документации, следование которой позволит гарантировать качество продукции, подтвердить его при проведении контроля и исключить рекламации.
Наряду со сказанным следует постоянно проводить анализ случаев отклонений от требований спецификаций и параметров (операций, процессов), представляющих риск для стабильности качества с разработкой и реализацией планов организационно-технических мероприятий по обеспечению качества.
При разработке стандарта использованы российские нормативные документы (ГОСТ Р 6.30), материалы ВОЗ и FDA США [1], [2].
НАЦИОНАЛЬНЫЙ СТАНДАРТ РОССИЙСКОЙ ФЕДЕРАЦИИ
|
Производство лекарственных средств СИСТЕМА ОБЕСПЕЧЕНИЯ КАЧЕСТВА Общие требования Manufacturing of medicinal product. Quality assurance system. |
Дата введения - 2007-01-01
1. Область применения
Настоящий стандарт устанавливает требования к системе обеспечения качества при производстве лекарственных средств с целью их гарантированного соответствия техническим регламентам, национальным и межгосударственным стандартам, Государственной Фармакопее, другим нормативным документам, стандартам предприятий и специальным требованиям, задаваемым при регистрации лекарственных средств.
Стандарт дополняет системообразующий стандарт ГОСТ Р 52249 и детализирует требования к системе обеспечения качества. Конкретные организационные и технические требования к документации, процессам и оборудованию (стерилизация, подготовка воды, технологическое оборудование, чистые помещения и пр.) рассматриваются в других стандартах.
2. Нормативные ссылки
В настоящем стандарте использованы ссылки на следующие стандарты:
ГОСТ Р 6.30-2003 Унифицированные системы документации. Унифицированная система организационно-распорядительной документации. Требования к оформлению документов
ГОСТ Р ИСО 13408-1-2000 Асептическое производство медицинской продукции. Часть 1. Общие требования
ГОСТ Р ИСО 14644-4-2002 Чистые помещения и связанные с ними контролируемые среды. Часть 4. Проектирование, строительство и ввод в эксплуатацию
ГОСТ Р 52249-2004 Правила производства и контроля качества лекарственных средств
Примечание - При пользовании настоящим стандартом целесообразно проверить действие ссылочных стандартов в информационной системе общего пользования - на официальном сайте Федерального агентства по техническому регулированию и метрологии в сети Интернет или по ежегодно издаваемому информационному указателю «Национальные стандарты», который опубликован по состоянию на 1 января текущего года, и по соответствующим ежемесячно издаваемым информационным указателям, опубликованным в текущем году. Если ссылочный документ заменен (изменен), то при пользовании настоящим стандартом следует руководствоваться замененным (измененным) документом. Если ссылочный документ отменен без замены, то положение, в котором дана ссылка на него, применяется в части, не затрагивающей эту ссылку.
3. Термины и определения
В настоящем стандарте применены термины и определения по ГОСТ Р 52249, а также следующие термины с соответствующими определениями:
3.1 информация о предприятии (досье предприятия) (site master file): Документ, содержащий основные данные о предприятии.
3.2 качество лекарственного средства (quality of medicinal product): Соответствие лекарственного средства требованиям спецификации, фармакопейной статьи или другого документа.
3.3 система обеспечения качества (quality assurance system): Комплекс организационных и технических мер, обеспечивающих выпуск лекарственных средств в соответствии с заданными требованиями.
3.4 критический параметр (critical parameter): Параметр, влияющий на качество лекарственного средства.
3.5 уровень действия (action level): Значение контролируемого параметра, при достижении которого требуется немедленное определение и устранение причин ввиду опасности выхода параметра за допустимые пределы.
3.6 уровень предупреждения (alert level): Значение контролируемого параметра, которое свидетельствует о возможной тенденции его выхода за допустимые пределы, что требует анализа причин изменения параметра и, при необходимости, принятия соответствующих мер.
3.7 промышленный регламент, технологическая инструкция и инструкция по упаковке (manufacturing formulae, processing and packaging instruction): Документы, определяющие все используемые исходные материалы и операции по производству и упаковке продукции.
3.8 инструкция, методика, процедура (procedure, standard operating procedure - SOP): Документы, содержащие указания по выполнению отдельных видов операций (например, по очистке, переодеванию, контролю окружающей среды, отбору проб, проведению испытаний, эксплуатации оборудования).
Примечание - В англоязычной литературе используется термин «Standard Operation Procedure - SOP». Применение в русском языке термина «Стандартная операционная процедура - СОП», являющегося заменой латинских букв кириллицей, не имеет содержательного смысла, не добавляет новизны в общепринятые отечественные термины и не рекомендуется.
3.9 протокол на серию (record): Документ, отражающий ход производства каждой серии продукции, в т.ч. разрешение на ее реализацию, и все факторы, влияющие на качество готовой продукции.
Примечание - В протокол на серию следует также включать данные о проведении подготовительных работ перед производством серии, влияющих на качество продукции (очистка и стерилизация оборудования, уборка помещений и пр.).
3.10 аттестация (qualificfcion, validation): Подтверждение соответствия заданным требованиям.
Примечания
1. На различных этапах проектирования, монтажа и ввода в эксплуатацию объектов проводятся:
- аттестация проекта (DQ - Design Qualification);
- аттестация в построенном состоянии (IQ - installation Qualification);
- аттестация в оснащенном состоянии (OQ - Operation Qualification);
- аттестация в эксплуатируемом состоянии (PQ - Performance Qualification).
2. Для проведения аттестации требуются программа аттестации (validation master plan) и методики аттестации.
«Валидационный мастер план» - нерекомендуемый термин.
4. Содержание системы обеспечения качества
4.1. Назначение системы обеспечения качества
Система обеспечения качества в производстве лекарственных средств должна гарантировать выполнение основных требований к выпускаемой продукции:
- соответствие спецификации (фармакопейной статье), в т.ч. отсутствие посторонних включений физической, химической и микробиологической природы, выходящих за установленные пределы;
- сохранение своих свойств в течение установленного срока годности;
- наличие правильной и четкой маркировки.
Существенные особенности, отличающие лекарственные средства от многих других видов продукции, состоят в следующем:
- сплошной контроль готовых лекарственных средств неразрушающими методами по всем показателям невозможен, т.е. контроль качества может выполняться только по выборке определенного числа образцов из серии продукции;
- потребитель не может проверить качество лекарственных средств, он полностью доверяет сопроводительной документации производителя.
Выборочный контроль не дает гарантии того, что дефектная продукция не окажется на рынке. В связи с этим качество лекарственного средства должно быть обеспечено технологией и организацией производства так, чтобы продукция, не соответствующая установленным требованиям, не могла появиться.
4.2. Принципы обеспечения качества
Обеспечение качества лекарственных средств основано на следующих принципах:
а). Четкое определение обязанностей и ответственности руководителей и всех сотрудников предприятия. Понимание всем коллективом и, в первую очередь, руководителем предприятия, первостепенной роли системы обеспечения качества в производстве лекарственных средств.
b). Документальное оформление всех процессов производства, контроля качества и пр. в конкретной, исчерпывающей и понятной для каждого работника форме с детализацией каждой операции или каждого требования так, чтобы любое действие выполнялось в соответствии с документом и действия по устному распоряжению или по личной трактовке исключались.
c). Организация производства в соответствии с документацией предприятия и действующими нормативными документами.
d). Обеспечение прослеживаемости всего процесса производства и контроля качества за счет полного документирования выполнения всех операций и полученных результатов от приема материалов до реализации продукции.
e). Контроль исходных и упаковочных материалов, промежуточной и готовой продукции в полном соответствии с установленными требованиями. Использование материалов, соответствующих установленным требованиям. Исключение использования иных материалов.
g). Выполнение требований ГОСТ Р 52249 к помещениям, оборудованию и процессам достигается наличием проекта производства, соответствующего нормативным документам, и его должной реализацией.
h). Укомплектованность производства персоналом, имеющим необходимую подготовку и дисциплину.
i). Исполнительская дисциплина - обязательное и точное выполнение персоналом своих обязанностей, приказов, распоряжений и других документов, а также информирование руководства о ситуациях, связанных с невыполнением порученного дела. Контроль выполнения персоналом установленных требований.
j). Постоянный анализ качества продукции, случаев отклонения от спецификаций и причин рекламаций; организация отзывов продукции, не соответствующей требованиям; анализ рисков и определение критических точек; проведение самоинспекций, т.е. наличие постоянной обратной связи между результатами работы, с одной стороны, и технологическим процессом, персоналом, материалами и другими ресурсами, с другой.
k) Культура производства:
- чистота на предприятии (территории, в производстве, вспомогательных, складских и бытовых помещений и пр.);
- личная гигиена, аккуратность и пр.;
- культура взаимоотношений (корректная работа руководителей, создание благоприятного психологического микроклимата на всех уровнях).
4.3. Структура системы обеспечения качества
Система обеспечения качества при производстве лекарственных средств состоит из следующих элементов.
4.3.1. Информация о предприятии
«Информация о предприятии» - документ, содержащий основные данные о предприятии в соответствии с подразделом 4.4.
4.3.2. Работа с материалами
Данный раздел включает в себя документацию, регламентирующую взаимоотношения с поставщиками исходных и упаковочных материалов, порядок приема материалов, отбора проб, карантинного хранения и пр. от заключения договоров (оформления заказов на поставку материалов) до выдачи материалов в производство в соответствии с разделом 5.
4.3.3. Организация производства
Данный раздел включает весь комплекс документации, регламентирующей производство лекарственных средств, от получения исходных материалов на складе материалов до сдачи продукции на склад и получения разрешения на реализацию готовой продукции в соответствии с разделом 6.
4.3.4. Контроль качества
Раздел содержит документацию по работе контрольных лабораторий, включая контроль материалов и готовой продукции в соответствии с разделом 7.
4.3.5. Анализ качества
Включает в себя проведение анализа рисков, случаев отклонения от спецификаций, рекламаций и организацию отзывов продукции с разработкой мер по повышению уровня работы в соответствии с разделами 7, 11.
4.3.6. Аудит
Проведение внешнего и внутреннего аудита позволяет своевременно обнаружить отклонения в производстве и связанные с ним факторы от установленных требований и принять необходимые меры в соответствии с разделом 13.
4.3.7. Подготовка производства
В понятие «подготовка производства» входят разработка проекта производства, строительство, оснащение оборудованием и приборами, разработка документации (методик аттестации критических помещений, оборудования и процессов, инструкций и пр.), проведение аттестации с оформлением протоколов, разработка планов организационно-технических мероприятий по обеспечению качества и развитию производства и пр.
4.3.8. Персонал
Разработка, реализация и контроль выполнения требований к профессиональной подготовке персонала, системы обучения, инструкций по поведению, личной гигиене и пр. в соответствии с разделом 9.
4.3.9. Система контроля исполнения
Содержит оформленный документально и реализованный организационно порядок контроля исполнения и меры воздействия на нарушителей в соответствии с разделом 10.
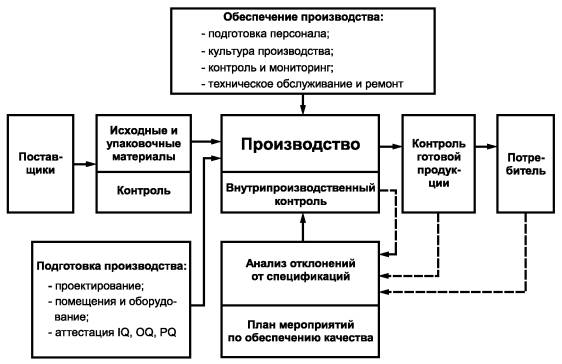
Структура системы обеспечения качества приводится в «Информации о предприятии». Она должна быть доступной для восприятия и наглядной, так как сложные, запутанные и неясно изложенные предметы не воспринимаются, и к ним, как правило, относятся формально. Пример блок-схемы структуры системы обеспечения качества приведен на рисунке 1.
Рисунок 1 - Система обеспечения качества
4.4. Информация о предприятии
В «Информации о предприятии» приводятся следующие данные:
- наименование и адрес предприятия;
- номенклатура выпускаемой продукции (если допустимо);
- данные о численном составе (если допустимо);
- организационная структура предприятия;
- ответственность руководителей службы контроля качества;
- перечень основных стандартов, на которых основана система обеспечения качества;
- систематизированный перечень документов, по которым ведется работа предприятия, подразделений и отдельных исполнителей, проводится аттестация и испытания оборудования, ведется обучение персонала и пр.; при большом количестве документов могут приводиться виды (наименования групп) документов.
Приложениями к «Информации о предприятии» могут быть:
- политика предприятия в области качества (необязательный документ);
- сводный перечень всех документов на предприятии (инструкции, методики, приказы и пр.) с системой кодирования документов (при необходимости).
Конкретное содержание «Информации о предприятии» определяется самим предприятием.
Содержание «Информации о предприятии», рекомендуемое Всемирной организацией здравоохранения (ВОЗ) [1], приведено в приложении А.
На предприятии должно быть определено лицо, ответственное за разработку «Информации о предприятии». Руководителям подразделений следует принимать активное участие в разработке «Информации о предприятии».
«Информация о предприятии» должна быть, по возможности, краткой и написанной в ясной форме. Данный документ должен быть полезным для сотрудников и руководителей предприятия и использоваться в практической деятельности.
Важным элементом является система управления документацией (в том числе кодирования), позволяющая легко находить нужный документ в зависимости от подразделения или процесса, контролировать внесение изменений и пр. Система управления документацией должна определять единые требования к разработке, обороту и актуализации документов. Она может быть оформлена в виде стандарта предприятия (организации).
«Информация о предприятии» должна быть открытым документом, доступным для пользования (за исключением данных для служебного пользования).
4.5. Организационная структура предприятия
4.5.1. Назначение организационной структуры - дать возможность каждому понять схему управления предприятием, взаимосвязи, подчиненность и свое место в ней.
4.5.2. Организационная структура предприятия имеет несколько уровней:
- руководитель предприятия;
- заместители руководителя (главный инженер, заместители по производству, качеству, коммерческой работе, капитальному строительству, общим вопросам, развитию и др.);
- начальники подразделений (цехов, отделов, лабораторий, служб и др.), заведующие складами и главные специалисты (главный технолог, главный механик и пр.);
- структурные единицы подразделений (отделы, бюро, секторы и пр.);
- исполнители.
Организационная структура должна отражать взаимосвязи между различными уровнями управления и подразделениями предприятия. Следует определить работника (руководителя), выполняющего функции Уполномоченного лица.
4.5.3. Руководитель предприятия, его заместители, руководители подразделений структурных единиц и исполнители должны иметь определенные функции (обязанности) и ответственность, которые излагаются в должностных инструкциях, контрактах или других документах.
Не допускается дублирование ответственности.
4.5.4. Для подразделений и структурных единиц должны быть разработаны положения, в которых определены структура, задачи, функции, права, взаимоотношения с другими подразделениями и ответственность.
4.5.5. Организационная структура и должностные инструкции определяют подчиненность подразделений и работников.
4.5.6. В должностной инструкции указываются:
- наименование должности;
- квалификационные требования (образование, стаж работы);
- подчиненность;
- функции (права и обязанности, возлагаемые данной инструкцией на соответствующее лицо);
- ответственность.
Каждый работник должен быть ознакомлен с должностной инструкцией под расписку.
4.6. Руководство предприятия
Руководству предприятия, в первую очередь первому руководителю, принадлежит решающая роль в обеспечении качества продукции.
Руководство предприятия отвечает за выработку стратегических решений, организует их выполнение, выделяет необходимые ресурсы и осуществляет контроль реализации принятых решений.
Обеспечение качества продукции - стратегическая цель предприятия.
4.7. Обеспечение качества и контроль качества
На предприятии рекомендуется иметь подразделения:
- обеспечения качества (например, отдел обеспечения качества);
- контроля качества (отдел контроля качества).
В функции отдела обеспечения качества входят:
- разработка структуры системы обеспечения качества, контроль ее функционирования, внесение изменений в систему обеспечения качества по мере развития производства;
- разработка основных форм документов и основных элементов системы обеспечения качества (оргструктура предприятия, перечни документации и пр.);
- распределение всего комплекса документации по подразделениям предприятия, контроль разработки документов, их распространения, внесения изменений и исполнения;
- контроль обучения и аттестации персонала;
- контроль разработки и реализации проектов производства, реконструкции производства;
- координация работы по аттестации проектов, помещений, процессов и оборудования (отдельные виды аттестации может выполнять сам отдел обеспечения качества);
- контроль выполнения требований инструкций, методик и других документов;
- разработка и контроль выполнения плана мероприятий по обеспечению соответствия требованиям ГОСТ Р 52249 и других нормативных документов.
Отдел обеспечения качества подчиняется руководителю предприятия.
Отдел контроля качества включает в себя контрольные лаборатории.
Руководитель отдела контроля качества продукции должен быть не зависимым от руководителя производства.
4.8. Политика предприятия в области качества
Для подчеркивания первостепенной роли обеспечения качества и постоянного акцентирования внимания всех сотрудников на обеспечении качества на предприятии может быть принята политика качества, которая оформляется в виде отдельного документа под названием «Политика в области качества». Это краткий общий документ, определяющий цель работы коллектива в отношении качества.
Документ должен отражать предмет деятельности предприятия, понимание коллективом предприятия своей основной задачи как всемерное удовлетворение нужд потребителей, установку на постоянное совершенствование работы с целью обеспечения стабильности показателей качества выпускаемой продукции. Пример документа приведен в приложении В.
Документ подписывается руководителем предприятия, доводится до каждого работника, постоянно находится в доступном месте, публикуется в информационных материалах и пр.
Политика предприятия в области качества должна быть ясной, понятной и воспринятой всеми работающими. Ее цели должны быть реальными. При ее формулировании следует избегать многословия, ничего не значащих фраз и формализма.
5. Материалы
На предприятии следует организовать контроль исходных и упаковочных материалов (входной контроль), включающий в себя отбор проб (образцов), их анализ (испытания) с оформлением документации, подтверждающей соответствие материалов заданным требованиям (спецификаций, стандартов, фармакопейных статей), и оформление разрешения на их использование или отклонение.
Необходимо разработать и ввести в действие систему, исключающую использование или поставку материалов, которые не соответствуют заданным требованиям. Система должна предусматривать своевременное обнаружение таких материалов.
Следует организовать входной контроль печатных и упаковочных материалов.
Должны быть документально оформлены и реализованы требования, регламентирующие:
- прием материалов;
- контроль качества исходных и упаковочных материалов, включая отбор проб (образцов), карантинное хранение, анализ проб или образцов, оформление разрешения на применение материалов, хранение проб (образцов);
- транспортирование материалов на предприятии;
- аудит поставщиков;
- оформление договоров (заказов).
Рекомендации по реализации данных требований приведены в приложении C.
6. Производство
Для обеспечения качества продукции в процессе производства следует разработать и реализовать требования, регламентирующие:
- проработку заказов (при необходимости) в соответствии с приложением D;
- организацию и управление производством в соответствии с утвержденной документацией;
- технологические процессы;
- эксплуатацию помещений и оборудования;
- маркирование (этикетирование);
- внутрипроизводственный контроль;
- материальный баланс;
- работу с отклоненной продукцией;
- условия хранения продукции;
- отгрузку продукции;
- подготовку персонала и его работу в соответствии с разделом 9.
Все действия, относящиеся к обеспечению качества в процессе производства, должны быть оформлены документально.
Рекомендации по реализации данных требований приведены в приложении Е.
7. Контроль качества и выпуск готовой продукции
7.1. Общие положения
Функциями отдела контроля качества являются приемка или отклонение любых исходных и упаковочных материалов, этикеток и готовой продукции по показателям качества, а также согласование документов (инструкций, методик, спецификаций), связанных с обеспечением качества.
Данный отдел наделяется необходимыми правами и несет ответственность за качество выпускаемой продукции. В его функции могут входить также рассмотрение протоколов серий, их проверка и расследование обнаруженных ошибок (совместно с отделом обеспечения качества).
Отдел контроля качества несет ответственность за приемку или отклонение материалов и готовой продукции, изготовленной, проверенной или упакованной по контракту с другим предприятием.
В состав отдела контроля качества входят лаборатории, осуществляющие контроль (испытания), допуск в производство (реализацию) или отклонение исходных и упаковочных материалов и готовой продукции.
Работа отдела контроля качества регламентируется инструкциями, определяющими ее обязанности, ответственность и права его сотрудников.
На предприятии должны быть определены специальными документами порядок работы с рекламациями на продукцию и порядок отзыва продукции с рынка.
Принципы организации отдела контроля качества приведены в ГОСТ Р 52249.
7.2. Контроль качества готовой продукции
Каждая серия готового лекарственного средства должна пройти контроль по всем показателям, содержащимся в фармакопейной статье (спецификации). Не допускается выпуск серий продукции, не отвечающих требованиям спецификации (фармакопейной статьи) хотя бы по одному показателю.
Протоколы результатов контроля качества должны содержать все данные о проведении тестов на соответствие требованиям спецификаций и других документов.
Методы отбора проб (образцов) и проведения контроля с указанием числа единиц продукции, отбираемых из серии для проведения контроля, должны быть приведены в методиках (инструкциях).
Точность, чувствительность, специфичность, воспроизводимость и другие характеристики аналитических методов контроля должны быть установлены и оформлены документально. Методы (методики), не содержащиеся в нормативных документах, подлежат аттестации по ГОСТ Р 52249 (приложение 15). Аттестация может выполняться специалистами предприятия или специалистами независимой организации.
Для методов, содержащихся в стандартах, Фармакопее и других нормативных документах, достаточно привести ссылки на них с обеспечением воспроизводимости методики в данной лаборатории на данном приборе.
7.3. Выпуск готовой продукции
Выпуск готовой продукции на реализацию осуществляется только после документального подтверждения того, что она произведена и проверена в соответствии с установленными требованиями.
7.4. Сохраняемые образцы
Предприятие должно оставлять на хранение образцы каждой серии продукции. Число образцов и время их хранения должны быть установлены в документации.
7.5. Лабораторные животные
Состояние животных, используемых для контроля исходных материалов, промежуточной и готовой продукции, следует контролировать.
Животных следует содержать в условиях, обеспечивающих пригодность их использования по назначению. Следует вести документацию, отображающую историю использования животных.
8. Обеспечение качества на этапе подготовки производства
8.1. Общие положения
Качество продукции закладывается на этапах проектирования производства, выбора оборудования, строительства, монтажа, пусконаладочных работ, аттестации и далее обеспечивается путем надлежащей эксплуатации.
Проектирование, строительство, ввод в эксплуатацию оборудования и помещений, в том числе проведение аттестации, относятся к подготовке производства.
При их реализации следует руководствоваться ГОСТ Р 52249 и другими стандартами, отражающими современный уровень развития техники.
На каждом этапе подготовки производства следует выполнять работы по аттестации. Логика проведения аттестации на различных этапах подготовки производства направлена на своевременное обнаружение ошибок и отклонений от заданных требований, внесение необходимых изменений и целенаправленный вывод производства на выпуск продукции в соответствии с требованиями ГОСТ Р 52249.
8.2. Аттестация проекта
Цель аттестации проекта - подтверждение соответствия проекта заданию на проектирование и действующим нормативным документам. Ввиду того, что проектирование является длительным и дорогостоящим процессом, аттестацию проекта целесообразно разбить на этапы:
- аттестация концепции (принципиальных решений);
- аттестация утверждаемой части проекта (basic design).
Аттестацию концепции целесообразно выполнять для сложных и дорогостоящих проектов.
При необходимости может выполняться аттестация рабочей документации (чертежей).
Аттестация должна быть независимой. Для первого этапа она может носить характер консультаций. Второй этап является основой проекта, и проведение его аттестации имеет ключевое значение.
Аттестация проекта не должна заменяться экспертизой надзорных органов по отдельным направлениям, связанным с обеспечением безопасности, охраны природы и пр. Аттестация проекта должна быть направлена на подтверждение соответствия проектируемого объекта показателям назначения и требованиям ГОСТ Р 52249.
При аттестации проекта следует обратить особое внимание на выбор оборудования, разработку планировочных решений, построение систем вентиляции, подготовки воды и других инженерных систем в соответствии с требованиями ГОСТ Р 52249.
8.3. Аттестация в построенном состоянии
Аттестация в построенном (установленном) состоянии выполняется с целью подтверждения соответствия построенного объекта и установленного оборудования проекту и нормативным документам. При ее проведении проверяются:
- комплектность оборудования и его соответствие заказу;
- правильность установки и подключения оборудования;
- соответствие заданным требованиям материалов рабочих поверхностей, вступающих в контакты с продуктом;
- соответствие заданным требованиям критического оборудования (например, стерилизаторов, НЕРА фильтров).
8.4. Аттестация в оснащенном состоянии
Аттестация в оснащенном состоянии выполняется с целью подтверждения соответствия помещений и оборудования заданным требованиям при работе их в комплексе, но без выпуска продукции и при отсутствии персонала. По завершении этого этапа должна быть разработана и утверждена вся необходимая документация (инструкции, методики и другие документы по эксплуатации).
8.5. Аттестация в эксплуатируемом состоянии
Данный этап соответствует реальным условиям эксплуатации. При его выполнении проводятся испытания всех технологических процессов и оборудования с выпуском готовой продукции и при наличии персонала.
8.6. Помещения, оборудование и процессы, подлежащие аттестации
Аттестации подлежат помещения, оборудование и процессы, имеющие критические параметры. К ним, в первую очередь, относятся:
- чистые помещения и чистые зоны (ГОСТ Р ИСО 14644-4);
- процессы стерилизации (первичной упаковки, готовой продукции);
- процессы стерилизующей фильтрации в асептическом производстве;
- НЕРА фильтры, установленные в технологическом оборудовании;
- процессы лиофилизации;
- процессы обработки (очистки) поверхностей, соприкасающихся с продукцией;
- системы подготовки воды для инъекций и воды очищенной;
- процессы гомогенизации (обеспечения однородности продукции), при необходимости;
- процессы асептического наполнения (ГОСТ Р ИСО 13408-1);
- аналитические методы контроля, не содержащиеся в утвержденных нормативных документах;
- системы с компьютерным управлением и контролем, в том числе с использованием электронных подписей.
Аттестацию также следует проводить для других процессов и видов оборудования, влияющих на качество продукции.
При производстве специфических лекарственных средств следует определить критические параметры и процессы, а также провести их аттестацию. Например, при производстве медицинских иммунобиологических препаратов к критическим процессам относятся выращивание вирусов и микроорганизмов, их инактивация, выделение различных компонентов, очистка и пр.
Порядок проведения аттестации регламентируется программой аттестации, в которой указываются помещения, оборудование и процессы, подлежащие аттестации, с указанием состояний помещений (построенное, оснащенное или эксплуатируемое), работ, выполняемых при аттестации, и контролируемых параметров [2], [3].
9. Персонал
9.1. Общие положения
Персонал является критическим элементом в производстве, источником ошибок и загрязнений, приводящих к браку. Создание системы работы с персоналом является обязательным условием системы обеспечения качества.
Предприятие должно быть обеспечено достаточным числом персонала требуемой квалификации для производства продукции, обеспечения качества и работы инженерных, вспомогательных и других служб. Требования к персоналу приведены в ГОСТ Р 52249. Ниже даются дополнительные требования, связанные с непосредственным обеспечением качества продукции.
Общая схема работы с персоналом включает в себя следующие элементы:
- разработку и документальное оформление требований к персоналу;
- подбор и расстановку персонала;
- создание системы обучения персонала, включающей периодическую проверку знаний;
- аттестацию персонала;
- контроль выполнения персоналом требований инструкций;
- контроль состояния здоровья персонала (в необходимых случаях).
9.2. Требования к персоналу
Каждый работник предприятия должен иметь необходимую квалификацию, знать свои должностные обязанности и порядок их выполнения. Для этого следует документально оформить квалификационные требования к персоналу, ограничения на допуск к отдельным видам работ по состоянию здоровья, обязательства персонала по неукоснительному выполнению требований внутреннего распорядка и инструкций.
Права, обязанности и ответственность работника регламентируются должностными и другими инструкциями.
Каждый работник должен дать письменное обязательство выполнять требования документации и внутреннего распорядка в соответствии со своей должностной инструкцией и быть письменно предупрежден об ответственности за их нарушение.
На предприятии следует вести контроль нарушений требований внутреннего распорядка и инструкций с регистрацией замеченных нарушений.
9.3. Подготовка персонала
Каждый работник, занятый в производстве, складском хозяйстве, службе контроля качества, инженерных и вспомогательных службах, обеспечивающих выпуск лекарственных средств, должен иметь необходимое образование, специальную подготовку и опыт работы.
Наряду со специальной подготовкой особое внимание следует уделять обучению персонала работе в соответствии с ГОСТ Р 52249, знанию и выполнению должностных и других инструкций.
Обучение работе в соответствии с требованиями ГОСТ Р 52249 подразделяется на первоначальное и повторно-периодическое.
Целью первоначального обучения является подготовка персонала к выполнению обязанностей в полном объеме, а также формирование у каждого работника понимания:
- специфики производства лекарственных средств и их прямого влияния на безопасность (жизнь и здоровье) населения;
- необходимости гарантирования качества лекарственных средств за счет надлежащей организации и технологии производства;
- необходимости точного выполнения требований инструкций и других документов;
- личного влияния каждого работника на качество лекарственных средств;
- ответственности каждого работника за качество лекарственных средств.
Целью повторно-периодического обучения является постоянное поддержание и обновление знаний работников.
При внедрении новых технологий, оборудования, методик и пр. проводится специальное обучение.
При обнаружении несоответствий продукции или процессов установленным требованиям проводится внеочередное обучение.
На предприятии следует иметь подразделение (лицо), отвечающее за подготовку персонала, организацию обучения и проведение аттестации персонала. Следует разработать и документально оформить систему обучения персонала, включающую в себя требования к различным категориям работников, программы и графики обучения и порядок аттестации.
Программы обучения следует систематически пересматривать и обновлять с учетом развития предприятия, освоения новых видов продукции, технологических процессов и оборудования и изменения нормативных документов.
Первоначальное и повторно-периодическое обучение выполняются по отдельным программам.
Обучение может проводиться как силами предприятия, так и с привлечением сторонних организаций. На предприятии следует подготовить нескольких сотрудников, проводящих обучение по специальной программе, составленной с учетом требований ГОСТ Р 52249.
Сторонние преподаватели и консультанты должны иметь необходимую квалификацию и опыт работы. Следует регистрировать дату проведения занятий (консультаций), тему и данные о преподавателе или консультанте (имя, место работы, адрес, квалификацию).
Руководители и ведущие специалисты обязаны систематически повышать свою квалификацию, иметь общую подготовку по ГОСТ Р 52249 и знать последние достижения в своей области.
9.4. Аттестация персонала
Для подтверждения квалификации работников следует проводить их аттестацию (первоначальную и повторно-периодическую). Лица, не прошедшие обучение и аттестацию в установленном порядке, не допускаются к выполнению работ, связанных с производством и контролем качества лекарственных средств.
9.5. Обязанности персонала
Персонал обязан выполнять возложенные на него функции в соответствии с должностными инструкциями.
Особое внимание следует уделять персональной ответственности сотрудников за точное выполнение требований инструкций, правил поведения, личной гигиены, по поддержанию чистоты, обращению с технологической одеждой, входу и выходу в производственные и другие помещения. Передвижения персонала по предприятию ограничиваются пределами необходимости. В чистые помещения, склады, зоны карантинного хранения и аналогичные помещения допускаются только лица, работающие в них или выполняющие контрольные и обслуживающие функции. Иные лица допускаются только с письменного разрешения руководства предприятия.
9.6. Состояние здоровья персонала
Лица с признаками хронических заболеваний или явными повреждениями кожи, которые могут оказать отрицательное влияние на безопасность и качество продукции, не допускаются к работам, связанным с прямым контактом с исходными и упаковочными материалами, промежуточной и готовой продукцией до получения медицинского заключения.
В случае недомогания работник обязан поставить об этом в известность руководство.
10. Контроль исполнения
Контроль исполнения является важной частью системы обеспечения качества (приложение F). Предметом контроля исполнения являются входящие документы, приказы, распоряжения, поручения, протоколы заседаний, планы организационно-технических мероприятий и пр. (ГОСТ Р 6.30). Данные документы должны быть доведены до сведения всех исполнителей под расписку.
Контроль исполнения документов, связанных с обеспечением качества и безопасности продукции, обязателен. Порядок контроля приводится в специальном документе «Система управления документацией».
Каждый документ должен содержать:
- ясное изложение предмета, подлежащего контролю;
- исполнителя (исполнителей, соисполнителей) с указанием структурных подразделений;
- срок исполнения;
- данные о лице (подразделении), на которое возлагается контроль исполнения;
- данные о лице (подразделении), снимающем документ с контроля исполнения;
- форму отчета об исполнении (рассмотрение на следующем заседании или диспетчерском совещании, докладная записка и пр.).
Исполнители могут быть указаны в резолюции на документе.
Указанные документы образуют справочно-информационный банк данных по контролируемым документам.
11. Анализ рисков в критических точках
11.1. Общие положения
Основной целью обеспечения качества является предупреждение несоответствия продукции заданным требованиям и рекламаций на нее. Эффективным методом решения этой задачи является анализ рисков.
Под анализом рисков понимается метод оценки и влияния критических параметров оборудования и технологических процессов на качество продукции.
Анализ рисков в критических точках (критических контрольных точках) позволяет своевременно выявлять узкие места в производстве и ненадежные элементы в оборудовании.
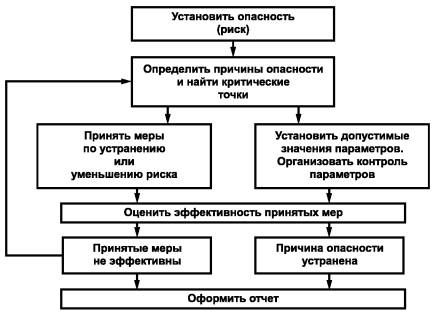
11.2. Основные этапы анализа рисков
Существует семь этапов проведения анализа рисков [4]:
1. Выполнение предварительных действий:
- установление наличия потенциальной опасности в какой-либо зоне (точке);
- оценка вероятности наступления опасной ситуации (качественно);
- предложение методов предотвращения опасной ситуации.
2. Определение критических точек окружающей среды (действия персонала, стадии технологического процесса), далее - найти критические точки, на которые следует обратить внимание, чтобы уменьшить опасность.
3. Установление допустимых значений параметров, приведение в соответствие которым уменьшит риск до приемлемого уровня.
4. Организация контроля параметров в точках риска с определенной периодичностью, позволяющей оценивать эффективность принятых мер и предупреждать опасность.
5. Разработка порядка действий на случай выхода параметров в критической точке за допустимые пределы, обеспечить возможность реализации этих действий (персоналом, материалами и оборудованием).
6. Оценка эффективности принятых мер.
7. Документальное оформление всех перечисленных действий и полученных результатов.
Работу по анализу рисков и предотвращению опасных ситуаций следует начинать с «наихудших случаев» и «наихудших точек», так как уменьшение риска в них даст наибольший и зримый эффект.
Анализ рисков носит циклический характер, направленный на систематическое повышение надежности всей производственной цепи. Схема работы приведена на рисунке 2.
Рисунок 2 - Схема работы по анализу рисков
11.3. Уровни значений параметров
В нормативной и технической документации задаются предельно допустимые значения параметров или пределы их изменения. Для своевременного обнаружения тенденции выхода параметров за допустимые значения и предупреждения опасной ситуации целесообразно установить два дополнительных уровня значений параметров:
- уровень предупреждения;
- уровень тревоги.
В критических точках следует контролировать параметры по обоим уровням.
Контроль может быть периодическим или непрерывным.
Для периодического контроля следует установить периодичность и методы его проведения и предусмотреть порядок оформления факта проведения контроля и полученных значений параметров.
Для непрерывного контроля следует определить порядок регистрации и хранения полученных значений параметров.
Следует предусмотреть меры, принимаемые в случае выхода параметров за пределы уровней предупреждения и действия.
12. Порядок внедрения системы обеспечения качества
Внедрение системы обеспечения качества в соответствии с ГОСТ Р 52249 требует организационно-технической подготовки, обучения персонала и апробации созданной системы. Эту работу следует проводить так, чтобы она была адекватно воспринята коллективом предприятия и не носила формального характера.
Внедрение системы обеспечения качества на производстве является длительным процессом, требующим приведения всего комплекса оборудования, помещений, документации, работы персонала в соответствие с ГОСТ Р 52249. Эта работа может быть разбита на этапы, исходя из того, что внедрение организационных мер на первом этапе не требует значительных капиталовложений и может быть реализовано в сжатые сроки. На втором этапе может быть предусмотрено комплексное техническое перевооружение производства.
Рекомендуемые этапы создания системы обеспечения качества приведены в приложении G.
13. Аудит и инспекции
Инспекции (инспектирование) выполняются надзорными органами с целью проверки соответствия производства требованиям ГОСТ Р 52249 и других нормативных документов.
Аудит - это проверка производства на соответствие требованиям ГОСТ Р 52249 и другим нормативным документам, выполняемая самим предприятием или независимой организацией. Аудит направлен на детальный анализ всех сторон деятельности предприятия, входящих в предмет аудита.
Различается внешний и внутренний аудит.
Внешний аудит выполняется независимой организацией. Результаты аудита можно использовать при проведении инспекций. Его проведение целесообразно также при подготовке предприятия к инспекции и получении независимой оценки организации производства, технологии и системы контроля качества.
Внутренний аудит (самоинспекция) выполняется самим предприятием с целью проверки выполнения требований ГОСТ Р 52249, других нормативных документов и принятия необходимых мер по устранению выявленных недостатков.
Аудит может выполняться органами по сертификации в пределах их области аккредитации с привлечением, при необходимости, аккредитованных Испытательных лабораторий для проверки соответствия установленным требованиям (аттестации) оборудования, чистых помещений и процессов.
Результаты аудита должны быть оформлены документально. По результатам аудита следует разработать программу организационно-технических мероприятий с указанием сроков выполнения и ответственных лиц по каждому мероприятию. После устранения выявленных недостатков оформляется соответствующий протокол.
Рекомендации по проведению аудита и инспекции в соответствии с Руководством ВОЗ [1] приведены в приложении H. При подготовке к аудиту и инспекции рекомендуется использовать контрольные вопросы согласно приложению I.
Приложение A
(справочное)
Информация о предприятии
«Информация о предприятии» - документ, подготовленный производителем и содержащий данные о производстве и (или) контроле лекарственных средств на предприятии (производстве), а также о любых связанных с ними операциях, выполняемых в соседних или близлежащих зданиях. Если в данном месте выполняется только часть операций, то в «Информации о предприятии» следует приводить только эти операции, например, проведение анализа, упаковка и пр. [1].
«Информация о предприятии» должна быть краткой (объемом не более 25 страниц).
A.1. Общая информация
A.1.1. Краткая информация о компании (предприятии), включая его название и адрес, взаимоотношения с другими предприятиями и данные о выпускаемой продукции.
A.1.2. Состав руководства предприятия.
A.1.3. Предмет деятельности предприятия в соответствии с лицензией на производство, выданной национальным органом.
A.1.4. Перечень всех других видов деятельности, выполняемых на производственной площадке.
A.1.5. Название и адрес производственной площадки, телефон, факс и круглосуточный телефон.
A.1.6. Номенклатура продукции, выпускаемой на производственной площадке. Информация о всех токсичных или опасных веществах с указанием особенностей работы с ними (в специально выделенных помещениях, зданиях, оборудовании или с разделением циклов производства во времени).
A.1.7. Краткое описание площадки: ее площадь, место расположения, непосредственное окружение (ситуационный план), наличие других производств на площадке.
A.1.8. Число работников, занятых в производстве, контроле качества, складском хозяйстве и реализации.
A.1.9. Данные о получаемых со стороны услугах научного, аналитического или технического характера, относящихся к производству и проведению анализов.
A.1.10. Краткое описание системы обеспечения качества.
A.2. Персонал
A.2.1. Организационная структура, на которой были бы показаны взаимосвязи в плане обеспечения качества, в том числе производство и контроль качества.
A.2.2. Данные о квалификации, опыте работы и ответственности основного персонала.
A.2.3. Основные данные о первоначальном и повторном обучении персонала и ведении документации по обучению.
A.2.4. Требования к состоянию здоровья производственного персонала.
A.2.5. Требования к гигиене персонала и его одежде.
A.3. Помещения и оборудование
A.3.1. Помещения
A.3.1.1. Упрощенная планировка или описание производственных зон с указанием масштаба (строительные чертежи и чертежи коммуникаций не требуются).
A.3.1.2. Тип строительных конструкций и отделочных материалов.
A.3.1.3. Краткое описание систем вентиляции с более детальными решениями для критических зон, обеспечивающими защиту от загрязнений, содержащихся в воздухе (рекомендуется приводить принципиальные схемы вентиляции и кондиционирования).
Для производства стерильных лекарственных средств следует указывать классификацию помещений по чистоте.
A.3.1.4. Зоны, где обращаются высокотоксичные, опасные и сенсибилизирующие вещества.
A.3.1.5. Краткое описание систем подготовки воды (желательны принципиальные схемы) с указанием методов обработки.
A.3.1.6. Данные о порядке планового технического обслуживания помещений и ведения документации по техническому обслуживанию.
A.3.2. Оборудование
A.3.2.1. Краткие данные об основном оборудовании, используемом в производстве и контрольных лабораториях (перечень оборудования не требуется).
A.3.2.2. Данные о порядке планового технического обслуживания оборудования и ведения документации по техническому обслуживанию.
A.3.2.3. Порядок аттестации и калибровки (поверки), в том числе оформление данных и ведение протоколов.
A.3.3. Уборка (обработка)
A.3.3.1. Наличие письменных инструкций по уборке (обработке) производственных помещений и оборудования.
A.4. Документация
A.4.1. Порядок разработки, пересмотра и распространения необходимой документации для производства.
A.4.2. Любая другая документация, относящаяся к качеству продукции, не упомянутая в других разделах (например, по микробиологическому контролю воздуха и воды).
A.5. Производство
A.5.1. Краткое описание производственных операций с использованием, по возможности, схем с указанием потоков материалов и пр. данных о наиболее важных параметрах.
A.5.2. Порядок обращения с исходными и упаковочными материалами, нерасфасованная продукция и готовая продукция, включая отбор проб, карантинное хранение, выпуск продукции и хранение.
A.5.3. Порядок обращения с отклоненными материалами и продукцией.
A.5.4. Краткие данные о порядке аттестации технологических процессов.
A.6. Контроль качества
A.6.1. Описание системы контроля качества и функций отдела контроля качества.
A.7. Работа по контрактам на производство продукции и проведение анализов
A.7.1. Данные о порядке проведения оценки соответствия требованиям ГОСТ Р 52249 со стороны заказчика.
A.8. Реализация, рекламации и отзыв продукции
A.8.1. Порядок реализации и система документации.
A.8.2. Инструкция, определяющая порядок действий при поступлении рекламаций.
A.8.3. Инструкция, определяющая порядок действий при отзыве продукции.
A.9. Внутренний аудит
A.9.1. Краткое описание системы внутреннего аудита (самоинспекций).
Приложение B
(справочное)
Политика в области качества
(Пример)
Цель нашей работы - гарантировать стабильное качество выпускаемых нами лекарственных средств, направить усилия всех наших сотрудников на достижение этой общей цели за счет выполнения требований Правил производства и контроля качества лекарственных средств (GMP), высокой исполнительской дисциплины, совершенствования производства и квалификации персонала, постоянного анализа выпускаемой продукции и технологических процессов.
Генеральный директор Ф. И. О.
Приложение C
(справочное)
Материалы
C.1. Прием материалов
C.1.1. При приеме материалов следует проверять:
- соответствие фактически поставленного материала накладной;
- соответствие накладной договору (заказу, спецификации);
- целостность тары (упаковки) и пломб (при их наличии);
- правильность маркировки;
- сроки годности (хранения материала).
C.1.2. Прием материалов оформляется документом, в котором указывается, как минимум, следующее:
- наименование материала;
- код материала (при необходимости);
- номер серии изготовителя материала;
- поставщик и изготовитель материала;
- дата приемки;
- количество материала;
- соответствие поставленного материала накладной и договору (при обнаружении несоответствия составляется акт);
- состояние упаковки (целостность).
C.1.3. После приема на каждую упакованную единицу материала наносится внутрипроизводственная этикетка, содержащая:
- наименование материала;
- код материала (при необходимости);
- дату приема;
- номер единицы тары и общее число единиц;
- количество материалов в единице тары;
- подпись приемщика;
- номер серии;
- статус материала (может обозначаться цветом этикетки).
Допускается нанесение штрихового кода на этикетку.
C.1.4. При поставке нескольких серий одного и того же материала каждая серия принимается отдельно с присвоением ей индивидуального номера, после чего проводится отбор проб, испытания и выдается разрешение на использование (или решение об отклонении).
C.1.5. К дальнейшей работе допускаются только материалы, соответствующие заказу и спецификациям, с неповрежденной упаковкой, четкой ненарушенной маркировкой и удовлетворяющие требованиям к срокам хранения. В противном случае материалы изолируются до принятия решения в отношении их.
C.1.6. Не допускается прием материалов под открытым небом и в складских помещениях, где существует возможность перепутывания и замены материалов, перекрестного загрязнения и пр.
C.2. Контроль качества исходных и упаковочных материалов
C.2.1. Отбор проб (образцов)
Персонал, выполняющий отбор проб, должен быть обучен и аттестован. Отбор проб выполняется в соответствии с инструкцией (методикой), утвержденной в установленном порядке. Идентичность пробы (соответствие пробы договору, заказу или спецификации) должна, как правило, проверяться для каждой единицы тары.
Отбор проб выполняется, как правило, в выделенных зонах. При отборе проб в складских зонах следует принимать специальные меры против прямого и перекрестного загрязнения материалов; при необходимости - меры по защите персонала. Эти меры могут включать использование чистых или изолированных зон.
Порядок отбора проб в соответствии с ГОСТ Р 52249 (подразделы 6.11 - 6.14) следует изложить в инструкции, которая определяет:
- метод отбора проб или ссылку на существующую методику;
- тару (контейнеры), в которую отбирают пробы;
- количественные характеристики пробы;
- оборудование и инвентарь для отбора проб;
- порядок маркирования контейнеров с пробами;
- порядок транспортирования и условия хранения проб;
- методы очистки (обработки) контейнеров, оборудования и инвентаря для отбора проб;
- специальные требования.
Маркировка (внутрипроизводственная этикетка) на контейнере с пробами должна содержать, как минимум, следующую информацию:
- наименование материала и его код;
- указание изготовителя материала;
- номер серии;
- дату отбора проб;
- подпись лица, отбиравшего пробу.
C.2.2. Карантинное хранение
В период проведения испытаний исходные материалы должны находиться в карантинном хранении. При необходимости может предусматриваться хранение различных серий материалов в раздельных зонах. Разделение может быть обеспечено также организационными мерами при условии обеспечения защиты от перепутывания и загрязнения. Доступ в зоны хранения материалов должен быть ограничен [ГОСТ Р 52249 (подраздел 3.21)].
Исходные материалы находятся в карантине до получения разрешения на их использование или документального оформления отклонения с определением действий в отношении данных материалов (возврат поставщику, утилизация и пр.).
C.2.3. Испытания (анализ проб или образцов)
Порядок проведения испытаний - по ГОСТ Р 52249 (подразделы 6.15 - 6.22).
При испытаниях проверяется соответствие материалов спецификациям по методикам, содержащимся в нормативных документах (стандартах, фармакопейных статьях и др.), при их отсутствии - по методикам, разработанным производителем или другими компетентными организациями.
При несоответствии результатов испытаний заданным требованиям следует провести расследование (анализ) причин отклонений (низкое качество материала, ошибки при испытаниях и др.).
Результаты испытаний и отбора всех проб, в том числе результаты причин отклонений (при наличии), оформляются документами (например, протоколами, заполняемыми рукописным способом или с применением технических средств).
C.2.4. Разрешение на применение материалов
При положительных результатах испытаний отдел контроля качества выдает разрешение на их применение.
В случае отрицательного результата испытаний отдел контроля качества оформляет решение об отклонении материала с последующим уведомлением поставщика, проводит анализ причин отклонения и разрабатывает меры по предотвращению повторных отклонений.
С.2.5. Хранение проб (образцов)
Число отобранных проб, требования к условиям хранения, срокам хранения, утилизации по истечении срока хранения должны быть определены инструкцией.
Следует хранить достаточное число проб, необходимое для выполнения полного объема испытаний исходных материалов, в течение установленного срока их годности плюс один год [ГОСТ Р 52249-2004 (подраздел 6.14)]. Условия хранения не должны допускать ухудшения свойств материалов в течение всего срока хранения.
Помещения для хранения должны соответствовать установленным требованиям. Допуск в них разрешается только определенным лицам.
C.3. Хранение материалов
Условия хранения материалов - по ГОСТ Р 52249. Следует контролировать срок годности материалов. В случае его превышения материал следует помещать в карантинное хранение с нанесением маркировки, отражающей его статус.
Не допускается хранение материалов на полу. Материалы различных серий должны быть разделены.
Выдача материалов в производство осуществляется после получения разрешения отдела контроля качества (с учетом срока годности). При выдаче материала в производство следует проверять его соответствие требованиям спецификаций, срок годности и соблюдение принципа «первым пришло - первым ушло».
Следует вести посерийный учет расхода материалов с регистрацией даты (времени) начала и окончания расходования серии.
Рекомендуется установить норму неснижаемого (минимального) запаса каждого вида материалов и организовать учет материалов на складах и порядок их выдачи.
Отклоненные исходные материалы следует изолировать.
C.4. Транспортирование материалов на предприятии
Транспортирование материалов выполняется в соответствии с инструкцией, определяющей средства и методы транспортирования, с соблюдением требований сохранности материалов и безопасности. Следует определить маршруты транспортирования материалов и лиц.
C.5. Аудит поставщиков
На предприятии следует иметь утвержденный перечень поставщиков всех используемых материалов. Приобретение материалов у поставщиков, не внесенных в данный перечень в установленном порядке, не допускается.
Аудит поставщика является важным и эффективным средством обеспечения качества исходных и упаковочных материалов. Следует уделять особое внимание аудиту поставщиков, которые не имеют многолетнего стажа безупречной работы. Перечень поставщиков составляется и утверждается по результатам аудита.
При проведении аудита следует провести анализ производства у поставщика и используемых им материалов.
Следует разработать политику взаимоотношений с поставщиками, в том числе наложение на них материальных санкций в случае поставки непригодных материалов, замену поставщиков и пр.
В случае отклонения и возврата поставленных материалов следует получить информацию о причинах, вызвавших отклонение, и мерах, принятых для их устранения.
Примечание - Систематический учет качества работы поставщиков следует организовать также при оказании ими различных услуг, например, по стирке одежды, ремонту оборудования и пр.
C.6. Договоры
Поставка исходных и упаковочных материалов оформляется договором (контрактом), в котором следует четко изложить требования к материалам со ссылкой на соответствующий нормативный документ. Следует документально оформить порядок подготовки договора с указанием согласовывающих лиц и последовательности согласования, а также предусмотреть порядок внесения изменений в договор.
Порядок подготовки и подписания договоров должен регламентироваться отдельной инструкцией, в которой указываются:
- перечень видов заключаемых договоров (поставка, услуги и пр.);
- информация о том, какие договоры готовит заказчик, какие - поставщик;
- примерные формы (образцы) договоров;
- лица, ответственные за подготовку договоров;
- лица, ответственные за согласование договоров и последовательность согласования;
- лица, подписывающие договоры;
- порядок внесения изменений в договоры;
- сроки подготовки и подписания договоров;
- порядок хранения договоров;
- порядок контроля выполнения договоров.
В договоре поставки следует предусматривать обязанность и ответственность поставщика о немедленном информировании заказчика о любых изменениях, связанных с производством материалов, в том числе об изменениях характеристик используемого сырья.
Заказчик должен своевременно информировать поставщика о предполагаемых изменениях требований и любых претензиях к материалам, их упаковке и устанавливать специальные требования к материалам и методам их контроля, согласовав их с поставщиком.
При необходимости возможна организация контроля материалов представителем заказчика на предприятии-поставщике.
В договоре следует указывать:
- наименование, число и вид тары и упаковки поставляемых материалов;
- изготовителя и поставщика материалов (если договор заключается не с изготовителем материалов);
- документ, требованиям которого материал должен соответствовать;
- требования безопасности;
- возможность проведения аудита у поставщика;
- санкции, применяемые к поставщику при невыполнении им обязательств.
Приложение D
(справочное)
Проработка заказов и организация их выполнения
D.1. Рекомендуется, при необходимости, определить форму заявки на поставку продукции, заполняемую покупателем, и форму договора (заказа) поставки.
При проработке заказа следует оценить возможность выполнения заказа в требуемый срок. С этой целью предусматривается проверка:
- наличия требуемой продукции в номенклатуре предприятия;
- фактической возможности выполнения заказа в требуемые сроки;
- наличия требуемой продукции на складе и в производстве;
- обеспеченности исходными и упаковочными материалами (при отсутствии продукции на складе) или возможности данного обеспечения;
- достаточности производственных и складских мощностей;
- готовности оборудования (наличие или подтверждение статуса «аттестовано» для всех критических технологических процессов и оборудования);
- поступления рекламаций на заявляемый вид продукции, необходимости установления и устранения причин брака до возобновления производства.
D.2. При необходимости может быть определен лист согласования, заполняемый подразделениями предприятия при рассмотрении заказа.
Главная цель при проработке заказа - подтверждение возможности выполнения заказа в установленные сроки с требуемым качеством.
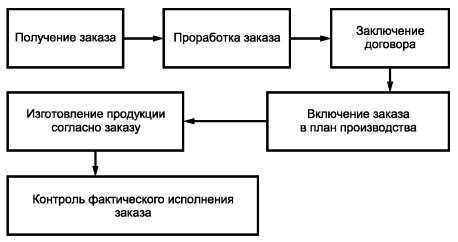
D.3. Рекомендуется разработать и наглядно представить схему исполнения заказа от его получения до отгрузки. Пример схемы приведен на рисунке D.1.
Рисунок D.1 - Схема исполнения заказа
Этап заключения договора может не включаться во внутрипроизводственный порядок работы.
Может быть предусмотрен контрольный лист исполнения заказа, в котором отражаются все этапы его выполнения.
Приложение E
(справочное)
Организация производства
E.1. Документация
E.1.2. Спецификации на исходные и упаковочные материалы, промежуточную и готовую продукцию и пр. разрабатываются в соответствии с требованиями ГОСТ Р 52249 и других нормативных документов.
E.1.3. Производственная и технологическая документация
Назначением данных видов документации является обеспечение выпуска продукции в строгом соответствии со спецификациями.
В состав производственной и технологической документации входят промышленные регламенты, технологические инструкции и инструкции по упаковке. Требования к промышленным регламентам, технологическим инструкциям и инструкциям по упаковке приведены в ГОСТ Р 52249 и других нормативных документах.
E.1.4. Протоколы на серию продукции
На каждую серию продукции составляется протокол с данными о подготовке и ходе производства этой серии, фактических значениях параметров технологического процесса и окружающей среды (в том числе данные мониторинга), выявленных отклонениях и разрешении на реализацию продукции.
Протоколы содержат данные о готовности помещений и оборудования к проведению технологического процесса, его фактическом выполнении, значениях контролируемых параметров и пр. Протоколы содержат историю изготовления серии продукции и используются в качестве доказательного материала в случае рекламаций, при анализе причин отклонений, проведении анализа рисков и пр.
На всех этапах ведения протокола следует проверять правильность его составления, наличие подписей ответственных лиц и работников отдела контроля качества.
Порядок ведения и проверки протокола на серию продукции должен быть определен специальным документом с указанием ответственных лиц.
Срок хранения протоколов - не менее одного года после окончания срока годности продукции, если не установлено иное.
E.2. Помещения, оборудование и технологические процессы
E.2.1. Помещения, оборудование и технологические процессы должны соответствовать своему назначению, требованиям ГОСТ Р 52249 и других нормативных документов. Помещения, оборудование и процессы, связанные с критическими параметрами, подлежат аттестации, которая проводится как на этапе подготовки производства (см. раздел 8), так и в эксплуатации (повторная аттестация после внесения изменений, связанных с критическими параметрами, длительными перерывами в работе, значительными отклонениями от условий эксплуатации и т.д.).
E.2.2. На предприятии следует организовать эксплуатацию и техническое обслуживание помещений и оборудования с ведением графиков и журналов технического обслуживания.
E.2.3. Следует предусмотреть периодический или непрерывный контроль критических параметров оборудования, технологических процессов и окружающей среды с установлением уровней предупреждения и действий.
E.2.4. Проведение обработки (очистки, дезинфекции, стерилизации) помещений и оборудования следует фиксировать в журналах, картах или других учетных документах с указанием даты и времени проведения обработки, наименования и номера серии продукции (при выпуске двух или более видов продукции), после производства которой проведена обработка.
Записи в журнале должны иметь две подписи: работника, выполняющего обработку, и контролирующего лица. Журнал следует вести в хронологическом порядке.
Данные об обработке критического оборудования следует приводить в протоколе серии продукции.
E.3. Маркирование (внутреннее этикетирование) в процессе производства
E.3.1. На предприятии должен быть установлен порядок обращения внутрипроизводственных этикеток и контроль за ними.
E.3.2. На этапе производства упаковка (производственная тара) с материалами, промежуточными или готовыми продуктами должна иметь два вида внутрипроизводственной маркировки (может наноситься на одну или разные этикетки) следующего содержания:
- обозначение или идентификацию материала или продукта (идентификационная этикетка);
- статус материала или продукта в производственной цепи (этикетка статуса).
В идентификационной этикетке указываются:
- наименование (код) материала или продукта;
- номер серии;
- дата нанесения этикетки (маркировки);
- подпись.
Этикетка статуса содержит информацию о том, где находится материал (продукт) или какую стадию в производственной цепи он прошел (например, «находится на карантинном хранении», «прошел карантинное хранение» и т.д.). На ней также следует указывать наименование (код) материала, номер серии и дату.
Информация о статусе может быть выделена цветом этикетки (например, зеленый - «Допущен к использованию», желтый - «Находится в карантинном хранении», красный - «Отклонен»).
E.3.3. Этикетки обоих видов должны наноситься на каждую упаковочную единицу. Они должны быть ясными и однозначными для понимания.
Данные об идентификации материала (продукта) и его статусе могут быть нанесены на одну и ту же этикетку.
E.3.4. Следует организовать учет внутрипроизводственных этикеток и их хранение так, чтобы избежать перепутывания и ошибочного нанесения. Следует документально определить порядок нанесения этикеток и лиц, ответственных за проведение данной операции.
E.3.5. Этикетки перед использованием следует проверить на предмет их соответствия назначению.
E.3.6. Неплотно прилегающие и поврежденные этикетки следует удалять и заменять на новые.
E.3.7. На упаковку (тару) с крышкой этикетка наносится только на корпус упаковки (не на крышку).
E.4. Внутрипроизводственный контроль
Целью внутрипроизводственного контроля является проверка соответствия критических параметров технологического процесса и показателей промежуточного продукта, находящегося на стадии производства, требованиям документации. Данный контроль выполняется производственным подразделением и позволяет своевременно предпринять корректирующие действия в процессе производства.
Для проведения внутрипроизводственного контроля следует предусмотреть необходимые помещения, персонал и оборудование.
Следует документально определить требования к контролируемым параметрам и меры, принимаемые при отклонении от допустимых значений.
Инструкции (методики) по проведению внутрипроизводственного контроля согласовываются отделом контроля качества.
Данные внутрипроизводственного контроля используются при анализе рисков и разработке мероприятий по обеспечению стабильного качества продукции.
E.5. Печатные материалы
E.5.1. Ввиду их ключевой роли в обеспечении подтверждения идентичности лекарственных средств следует обеспечить надежное и безопасное хранение, а также учет движения печатных материалов [ГОСТ Р 52249 (подраздел 3.25)].
E.5.2. По учету движения упаковочных материалов, в том числе промаркированных, на предприятии должен быть разработан отдельный документ, в котором отражается порядок передачи упаковочных материалов на всех этапах производства с указанием ответственных лиц. Лица, ответственные за учет движения этих материалов, назначаются приказом Руководителя.
E.5.3. Следует проверять баланс числа полученных, использованных и возвращенных этикеток для готовой продукции и баланс использованных этикеток и числа готовых единиц продукции. Следует анализировать и расследовать причины расхождения между полученными данными.
Баланс может не проводиться для рулонных или разрезных этикеток, если предусмотрен автоматический 100 %-ный контроль правильности нанесения этикеток.
Неиспользованные этикетки, содержащие номер серии готовой продукции, должны уничтожаться с составлением протокола.
Е.6. Материальный баланс
После завершения производства и упаковки серии продукции выполняется сопоставление теоретического и фактического выхода продукции. Сопоставление выполняется производственным подразделением. Последующие проверки проводятся, как правило, отделом контроля качества.
E.7. Работа с отклоненными материалами (продукцией)
E.7.1. Причины любого отклонения следует расследовать и разрабатывать мероприятия по предотвращению его повторения.
E.7.2. Работа с отклоненными материалами (продукцией) должна быть отражена в специальной инструкции, в которой указываются:
- критерии отклонения продукции или ссылка на эти критерии;
- порядок принятия решения в отношении отклоненных материалов (продукции);
- лица, принимающие решение об отклонении;
- действия с отклоненными материалами (продукцией) (возврат поставщику, повторная переработка, утилизация, получение разрешения на использование и пр.);
- маркирование и место хранения таких материалов (продукции).
E.7.3. Инструкция по действиям персонала в случае обнаружения несоответствий должна содержать:
- порядок регистрации несоответствий;
- порядок информирования вышестоящих лиц;
- меры по обеспечению соответствия перерабатываемой серии заданным требованиям.
Переработка отклоненных серий допускается только по разрешению отдела контроля качества согласно соответствующей документации и с принятием мер, обеспечивающих соответствие перерабатываемой серии заданным требованиям.
Должны быть сформулированы условия, при которых допускается переработка продукции.
E.7.4. Для хранения отклоненных материалов (продукции) должны быть предусмотрены специальные помещения (зоны). Для наглядности их следует выделить (например, цветом) и принять меры предосторожности от несанкционированного доступа в них.
E.7.5. Документацию по работе с отклоненными материалами и продукцией следует хранить в течение установленного периода времени, определенного системой управления документацией, действующей на предприятии.
E.8. Хранение продукции
Следует разработать требования к хранению продукции в соответствии с фармакопейной статьей, в том числе требования:
- к направлению в карантинное хранение до получения разрешения на реализацию;
- к условиям хранения, параметрам микроклимата, освещенности и пр., при которых гарантируется сохранность продукции без ухудшения ее свойств.
Другие требования - по ГОСТ Р 52249.
Приложение F
(справочное)
Порядок организации контроля исполнения
F.1. Контроль исполнения документов повышает уровень ответственности за выполняемую работу и направлен на своевременное и надлежащее исполнение документов, поступающих на предприятие и разработанных самим предприятием.
Отсутствие должного контроля исполнения приводит к следующему:
- утере документов;
- неисполнению документов в срок или неисполнению их вообще;
- неорганизованной работе исполнителей, в основном по методу «устранения отклонений» с элементами случайности и хаотичности;
- практической невозможности восстановить историю работы с документами и роль каждого из исполнителей.
F.2. Контроль исполнения может быть сплошным или выборочным.
Если на предприятии не предусмотрен сплошной контроль, то должен быть утвержден перечень документов, исполнение которых подлежит контролю.
F.3. Ответственным за исполнение документа (ответственным исполнителем) является лицо, указанное в перечне исполнителей (резолюции на входящем документе) первым. Ответственному исполнителю предоставляется право созыва соисполнителей.
Соисполнители обязаны предоставить ответственному исполнителю за установленный им период времени до истечения срока исполнения документа все материалы для обобщения и подготовки проекта соответствующего документа.
Соисполнители несут равную с исполнителем ответственность за своевременное и надлежащее исполнение документа.
F.4. Исполнение документа может быть разделено на этапы и составлен план-график, включающий в себя наименования этапов, исполнителей и сроки исполнения. План-график составляется исполнителем и утверждается лицом, контролирующим исполнение.
F.5. На предприятии должно быть назначено независимое лицо или структурное подразделение, осуществляющее учет исполнения и подчиняющееся непосредственно руководителю службы делопроизводства (руководителю информационной службы), руководителю службы качества или Руководителю предприятия. На предприятиях с небольшим объемом документации эти функции могут быть возложены на секретаря или другое лицо, связанное с делопроизводством.
В обязанности данного лица (подразделения) входит следующее:
- постановка документа на контроль;
- проверка своевременного доведения документа до исполнителей;
- предварительная проверка и регулирование процесса исполнения;
- оценка контроля (наблюдение) за процессом исполнения документа;
- снятие документа с контроля в установленном порядке;
- анализ исполнительской дисциплины отдельных лиц, подразделений и предприятия в целом, а также подготовка соответствующих материалов для руководства с целью принятия решений по управлению уровнем дисциплины;
- представление доклада руководству об исполнении документа.
Данное лицо (подразделение) работает совместно с лицами, ответственными за делопроизводство в других подразделениях организации.
F.6. Следует различать учет исполнения и контроль исполнения. При учете исполнения не оценивается, действительно ли документ исполнен, а лишь систематизируется работа по учету исполнения и проверяется правильность оформления документов.
Контроль исполнения осуществляется лицом (подразделением), способным оценить выполнение требований документа в полном объеме. В отдельных случаях функции учета и контроля исполнения могут быть совмещены и возложены на лицо (подразделение), осуществляющее контроль исполнения.
F.7. Копии документов, подлежащих контролю, должны быть своевременно выданы под расписку всем исполнителям и лицам (подразделению), осуществляющим контроль и учет исполнения.
F.8. Сроки исполнения документа исчисляются в календарных днях от даты поступления документа на предприятие или от даты подписания внутреннего документа, за исключением случаев, оговоренных законодательством или нормативно-правовыми актами. Сроки исполнения указываются Руководителем в резолюции на поступающем (внешнем) документе либо в тексте внутреннего документа.
F.9. На документах для контроля проставляется штамп «Контроль» в правом верхнем поле.
F.10. Поставленные на контроль документы вносятся в базу данных по контролю документов.
F.11. Если невозможно исполнить документ, то исполнитель должен заблаговременно обратиться с письменной просьбой о продлении срока исполнения к руководителю, устанавливающему срок исполнения, который и принимает решение об изменении срока исполнения.
Изменение срока исполнения оформляется документально, заносится в базу данных контроля документов и ставится на учет.
F.12. Приостановить исполнение документа, а также отменить его может только руководитель (орган), подписавший данный документ, либо вышестоящий Руководитель.
F.13. Следует разработать технологию контроля, позволяющую наглядно отслеживать процесс исполнения документов.
Могут использоваться следующие системы контроля [5], предусматривающие ведение:
- журнала контроля;
- контрольных карточек по каждому отдельному документу;
- контрольной картотеки, которая формируется из базы данных и содержит два раздела: контролируемый массив и исполненные документы.
При ведении контрольной картотеки ее первый раздел делится на 31 ячейку по числу дней месяца, на дополнительные ячейки для документов, срок исполнения которых наступит в следующих месяцах, и ячейки для документов, срок исполнения которых истек.
В ячейки могут вкладываться контрольные карты, в которых указываются наименование документа, его дата и номер, исполнители, лицо, ответственное за контроль, срок исполнения и отметки об исполнении. Второй раздел картотеки содержит сведения об исполненных документах.
Эффективной формой контроля является компьютерный учет исполнения документов. При этом напоминания исполнителям могут направляться по электронной почте.
Компьютеризация контрольных операций позволяет значительно увеличить объем контроля.
Для наглядности может быть оформлен стенд, отражающий исполнительскую дисциплину, либо, при наличии компьютерной сети, создается соответствующая программа, доступная всем пользователям данного предприятия.
F.14. Лицо, ответственное за учет исполнения, в течение трех - пяти дней до истечения срока направляет исполнителю извещение-напоминание.
F.15. После исполнения документ снимается с контроля. Решение о снятии принимается лицом, на которое возложен контроль. Решение оформляется отдельным документом (протоколом и пр.), а также делается подпись на контрольной карте и т.д.
В правом верхнем углу документа ставится штамп «Исполнено», вносятся соответствующие изменения в картотеку или в компьютерную базу данных, или проставляются отметки на контрольной карте. После этого документ отправляется на хранение.
F.16. Исполненные документы и данные об их исполнении должны храниться в течение установленного срока. Срок хранения устанавливается предприятием, но не может быть меньше срока хранения документации на серию продукции, выпущенной в тот же период времени.
Сохраняемые документы могут использоваться при анализе рисков в производстве, рекламаций и пр.
Допускается хранение документов на электронных носителях с соблюдением мер по обеспечению их сохранности.
Контроль по существу дает оценку, насколько правильно и полно решена задача.
Контроль сроков исполнения ведет служба делопроизводства. Основное назначение данного вида контроля - оперативное обнаружение первых признаков срыва исполнения документа, своевременное информирование об этом руководителя и, тем самым, создание условий для принятия надлежащих мер по предотвращению срыва намеченных мероприятий.
Приложение G
(справочное)
Этапы создания системы обеспечения качества
Таблица G.1 - Этапы создания системы обеспечения качества
|
Исполнитель |
Контролирующий отдел (лицо) |
|
|
1. Организационные меры по внедрению системы обеспечения качества |
||
|
1.1. Принятие решения о введении системы обеспечения качества. Издание приказа |
Руководитель предприятия |
- |
|
1.2. Формирование Совета GMP (комиссии, рабочей группы) по подготовке к введению системы обеспечения качества. Издание приказа |
- |
|
|
1.3. Разработка плана-графика подготовки к введению системы обеспечения качества. |
Совет GMP. |
Руководитель предприятия |
|
Утверждение плана-графика |
Руководитель предприятия |
|
|
1.4. Формулирование политики в области качества. |
Совет GMP. |
- |
|
Обсуждение политики и плана-графика в коллективе (подразделениях). |
Руководители подразделений. |
|
|
Утверждение политики в области качества |
Руководитель предприятия |
|
|
1.5. Разработка (оформление) организационной структуры предприятия |
Отдел обеспечения качества |
Совет GMP |
|
1.6. Разработка (сверка) технологических регламентов и всей технологической документации |
Отдел главного технолога |
Отдел обеспечения качества |
|
1.7. Разработка (сверка) всего комплекса инструкций и методик |
Руководители подразделений |
|
|
1.8. Отработка порядка ведения протоколов серий продукции (маршрутных карт) |
Производственный отдел |
|
|
1.9. Подготовка Руководства по качеству. |
Отдел обеспечения качества. |
Совет GMP |
|
Утверждение Руководства по качеству |
Руководитель предприятия |
|
|
1.10. Введение системы контроля исполнения |
- |
Отдел обеспечения качества |
|
1.11. Документальное оформление системы самоинспекций (внутреннего аудита) |
Отдел обеспечения качества |
Совет GMP |
|
1.12. Обучение персонала. Освоение персоналом комплекса документации и других элементов GMP |
Отдел подготовки персонала (обучения) |
Отдел обеспечения качества |
|
2. Комплексное техническое перевооружение производства |
||
|
2.1. Формулирование задания на перевооружение производства (задания на проектирование) |
- |
Руководство предприятия |
|
2.2. Разработка проекта |
- |
|
|
2.3. Аттестация и корректировка проекта (при необходимости) |
- |
|
|
2.4. Реализация проекта |
- |
|
|
2.5. Аттестация производства и его элементов в построенном, оснащенном и эксплуатируемом состояниях |
- |
Отдел обеспечения качества |
|
3. Аудит и подготовка к инспектированию |
||
|
3.1. Внешний аудит системы обеспечения качества |
Независимая организация |
Отдел обеспечения качества |
|
3.2. Корректировка по результатам аудита |
Отдел обеспечения качества, все подразделения |
Совет GMP |
|
3.3. Сертификация производства на соответствие требованиям ГОСТ Р 52249 |
Орган по сертификации |
Отдел обеспечения качества |
|
3.4. Представление Системы обеспечения качества надзорному органу (инспекции) |
- |
- |
|
Примечание - Председатель Совета GMP - руководитель предприятия. Заместитель председателя Совета - заместитель руководителя предприятия по качеству (директор по качеству). Заседания проводит председатель Совета, в исключительных случаях - его заместитель. |
||
Приложение H
(справочное)
Рекомендации по проведению аудита (инспекций) на соответствие требованиям ГОСТ Р 52249
Данные рекомендации соответствуют Руководству ВОЗ по инспектированию предприятий - производителей лекарственных средств [1], целью которого является гармонизация порядка проведения инспекций в странах - членах ВОЗ, и которое, также распространяется на следующие виды аудита:
- аудит, выполняемый независимой организацией или лицом для оценки системы обеспечения качества (в том числе при сертификации на соответствие требованиям ГОСТ Р 52249);
- внутренний аудит (самоинспекция) предприятия или его части, проводимые работниками самого предприятия;
- аудит поставщика по поручению заказчика (потребителя).
Рекомендации могут служить методической основой при подготовке предприятий к проведению аудита (инспекций).
В приложениях H и I вместо терминов «аудит (инспекции)» применяется термин «аудит», если излагаемый материал относится как к аудиту, так и к инспекции.
H.1. Задача аудита
Целью аудита является представление детального отчета о соответствии производства и контроля качества требованиям стандартов с учетом специфики выпускаемой продукции. Аудит не должен сводиться к составлению перечня недостатков, нарушений и несоответствий. По результатам аудита следует дать основные предложения по совершенствованию производства, соблюдая при этом условие конфиденциальности.
Аудит рассматривается как помощь в работе и стимул для производителя соответствовать требованиям ГОСТ Р 52249 и устранять имеющиеся недостатки.
H.2. Процесс аудита
Следует определить план проведения аудита и форму отчета. В зависимости от цели аудит может быть различным.
H.2.1. Аудит в полном объеме
Аудит выполняется в полном объеме по всем элементам, имеющим отношение к ГОСТ Р 52249 и лицензии. При этом следует указывать:
- является ли производство новым;
- требуется ли продление (обновление) или выдача новой лицензии;
- введены ли новые изменения в процессы производства, конструкции помещений, технологическое оборудование, состав персонала и пр.;
- обнаруженные несоответствия требованиям GMP;
- дату последнего аудита;
- устранены ли замечания по результатам предыдущего аудита.
H.2.2. Аудит в сокращенном объеме
Аудит в сокращенном объеме проводится для производств, в которых постоянное соответствие требованиям ГОСТ Р 52249 подтверждено предыдущими аудитами. При этом оценивается соответствие требованиям ГОСТ Р 52249, входящим в предмет аудита, и существенные изменения, появившиеся после последнего аудита. По полученным результатам определяется отношение предприятия к обеспечению качества. При обнаружении несоответствий требованиям ГОСТ Р 52249 проводится более детальный аудит.
H.2.3. Контроль по результатам аудита
Целью контроля по результатам аудита является проверка устранения обнаруженных недостатков. Как правило, контроль выполняется в период от шести недель до нескольких месяцев после аудита в зависимости от характера выявленных недостатков и выполнения разработанных мероприятий по их устранению. Контроль ограничивается специфическими требованиями ГОСТ Р 52249, которые были нарушены или не выполнялись.
Н.2.4. Специальный аудит
Специальный аудит проводится для контроля производства отдельных лекарственных средств из-за рекламаций или отзывов продукции, связанных с возможными дефектами. Информация о неблагоприятной реакции человека на действие лекарственных средств также может указывать на наличие возможных недостатков. Такой аудит может проводиться только для отдельного продукта, группы взаимосвязанных продуктов или отдельных операций, например, смешивания, стерилизации или маркирования.
Специальный аудит может проводиться для оценки процесса производства отдельного продукта.
Еще одной причиной для такого аудита может быть сбор специфической информации или анализ отдельных операций для выработки рекомендаций по выполнению производителем установленных требований.
H.2.5. Периодичность и продолжительность проведения аудита
Периодичность и продолжительность проведения аудита зависят от вида инспекции, объема работы и числа аудиторов.
Аудит рекомендуется проводить регулярно, в идеальном случае - ежегодно. Для крупных предприятий с большой номенклатурой продукции аудит может проводиться в виде нескольких посещений в течение более длительного периода времени, например пяти лет, если он равен сроку действия лицензии или сертификата на соответствие требованиям ГОСТ Р 52249.
Продолжительность проведения аудита зависит от размеров предприятия (производства) и цели аудита. Аудит может длиться от нескольких дней до двух и более недель. К аудиту при необходимости могут привлекаться специалисты различного профиля.
H.2.6. Подготовка к аудиту
Проведение аудита начинается с рассмотрения документов предприятия. В их состав могут входить:
- лицензия на производство;
- регистрационное досье;
- информация о предприятии;
- документы о рекламациях и отзывах продукции, результаты испытаний и отчеты о предыдущих аудитах.
Ценными источниками информации могут быть ежегодные отчеты для акционеров, данные о рекламациях, отчеты о проведении внутреннего аудита. Возможность представления данных документов определяется самим предприятием. В некоторых случаях предприятие представляет аудитору отчеты о проведении внутреннего аудита для общей информации после того, как он завершит свой собственный отчет. Как минимум, следует проверить периодичность проведения внутреннего аудита и перечень объектов на предприятии, на которых он проводился.
H.2.7. Проведение аудита
Аудит может проводиться для оценки новых предприятий и новых производственных линий, а также для принятия решения о продлении (о возобновлении действия) лицензии. О проведении планового аудита предприятие предупреждается заранее.
Аудит может проводиться в сокращенном объеме при проведении инспекционного контроля по результатам предыдущего аудита и в специальных случаях.
Проведение аудита начинается со встречи аудиторов с руководством предприятия и лицами, ответственными за выпуск продукции на данном участке. Следует предъявлять документы, удостоверяющие полномочие присутствующих лиц, и излагать цель проведения аудита.
Желательно, чтобы с аудиторами постоянно работал, по крайней мере, один представитель, непосредственно участвующий в производстве продукции на инспектируемом участке. Он должен знать систему обеспечения качества предприятия и участвовать в проведении внутренних аудитов.
После этого аудитор может проводить анализ документов или осмотр предприятия, или и то и другое. Это позволит ему выработать окончательный план проведения аудита. Рекомендуется, чтобы аудитор подготавливал и реализовывал этот план по своему усмотрению, а не следовал плану руководства предприятия.
Для проведения аудита существует несколько общих правил.
a). Аудит должен проводиться в соответствии с первоначальным планом, насколько это возможно. Специфические для данного производства действия, например внутрипроизводственный контроль и рабочая документация, могут проверяться в месте их выполнения. Следует обратить внимание на такие вопросы, как подготовка воды, хранение образцов и аттестация.
b). Рекомендуется проследить процесс производства от приема исходных материалов до отгрузки готовой продукции. Следует тщательно зафиксировать частоту отзывов и возврата продукции.
c). Требуется анализ таких документов, как промышленный регламент, методики испытаний, инструкции, протоколы серий (включая протоколы проведения анализов, документы по контролю печатных материалов и операций маркировки и пр.).
Аудитор может пользоваться кратким контрольным листом, чтобы проверить все необходимые вопросы. Подробные контрольные листы с высокой степенью детализации, разработанные на основе ГОСТ Р 52249, используются для обучения аудиторов. Опыт показывает, что жесткое следование слишком подробным контрольным листам может привести к пропуску существенных недостатков системы обеспечения качества, относящихся к специфическому направлению работы предприятия. Для опытного аудитора знание слабых мест предприятия и интуиция помогают больше, чем контрольные листы. Рекомендуемые контрольные листы приведены в таблицах I.7, I.8 (приложение I).
H.2.8. Программа испытаний на стабильность (проверка стабильности)
Следует убедиться, что существует программа регулярного отбора проб всех видов продукции с производственного участка для испытаний на стабильность. Методика испытаний на стабильность должна предусматривать такие стрессовые значения температуры и освещенности и аналитические методы оценки стабильности, которые позволят сделать вывод о стабильности продукции в течение установленного срока хранения. Программа должна предусматривать повторную оценку стабильности после любых изменений в процессе производства или составе лекарственного средства.
Следует регистрировать существенные изменения в помещениях, оборудовании, продукции и руководящем персонале после проведения последнего аудита. Эти изменения могут привести к отклонению от установленных требований и несоответствию ГОСТ Р 52249. Например, новое оборудование может потребовать разработки новых инструкций, новая технологическая линия может потребовать переработки документации на продукцию, приход нового руководителя отдела контроля качества может изменить стиль и методы работы.
Целесообразно предусматривать возможность выполнения видеосъемки при проведении аудита для получения документального свидетельства о состоянии производственных помещений или лабораторий.
Ситуационный план, а в некоторых случаях - материалы аэрофотосъемки, возможно с охватом прилегающей территории, могут быть получены от предприятия совместно с другими материалами, включаемыми в отчет.
H.2.9. Отбор проб
Обычной практикой инспектирования [1] является отбор проб для проведения испытаний в официально аккредитованной контрольной лаборатории. Как правило, пробы (образцы) отбирают из выпущенной в реализацию продукции, например со склада готовой продукции. Могут также отбираться пробы исходных материалов или промежуточной продукции. Для сохранения целостности пробу отбирают в соответствии с методикой отбора пробы и ее анализа. По результатам отбора оформляют документ, в котором указывается следующее:
- наименование продукции, пробы (образцы) которой взяты для анализа, номера серий, дата, место отбора проб, число проб и данные об упаковке и условиях хранения;
- сопутствующие факторы и условия, например, предполагаемые дефекты, текущий анализ, проверка соответствия требованиям ГОСТ Р 52249;
- указания по пломбированию контейнеров с пробами;
- письменное подтверждение приема проб аудитором (возможно, с сертификатом производителя с данными анализа и другими документами).
Представителю предприятия, сопровождающему аудитора, следует отбирать дублирующие пробы из той же серии для проведения испытаний в заводской лаборатории на случай возможных вопросов.
H.3. Отчет
Рекомендуется разделить отчет на четыре части: общая информация о компании и производственных помещениях, описание проведения аудита, сделанные замечания, выводы. Вспомогательные данные могут быть помещены в приложение (номенклатура выпускаемой продукции, организационная схема, годовой отчет о работе предприятия, фотографии и пр.).
Для экономии времени первая часть может быть представлена предприятием заранее. Аудитор, находясь на предприятии, проверяет правильность этих данных.
Во второй части отчета следует дать подробное и последовательное описание проведения аудита с указанием проверенных подразделений (склады, лаборатории) и рассмотренных документов предприятия (протоколы и пр.), а также привести данные об отобранных пробах и полученных результатах.
В третьей части приводятся замечания. Следует отразить изменения, улучшения или примеры ухудшения, произошедшие после предыдущего аудита.
Положительные наблюдения должны быть представлены в виде описания процессов, которые выполняются предприятием особенно хорошо и могут служить примерами успешного следования требованиям ГОСТ Р 52249.
При описании отрицательных фактов (замечаний) следует проводить различие, является ли недостаток свойством самой системы или он является следствием невыполнения требований, предусмотренных системой. Например, если обнаружена неудовлетворительная уборка (очистка), то важно установить, содержит ли ошибки инструкция по уборке (и существует ли она) или существующая инструкция не выполняется.
В завершающей части отчета следует привести перечень замечаний, недостатков и пр. в порядке убывания их значимости, дать рекомендации по совершенствованию работы и устранению недостатков. Третья и четвертая части должны быть рассмотрены с руководством предприятия и ответственными работниками на заключительной встрече по результатам проведения аудита.
Копия всего отчета с утверждающей подписью руководства совместно с сопроводительным письмом направляется руководству предприятия. Рекомендации по устранению недостатков и сроки устранения должны быть доведены до руководства предприятия.
До отъезда аудитора рекомендуется провести заключительную встречу с руководством предприятия. Аудитору следует изложить результаты своей работы, указать обнаруженные нарушения или другие данные.
Приложение I
(справочное)
Контрольные вопросы при аудите (проведении инспекции) производств
Контрольные вопросы при аудите производств на соответствие требованиям ГОСТ Р 52249 делятся на основные и дополнительные.
Основные контрольные вопросы, соответствующие новому подходу FDA США [2], приведены в таблицах I.1 - I.6, дополнительные вопросы - в таблицах I.7 - I.8.
Таблица I.1 - Система обеспечения качества
|
Контрольный вопрос |
Оценка |
Замечания |
||
|
Да |
Нет |
|||
|
1 |
Возложена ли на отдел контроля качества ответственность за рассмотрение и согласование всех документов по выпуску продукции, контролю и обеспечению качества с целью гарантирования соответствия продукции своему назначению? |
|
|
|
|
2 |
Возложена ли на отдел контроля качества ответственность за рассмотрение и согласование всех документов, относящихся к протоколам на серию? |
|
|
|
|
3 |
Существует ли инструкция по анализу продукции? |
|
|
|
|
4 |
Выполняется ли анализ производств не реже одного раза в год? |
|
|
|
|
5 |
Выполняется ли при оценке продукции анализ тенденций или другой информации о сериях каждого вида выпускаемой продукции? |
|
|
|
|
6 |
Существует ли инструкция по анализу качества и рассмотрению рекламаций? |
|
|
|
|
7 |
Выполняется ли оценка, насколько подробно ведется расследование и соответствующее документальное оформление рекламаций с учетом фактора времени? |
|
|
|
|
8 |
Видно ли при рассмотрении рекламаций, насколько эффективны корректирующие действия? |
|
|
|
|
9 |
Существует ли инструкция, позволяющая выявлять несоответствия и нарушения в процессе производства, включая требования к документальному оформлению, оценке и расследованию с учетом фактора времени, а также выполнению корректирующих действий и оценке их эффективности? |
|
|
|
|
10 |
Существует ли адекватная система контроля изменений в процессе производства или составе лекарственного средства, которая гарантирует, что изменения оформляются документально, оцениваются надлежащим образом (включая, при необходимости, проведение повторной аттестации) и их согласование (утверждение)? |
|
|
|
|
11 |
Существует ли инструкция по внесению изменений? |
|
|
|
|
12 |
Существует ли инструкция по переработке продукции? |
|
|
|
|
13 |
Регламентирует ли инструкция по переработке продукции: - оценку продукции, подлежащей переработке; - оценку изменения стабильности продукции и необходимости проведения аттестации; - рассмотрение и согласование программы переработки продукции и оценки результатов? |
|
|
|
|
14 |
Существует ли инструкция по отзыву продукции с рынка и работе с рекламациями? |
|
|
|
|
15 |
Оценивают ли при возврате или спасении продукции состояние продукции и причины этого? |
|
|
|
|
16 |
Расследуются ли надлежащим образом случаи возврата продукции и принимаются ли при необходимости корректирующие и предупредительные меры? |
|
|
|
|
17 |
Существует ли инструкция, требующая проведения расследования и принятия корректирующих и предупредительных мер при нарушении стабильности продукции? |
|
|
|
|
18 |
Существует ли инструкция, регламентирующая, когда следует поместить продукцию в карантин, как ее контролировать, и инструкция, определяющая место хранения продукции, предназначенной к выпуску или отклонению? |
|
|
|
|
19 |
Существует ли специально выделенная зона для карантинного хранения материалов, промежуточной и готовой продукции? |
|
|
|
|
20 |
Существует ли утвержденный план аттестации оборудования, помещений, вспомогательных систем, процессов, лабораторных методов и систем с компьютерным управлением? |
|
|
|
|
21 |
Существует ли система контроля проведения аттестации с присвоением статуса соответствующему элементу (например, аттестовано, повторно аттестовано, подлежит повторной аттестации и пр.)? |
|
|
|
|
22 |
Существует ли система (программа) обучения и аттестации персонала отделов обеспечения качества и контроля качества в соответствии с установленными критериями? |
|
|
|
|
Общие выводы по результатам проверки раздела «Система обеспечения качества»: _________________________________________________________________________ _________________________________________________________________________ _________________________________________________________________________ |
||||
Таблица I.2 - Помещения и оборудование
|
Контрольный вопрос |
Оценка |
Замечания |
||
|
Да |
Нет |
|||
|
1 |
Существуют ли планы помещений с нанесением оборудования, указанием чистых зон, потоков материалов, персонала, промежуточной и готовой продукции? |
|
|
|
|
2 |
Существуют ли принципиальные схемы вентиляции и кондиционирования воздуха с указанием расходов воздуха для каждого помещения, перепадов давления, классов чистоты и пр.? |
|
|
|
|
3 |
Обеспечивают ли планировочные решения и система вентиляции и кондиционирования воздуха требования отсутствия перекрестных загрязнений и перепутывания? |
|
|
|
|
4 |
Соответствуют ли установленным требованиям системы подготовки воды, сжатого воздуха и других технологических сред? |
|
|
|
|
5 |
Соответствуют ли установленным требованиям: - освещение; - питьевая вода; - комнаты гигиены и туалеты; - _____________________? |
|
|
|
|
6 |
Существует ли система допуска к применению и контролю средств против грызунов, фунгицидов, инсектицидов, моющих и дезинфицирующих средств? |
|
|
|
|
7 |
Существуют ли требования к аттестации оборудования в построенном и оснащенном состояниях? |
|
|
|
|
8 |
Соответствует ли оборудование, его размеры и расположение проекту и установленным требованиям? |
|
|
|
|
9 |
Соответствуют ли поверхности оборудования установленным требованиям (по реактивности, аддитивным и абсорбирующим свойствам)? |
|
|
|
|
10 |
Существует ли система допуска к применению и контроля смазочных материалов, жидкостей для систем охлаждения и замораживания? |
|
|
|
|
11 |
Существуют ли инструкции и графики очистки (обработки) и технического обслуживания помещений и оборудования? |
|
|
|
|
12 |
Аттестованы ли методы очистки оборудования для проверки удаления остатков материалов и неабсорбирования моющих средств? |
|
|
|
|
13 |
Выполнена ли аттестация, калибровка и организовано ли техническое обслуживание холодильников, холодных комнат и морозильников? |
|
|
|
|
14 |
Выполнена ли аттестация систем с компьютерным управлением, связанных с холодильниками и морозильниками, в том числе системы обеспечения безопасности? |
|
|
|
|
15 |
Существует ли система контроля изменений в оборудовании, проведение повторной аттестации? |
|
|
|
|
16 |
Существует ли система обучения и аттестации персонала (в том числе работающего по договорам), занятого уборкой (обработкой) помещений и оборудования, техническим обслуживанием и аттестацией? |
|
|
|
|
17 |
Выполнялась ли аттестация проекта? |
|
|
|
|
18 |
Откорректирован ли проект по результатам аттестации? |
|
|
|
|
19 |
Есть ли перечень критического оборудования, процессов? |
|
|
|
|
20 |
Существует ли программа аттестации помещений, оборудования и процессов? |
|
|
|
|
21 |
Проводилась ли аттестация помещений, оборудования и процессов в построенном, оснащенном и эксплуатируемом состояниях? |
|
|
|
|
Следует проверять протоколы аттестации, обращая особое внимание на следующее: кто, когда, по каким документам (инструкциям, стандартам и пр.) проводил аттестацию, какие приборы и оборудование использовались, соответствуют ли данные протоколов реальному оборудованию, нет ли противоречий в самих протоколах. Общие выводы по результатам проверки раздела «Помещения и оборудование»: _________________________________________________________________________ _________________________________________________________________________ _________________________________________________________________________ |
||||
Таблица I.3 - Материалы
|
Контрольный вопрос |
Оценка |
Замечания |
||
|
Да |
Нет |
|||
|
1 |
Выполняется ли надлежащая маркировка всех исходных материалов, упаковочных материалов, промежуточной и готовой продукции с нанесением наименования (кода), номера серии, срока годности и статуса (в плане качества)? |
|
|
|
|
2 |
Существует ли система учета и распределения всех материалов (включая упаковочные материалы, укупорочные средства и пр.), в том числе контроль по принципу: «первым пришло - первым ушло»? |
|
|
|
|
3 |
Соответствуют ли условия хранения установленным требованиям? |
|
|
|
|
4 |
Организовано ли карантинное хранение материалов до прохождения ими контроля до выпуска? |
|
|
|
|
5 |
Выполняется ли отбор представительных проб для проведения контроля? |
|
|
|
|
6 |
Выполняется ли хотя бы один специфический идентификационный тест для каждой серии материалов (компонентов)? |
|
|
|
|
7 |
Выполняется ли полное исследование отклоненных серий материалов, в том числе упаковочных и укупорочных материалов, и принимаются ли, при необходимости, корректирующие и предупреждающие действия? |
|
|
|
|
8 |
Существует ли система аттестации и контроля поставщиков? |
|
|
|
|
9 |
Выполняется ли подготовка вспомогательных материалов и технологических средств (например, воды, азота, сжатого воздуха) правильно разработанными, построенными и аттестованными системами, имеющими систему технического обслуживания? |
|
|
|
|
10 |
Испытаны (аттестованы) ли должным образом упаковочные и укупорочные материалы на предмет отсутствия их реактивности, аддитивных и абсорбирующих свойств по отношению к продукции? |
|
|
|
|
11 |
Существует ли система контроля изменений поставщиков материалов, качества и обращения материалов (методов транспортирования и хранения)? |
|
|
|
|
12 |
Ведется ли документация на реализацию готовой продукции с указанием номеров серии? |
|
|
|
|
13 |
Существует ли система обучения и аттестации персонала, занятого в обращении материалов? |
|
|
|
|
Общие выводы по результатам проверки раздела «Материалы»: _________________________________________________________________________ _________________________________________________________________________ _________________________________________________________________________ |
||||
Таблица I.4 - Производство
|
Контрольный вопрос |
Оценка |
Замечания |
||
|
Да |
Нет |
|||
|
1 |
Существует ли система внесения изменений, их контроля и аттестации? |
|
|
|
|
2 |
Обеспечивается ли должный контроль поступления в производство только специфицированных материалов? |
|
|
|
|
3 |
Действительно ли расчетный и фактический расходы материалов в производстве совпадают на 100 %? |
|
|
|
|
4 |
Выполнена ли должная идентификация оборудования в отношении содержания, номеров серий и статуса качества? |
|
|
|
|
5 |
Проводится ли аттестация процессов мойки, стерилизации и депирогенизации первичных упаковок и укупорочных материалов? |
|
|
|
|
6 |
Существуют ли образцы протоколов производства и контроля серий для всех выпускаемых видов продукции? |
|
|
|
|
7 |
Проводится ли сопоставление ожидаемого (расчетного) и фактического объемов произведенной продукции с документальным оформлением? |
|
|
|
|
8 |
Проводится ли расследование и устранение несоответствий в выходе продукции (ожидаемом и фактическом объемах продукции)? |
|
|
|
|
9 |
Составляются ли протоколы производства и контроля на каждую серию продукции? |
|
|
|
|
10 |
Существует ли временная диаграмма для поэтапного выполнения технологического процесса? |
|
|
|
|
11 |
Проводится ли внутрипроизводственный контроль, и оформляются ли его результаты? |
|
|
|
|
12 |
Существует ли процедура доведения показателей до требований спецификаций на промежуточную и готовую продукцию? |
|
|
|
|
13 |
Предусмотрены ли меры по предотвращению наличия нежелательных микроорганизмов в нестерильной продукции? |
|
|
|
|
14 |
Требуется ли выполнение подготовительных мероприятий перед началом производства (проверка и подготовка оборудования)? |
|
|
|
|
15 |
Ведутся ли журналы очистки и эксплуатации оборудования? |
|
|
|
|
16 |
Выполнена ли аттестация процессов и оборудования, в том числе систем с компьютерным управлением и средств автоматизации? |
|
|
|
|
17 |
Существует ли в производстве порядок внесения изменений, предусматривающий проведение повторной аттестации? |
|
|
|
|
18 |
Расследуются и устраняются ли противоречия и отклонения в процессе производства? |
|
|
|
|
19 |
Соответствует ли производственный персонал требованиям к внешнему виду, личной гигиены, поведению и пр.? |
|
|
|
|
20 |
Прошел ли производственный персонал официально предусмотренную подготовку и аттестацию для выполнения своих обязанностей? |
|
|
|
|
Общие выводы по результатам проверки раздела «Производство»: _________________________________________________________________________ _________________________________________________________________________ _________________________________________________________________________ |
||||
Таблица I.5 - Упаковка и маркировка
|
Контрольный вопрос |
Оценка |
Замечания |
||
|
Да |
Нет |
|||
|
1 |
Выполняется ли проверка правильности инструкций по упаковке и маркировке до начала производства? |
|
|
|
|
2 |
Существует ли система проверки того, что при упаковке и маркировке используется нужная серия нужного материала? |
|
|
|
|
3 |
Предусматривается ли контроль поступающих этикеток? |
|
|
|
|
4 |
Существует ли система контроля изменений в материалах для упаковки и маркировки? |
|
|
|
|
5 |
Существует ли система контроля изменений процесса упаковки и маркировки, предусматривает ли она проведение повторной аттестации? |
|
|
|
|
6 |
Существует ли необходимая зона с необходимыми мерами безопасности для хранения принятых и отклоненных этикеток и материалов для маркировки? |
|
|
|
|
7 |
Существует ли система возврата и контроля неиспользованных материалов для упаковки, этикеток и материалов для маркировки? |
|
|
|
|
8 |
Существует ли порядок, исключающий перепутывание этикеток, которые могут иметь близкие размеры, форму и цвет? |
|
|
|
|
9 |
Если разрезные этикетки для разных видов готовой продукции похожи, то предусмотрен ли 100 %-ный контроль электронными средствами, аттестованной системой контроля или с помощью линий специального оборудования? |
|
|
|
|
10 |
Существует ли запрет на групповую печать до тех пор, пока различия размеров, формы или цвета не будут ясными? |
|
|
|
|
11 |
Существует ли система контроля и идентификации упаковок (контейнеров), не имеющих маркировки, которые маркируются позже или имеют множественные индивидуальные этикетки? |
|
|
|
|
12 |
Составляются ли протоколы упаковки с приложением к ним образцов всех использованных этикеток? |
|
|
|
|
13 |
Существует ли система изготовления этикеток, проверки готовых этикеток и сопоставления их наличия и использования? |
|
|
|
|
14 |
Выполняется ли контроль маркированной готовой продукции? |
|
|
|
|
15 |
Существует ли надежный контроль номеров серий, в том числе уничтожение лишних этикеток с нанесенными номерами серий? |
|
|
|
|
16 |
Достаточно ли физическое (пространственное) разделение между различными линиями этикеток и упаковки, чтобы исключить перепутывание (в том числе разделение пакетов с документацией)? |
|
|
|
|
17 |
Выполняется ли контроль печатающего оборудования на предмет постоянства качества печати в ходе всего цикла печати? |
|
|
|
|
18 |
Проводятся ли полные проверки процессов с надлежащим документальным оформлением? |
|
|
|
|
19 |
Существует ли гарантия того, что сроки годности определены правильно и правильно нанесены на этикетки? |
|
|
|
|
20 |
Выполняются ли требования по защите упаковки от вскрытия? |
|
|
|
|
21 |
Проведена ли аттестация процессов упаковки и маркировки, в том числе аттестация выполнения требований безопасности систем с компьютерным управлением? |
|
|
|
|
22 |
Расследуются и устраняются ли противоречия и отклонения в процессе производства и упаковки и принимаются ли корректирующие и предупредительные меры? |
|
|
|
|
23 |
Прошел ли персонал официально предусмотренную подготовку и аттестацию для выполнения своих обязанностей? |
|
|
|
|
Общие выводы по результатам проверки раздела «Упаковка и маркировка»: _________________________________________________________________________ _________________________________________________________________________ _________________________________________________________________________ |
||||
Таблица I.6 - Контроль работы лабораторий
|
Контрольный вопрос |
Оценка |
Замечания |
||
|
Да |
Нет |
|||
|
1 |
Работает ли лаборатория надлежащим образом (следует проверить порядок проведения контроля исходных материалов, внутрипроизводственного контроля, готовой продукции, контроля стабильности, объем проверяемых серий, ведение документации, количество тестов для одной серии, организационную структуру и пр.)? |
|
|
|
|
2 |
Соответствуют ли помещения и оборудование своему назначению? |
|
|
|
|
3 |
Соответствует ли порядок технического обслуживания и калибровки приборов и оборудования установленным требованиям? |
|
|
|
|
4 |
Выполнена ли аттестация систем с компьютерным управлением и автоматизированного оборудования? |
|
|
|
|
5 |
Есть ли в наличии необходимые стандарты; выполняются ли тесты в соответствии с действующими стандартами? |
|
|
|
|
6 |
Выполняется ли аттестация методов хроматографии? |
|
|
|
|
7 |
Используются ли соответствующие требованиям спецификации и стандарты для оценки приемлемости результатов? |
|
|
|
|
8 |
Соответствует ли план отбора проб установленным требованиям? |
|
|
|
|
9 |
Существуют ли способы анализа утвержденных документов и реализуются ли они в действительности? |
|
|
|
|
10 |
Существует ли порядок проведения аттестации аналитических методов? |
|
|
|
|
11 |
Существует ли система контроля предлагаемых и утвержденных изменений в работе лаборатории? |
|
|
|
|
12 |
Все ли тесты выполняются на правильно отобранных пробах? |
|
|
|
|
13 |
Расследуются и устраняются ли противоречия и отклонения и принимаются ли корректирующие и предупредительные меры? |
|
|
|
|
14 |
Являются ли аналитические протоколы проведения тестов и выводы по ним полными? |
|
|
|
|
15 |
Хранятся ли данные в систематизированном и аккуратном виде и легковоспроизводимой форме? |
|
|
|
|
16 |
Соответствуют ли выводы по результатам контроля первичным данным? |
|
|
|
|
17 |
Существует ли инструкция по анализу результатов, выходящих за требования спецификаций и своевременно ли выполняются расследования? |
|
|
|
|
18 |
Сохраняются ли образцы для арбитражного и пр. контроля? |
|
|
|
|
19 |
Оформляется ли соответствующим образом документация на испытания сохраняемых образцов? |
|
|
|
|
20 |
Существует ли приемлемая программа тестов на стабильность? |
|
|
|
|
21 |
Способна ли лаборатория показать, что методы контроля стабильности действительно проверяют стабильность? |
|
|
|
|
Общие выводы по результатам проверки раздела «Контроль работы лабораторий» _________________________________________________________________________ _________________________________________________________________________ _________________________________________________________________________ |
||||
Контрольные вопросы для отдельных участков
В таблицах I.7 и I.8 приводится пример общих и контрольных вопросов для отдельных участков.
Для конкретного производства рекомендуется разрабатывать аналогичные вопросы, которые могут быть использованы при внутреннем аудите (самоинспекции).
Следует проверить наличие и содержание:
- технологических регламентов на каждый процесс и фактическое их выполнение в производстве по основным операциям, фактическое соответствие помещений, оборудования, контрольно-измерительных приборов, персонала (по квалификации и численности) и т.д.;
- спецификаций и соответствие фактически используемых материалов спецификациям (выборочно);
- инструкций, возможность реализации указанных в инструкции действий (материалами, оборудованием, обученным персоналом);
- норм расхода дезсредств, одежды и пр.;
- соответствия расхода дезсредств, одежды по бухгалтерии и нормам (инструкциям);
- выполнения отдельных работ по контрактам (например, стирки и стерилизации одежды) - способность подрядчика выполнить эти работы и фактическое их выполнение по договорам (бухгалтерия).
Таблица I.7 - Контрольный лист для производственного участка и участка фасовки
|
Контрольный вопрос |
Оценка |
Замечания |
||
|
Да |
Нет |
|||
|
Персонал. Обучение |
||||
|
1 |
Существует ли специально подготовленная для производства и утвержденная программа обучения персонала? Представить план на 200__ год, наличие текстов лекций |
|
|
|
|
2 |
Указано ли число персонала, в том числе: - инженерно-технические работники; - рабочие? |
|
|
|
|
3 |
Имеется ли документ, в котором указан номенклатурный перечень выпускаемой продукции с указанием активных субстанций? |
|
|
|
|
4 |
Имеется ли в наличии положение о производственном подразделении и его взаимодействии с другими подразделениями предприятия? |
|
|
|
|
5 |
Имеются ли в наличии должностные инструкции и инструкции по рабочим местам? |
|
|
|
|
6 |
Имеется ли в наличии документированный порядок поведения персонала (в том числе посетителей) на производстве (порядок входа-выхода, переодевания, гигиены и пр.)? |
|
|
|
|
7 |
Обеспечен ли технологической одеждой производственный персонал? |
|
|
|
|
8 |
Имеется ли документированный и утвержденный порядок использования технологической одежды в зависимости от производственных зон? |
|
|
|
|
9 |
Имеется ли документированный порядок подготовки и стирки спецодежды, а также периодичность ее замены? |
|
|
|
|
10 |
Документируется ли проведение обучения, и каким образом? |
|
|
|
|
11 |
Контролируется ли усвоение знаний? С какой периодичностью? Имеются ли документы, подтверждающие проведение обучения? |
|
|
|
|
12 |
Проводится ли обучение по инструкциям, методикам, процедурам? Как это документируется? |
|
|
|
|
13 |
Проводится ли инструктаж по технике безопасности, их регулярность и наличие протоколов? |
|
|
|
|
14 |
Укомплектовано ли производство персоналом соответствующего уровня профессиональной подготовки? |
|
|
|
|
15 |
Проходит ли весь персонал медицинское обследование при поступлении на работу и регулярные медицинские осмотры в процессе работы? |
|
|
|
|
16 |
Выполняются ли правила и предписания по личной гигиене и организации питания? |
|
|
|
|
Сведения о производственных помещениях |
||||
|
17 |
Имеется ли схема расположения помещений с указанием классифицируемых и контролируемых? Имеется ли четкая маркировка помещений? |
|
|
|
|
18 |
Используются ли помещения исключительно в соответствии с предусмотренными целями? Исключается ли использование производственных помещений и оборудования предприятия для производства нелекарственных средств? |
|
|
|
|
19 |
Обеспечивает ли планировка производственных помещений: - поточность процесса с кратчайшими расстояниями между всеми технологически связанными помещениями; - исключение взаимопересечения путей следования персонала, а также пересечения технологических потоков и персонала; - максимальную группировку помещений с одинаковой степенью чистоты; - рациональное размещение оборудования и материалов для предотвращения смешивания различных видов и серий исходного сырья, упаковочных материалов, полупродуктов и готовых лекарственных средств; - полное соблюдение условий санитарно-гигиенического режима; - исключение использования производственных и санитарно-бытовых помещений для прохода персонала, не работающего в них; - защиту исходного сырья, упаковочных и маркировочных материалов, полупродуктов и готовых лекарственных средств от загрязнения при перемещении внутри здания; - соблюдение норм и правил техники безопасности и пожарной безопасности? |
|
|
|
|
20 |
Соответствует ли нормам: - освещение; - отопление; - вентиляция; - снабжение электроэнергией, водой? |
|
|
|
|
21 |
Проведена ли соответствующим образом маркировка трубопроводов? Указано ли направление потоков? Проводится ли санитарная обработка? |
|
|
|
|
22 |
Соответствует ли система вентиляции и кондиционирования воздуха предъявляемым требованиям? Проводятся ли регулярные проверки эффективности работы воздушных фильтров? Ведется учет замены фильтров? Какими документами оформляется? |
|
|
|
|
23 |
Обособлено ли помещение для проведения взвешиваний? |
|
|
|
|
Сведения о технологическом оборудовании |
||||
|
24 |
Имеется ли документ, в котором указан перечень технологического оборудования с указанием заводских номеров? |
|
|
|
|
25 |
Соответствует ли оборудование заданным целям? |
|
|
|
|
26 |
Имеются ли регистрационные документы на каждую единицу оборудования? |
|
|
|
|
27 |
Техническое обслуживание оборудования проводится: - на производственной территории; - вне производственной территории? |
|
|
|
|
28 |
Имеются ли инструкции, регламентирующие: - порядок эксплуатации оборудования; - порядок обслуживания оборудования; - порядок очистки оборудования? |
|
|
|
|
29 |
Имеются ли документы, подтверждающие проведение: - очистки оборудования; - подготовки к производственному процессу; - профилактики; - ремонта? |
|
|
|
|
30 |
Имеются ли графики и инструкции по техническому обслуживанию? |
|
|
|
|
31 |
Осуществляется ли чистка оборудования по окончании производственного процесса в соответствии с требованиями? Делается ли запись об очистке оборудования при переходе: - от одной серии к другой; - от одного продукта к другому? |
|
|
|
|
32 |
Какой метод применяется для контроля чистоты: - химический; - микробиологический? |
|
|
|
|
33 |
Осуществляется ли уборка помещений в соответствии с предписаниями? |
|
|
|
|
34 |
Как проводятся мероприятия по предупреждению появления грызунов и насекомых? Осуществляется ли регистрация данных? |
|
|
|
|
35 |
Проводится ли мониторинг микробиологической чистоты производственной среды? |
|
|
|
|
36 |
Осуществляется ли контроль воды: - питьевой; - очищенной? |
|
|
|
|
37 |
Соответствует ли требованиям система идентификации и маркировки оборудования этикетками статуса? |
|
|
|
|
38 |
Проводится ли контроль параметров работы оборудования в процессе производства (внутрипроизводственный контроль)? |
|
|
|
|
Приборы |
||||
|
39 |
Имеется ли график поверки средств измерений? |
|
|
|
|
40 |
Имеются ли инструкции по уходу и техническому обслуживанию приборов? Находятся ли они около приборов? |
|
|
|
|
41 |
Регламентирует ли инструкция следующие аспекты: - периодичность проверки; - способ и периодичность проведения калибровки; - данные о специалисте, проводящем калибровку; - предписания по документированию калибровки; - данные о параметрах, подлежащих проверке; - данные о тестовых материалах, используемых при проверке; - действия, принимаемые при выявлении несоответствий? |
|
|
|
|
42 |
Имеются ли документы, подтверждающие проведение калибровки? |
|
|
|
|
43 |
Регистрируются ли в журнале технического обслуживания: - факты повреждения/неисправности прибора; - процесс использования и техобслуживания приборов; - данные по обязательному контролю; - оценка технического состояния прибора? |
|
|
|
|
44 |
Имеются ли средства пожаротушения? |
|
|
|
|
Документация |
||||
|
45 |
Имеются ли в наличии технологические регламенты, технологические инструкции, другие инструкции и методики по всей выпускаемой продукции? |
|
|
|
|
46 |
Имеются ли документы, устанавливающие: - порядок проведения основных технологических стадий; - формы регистрации (документирования) проведения основных стадий технологического процесса; - порядок и формы документирования проведения вспомогательных технологических стадий; - документированный порядок проведения санитарной обработки помещений; - формы регистрации проведения уборки помещения; - порядок проведения межоперационного или постадийного контроля; - формы документирования (регистрации) проведения внутрипроизводственного контроля; - порядок проведения мониторинга состояния производственных помещений; - формы регистрации (документирования) процесса мониторинга производственных помещений; - порядок предъявления на контроль полупродукта или готового продукта; - документированный порядок составления и предъявления на контроль протокола на выпускаемую серию сырья, материалов и готовой продукции? |
|
|
|
|
47 |
Имеются ли в наличии документы, устанавливающие порядок обозначения, маркировки этикетками статуса, инвентаризации приборов и оборудования? |
|
|
|
|
48 |
Существует ли порядок присвоения оборудованию производственных номеров и регистрация присвоенных номеров? |
|
|
|
|
49 |
Разработан ли для несоответствующих по качеству материалов: - порядок выяснения причин несоответствия материала и его документирование; - порядок и правила по дальнейшей переработке или утилизации материалов, правила складского карантина? |
|
|
|
|
50 |
Каким образом оформляется предписание по чистке оборудования, приборов и иных технических средств? |
|
|
|
|
51 |
Имеются ли инструкции по уборке, санитарной обработке? Каков порядок документирования процессов уборки? |
|
|
|
|
52 |
Имеется ли карта использования дезинфицирующих средств, проводится ли документирование регулярности смены дезинфицирующих средств? |
|
|
|
|
53 |
Подготовлен ли отчет о производстве и формировании серии готовой продукции, содержащий: - описание всего процесса упаковки в соответствии с инструкцией по упаковке; - наименование и форму представления; - дату изготовления; - номер серии готовой продукции; - число единиц упакованной продукции; - записи о контроле процесса упаковки и его результатах; - результаты контроля и наличие разрешения отдела контроля качества на каждую критическую операцию в технологическом процессе; - одобренный образец упаковки и маркировки; - подпись лица, ответственного за производство, с указанием даты; - полный отчет о результатах анализа; - запись о возможности выпуска данной серии готовой продукции в свободное обращение? |
|
|
|
|
54 |
Разработана ли программа микробиологического мониторинга чистоты производства? Установлен ли порядок документирования? Намечены ли мероприятия в случае получения несоответствующих результатов? |
|
|
|
|
55 |
Имеется ли документированный порядок отбора проб (образцов) внутри производства и порядок их доставки на место обследования? |
|
|
|
|
56 |
Существует ли регистрация результатов исследования образцов в лаборатории, порядок передачи и документирования результатов анализа? |
|
|
|
|
57 |
Осуществляется ли процесс производства в строгом соответствии с технологическим регламентом? |
|
|
|
|
58 |
Соблюдаются ли соответствующие санитарные и гигиенические нормы, а также техника безопасности при проведении работ с сырьем? |
|
|
|
|
59 |
Имеется ли в наличии инструкция и соблюдается ли порядок выдачи сырья на производство на основании соответствующей документации и разрешения отдела контроля качества? |
|
|
|
|
60 |
Соблюдается ли очередность использования сырья? |
|
|
|
|
61 |
Обеспечиваются ли меры профилактики вторичного загрязнения в процессе доставки сырья на производственный участок? |
|
|
|
|
62 |
Подвергаются ли проверке на микробную загрязненность все компоненты, входящие в состав нестерильных лекарственных средств? |
|
|
|
|
63 |
Имеются ли инструкции по обращению с материалами первичной упаковки, гарантирующие требуемый уровень их чистоты по механическому и микробному загрязнению? |
|
|
|
|
64 |
Предусмотрены ли специальные устройства (приспособления, контейнеры), исключающие возможность вторичного загрязнения или смешивания подготовленных материалов первичной упаковки при их транспортировании из одного помещения в другое? |
|
|
|
|
65 |
Проводится ли на производстве модернизация и совершенствование процесса производства? |
|
|
|
|
66 |
Регистрируются ли на производстве любые изменения в технологическом процессе и любые отклонения в ходе проведения производственной операции? |
|
|
|
|
67 |
Составляется ли протокол на каждую серию готового лекарственного средства? |
|
|
|
|
68 |
Имеется ли на производстве четкая регламентация использования остатков продукта от серии, включения их в последующие серии? |
|
|
|
|
69 |
Проводится ли переработка забракованного продукта? Оформляется ли разрешение отдела контроля качества? Как документируется переработка забракованного продукта? |
|
|
|
|
70 |
Ведется ли письменный учет и контроль за промаркированными упаковочными материалами (с нанесенным номером серии)? Как контролируется и документируется соотношение израсходованного упаковочного материала и числа единиц выпущенного продукта? Как выясняется причина расхождения такого соотношения и проводится анализ? |
|
|
|
|
Аттестация |
||||
|
71 |
Имеются ли инструкции по аттестации технологических процессов и процессов очистки, а также протоколы проведенных аттестаций? |
|
|
|
|
72 |
Имеются ли документы (инструкции, методики), устанавливающие: - порядок проведения процесса аттестации оборудования; - порядок проведения аттестации технологических процессов? |
|
|
|
|
73 |
Имеются ли документы, подтверждающие проведение всех этапов аттестации технологического и инженерного оборудования, участвующего в производстве или обеспечивающие его, а также аттестации чистых помещений (протоколы IQ, OQ, PQ)? |
|
|
|
|
74 |
Имеются ли документы (протоколы), подтверждающие проведение аттестации критических процессов производства? |
|
|
|
|
Другие вопросы |
||||
|
75 |
Поступали ли на произведенную продукцию: - рекламации со стороны потребителей; - претензии административных и надзорных органов; - требования по ее изъятию со стороны государственных органов; - отказы в проведении обязательной сертификации по причине несоответствия качества? |
|
|
|
|
76 |
После проведенного внутреннего аудита (самоинспекции) были ли приняты меры и проведены корректирующие мероприятия по устранению замечаний? |
|
|
|
|
Руководитель группы внутреннего аудита: ОЗНАКОМЛЕН Члены комиссии: Руководитель контролируемого подразделения: |
||||
Таблица I.8 - Контрольный лист для склада
|
Контрольный вопрос |
Оценка |
Замечания |
||
|
Да |
Нет |
|||
|
|
Организация, структура |
|
|
|
|
1 |
Существует ли схема организационной структуры? |
|
|
|
|
2 |
Имеются ли в наличии индивидуальные должностные инструкции на каждого специалиста с указанием обязанностей и ответственности сотрудников? |
|
|
|
|
3 |
Имеется ли список и образцы подписей сотрудников? |
|
|
|
|
4 |
Достаточное ли количество персонала на всех операциях (где и сколько не хватает)? Были ли изменения в личном составе? |
|
|
|
|
5 |
Существуют ли инструкции, регламентирующие индивидуальную гигиену, правила по поддержанию чистоты? Отведены ли места для приема пищи, курения? |
|
|
|
|
6 |
Используются ли средства индивидуальной защиты? |
|
|
|
|
7 |
Проводится ли медицинский осмотр персонала с точки зрения пригодности к работе? Принимались ли меры в случае неудовлетворительных результатов? |
|
|
|
|
|
Обучение |
|
|
|
|
8 |
Имеется ли в наличии утвержденная годовая программа обучения, в том числе по вопросам требований ГОСТ Р 52249? |
|
|
|
|
9 |
Имеются ли листы учета индивидуального обучения сотрудников? |
|
|
|
|
10 |
Контролируется ли усвоение знаний? С какой периодичностью? |
|
|
|
|
11 |
Проводится ли инструктаж по технике безопасности? С какой регулярностью? Имеются ли протоколы? |
|
|
|
|
Помещения складских зон, оборудование, приборы |
||||
|
12 |
Имеются ли на предприятии складские зоны, обеспечивающие специальные условия хранения (температуру, влажность)? |
|
|
|
|
13 |
Проводится ли мониторинг условий складского хранения (температурного режима, влажности воздуха)? |
|
|
|
|
14 |
Имеются ли в наличии измерительные средства, приборы, весы? Каким образом осуществляется порядок контроля, калибровки, технического обслуживания: - обозначением, этикетированием, порядком присвоения номера; - системой нумерации на складе; - ведением журналов приборов и измерительных средств? Имеется ли программа технического обслуживания: годовые, ежемесячные, еженедельные, ежедневное техобслуживание? Документируется ли все надлежащим образом? |
|
|
|
|
15 |
Имеются ли складские инструкции по работе складов, включая схему складирования и обращения материала? Разработан ли порядок обращения с ними? Надлежащим ли образом хранятся инструкции? Каким образом ведется складской учет: - на листах учета; - в компьютерной системе? Надлежащим ли образом хранятся документы? Имеется ли инструкция по транспортировке материалов? Осуществляется ли документирование поступления и движения продукции и упаковочных материалов? Имеются ли записи отдела контроля качества о проверке соответствия сырья, полуфабрикатов и упаковочных материалов перед выдачей в производство? Ведется ли письменный учет продукции, материалов, упаковки и этикетирования (выдача и возврат остатков)? Имеются ли в наличии все аналитические листы, паспорта и сертификаты соответствия на освобожденные лекарственные средства, сырье, упаковочные материалы? Разработан ли порядок документирования отбора образцов внутри склада, учет образцов, документирование? Осуществляется ли документирование результатов обследований и предписаний? |
|
|
|
|
16 |
Соблюдается ли порядок уборки складских помещений? Осуществляется ли документирование уборки в соответствии с инструкциями, ведение журнала уборки и дезинфекции? Проводятся ли дезинфекции? Имеется ли список дезинфицирующих средств? Разработана ли инструкция по мероприятиям после проведения дезинфекции? Проводится ли уничтожение грызунов? |
|
|
|
|
Сведения о помещениях |
||||
|
17 |
Выполняется ли отбор проб (образцов) продукции и материалов в соответствии с установленными требованиями? Имеются ли обособленные помещения (зоны) с обеспечением требований чистоты? Имеется ли четкая маркировка помещений? Проводится ли в срок замена фильтров? Документируется ли замена фильтров? |
|
|
|
|
18 |
Используются ли помещения исключительно в соответствии с предусмотренными целями? Имеются ли выделенные зоны: - приема полупродуктов и упаковочных материалов с возможностью очистки внешней упаковки; - хранения полупродуктов; - хранения готовой продукции, находящейся в карантине; - хранения одобренной готовой продукции; - хранения упаковочных материалов, снабженных типографскими надписями, других бумажных материалов (изолированных от доступа посторонних лиц); - хранения отбракованной, возвращенной или отозванной продукции? Соответствуют ли условия хранения установленным требованиям? |
|
|
|
|
19 |
Соблюдаются ли меры по гигиене: - отсутствие запыленных поверхностей; - наличие идентификационных контейнеров для сбора отходов и мусора; - отсутствие насекомых; - наличие инструкций по санитарии и гигиене? |
|
|
|
|
20 |
Соответствует ли нормативным требованиям: - освещение; - отопление; - вентиляция; - снабжение электроэнергией, водой; - температура, влажность? Как проводится контроль воды, в том числе, микробиологический? |
|
|
|
|
21 |
Каким образом осуществляется идентификация и присвоение складского номера: - наличием четкой маркировки сырья, материалов и готовой продукции; - использованием этикетки статуса, обозначающей качество продукции и ее освобождение (цветные стикеры)? Где и кем осуществляется «одобрение» продукции? Проводят ли маркировку складских участков? |
|
|
|
|
Прочие сведения |
||||
|
22 |
Осуществлялась ли аттестация? Имеется ли документ? |
|
|
|
|
23 |
Проводились ли ведомственные контрольные проверки, внутренние проверки? Имеется ли протокол проверки в распоряжении руководителя склада? Проводились ли корректирующие мероприятия по протоколу? |
|
|
|
|
Руководитель группы внутреннего аудита: ОЗНАКОМЛЕН Члены комиссии: Руководитель контролируемого подразделения: |
||||
Библиография
|
[1] |
Quality assurance of pharmaceuticals. A compendium of guidelines and related materials. Vol. 2. Good manufacturing practices and inspection. WHO, Geneva, 1999 Обеспечение качества лекарственных средств. Сборник руководств и связанных с ними материалов. Том. 2. Правила производств и инспектирование. ВОЗ, Женева, 1999 |
|
[2] |
Food and Drug Administration. Currant Good Manufacturing Practice in Manufacturing, Processing, Packing or Holding of Drugs; General and Currant Good Manufacturing Practice For Finished Pharmaceuticals. 21 CFR - Part 210 - 211 Управление по продуктам питания и лекарственным средствам. Производство, упаковка и обращение лекарственных средств; Общие и текущие правила производства готовых лекарственных средств. Кодекс федеральных правил США 21, части 210 - 211 |
|
[3] |
Чистые помещения. Под ред. А.Е. Федотова. М.: АСИНКОМ, 2003 - 576 с: ил. |
|
[4] |
WHO Technical report series; 908. WHO, Geneva, 2003 Серия технических отчетов ВОЗ, 908. ВОЗ, Женева, 2003 |
|
[5] |
Ватолина М.В. Организация работы с документами. - Ростов н/Д: Феникс, 2004 - 320 с. |
|
Ключевые слова: производство лекарственных средств, обеспечение качества, материалы, персонал, помещения, оборудование, аттестация, аудит, контроль качества |