Информационная система |
| Карта сайта |
Скачать ГОСТ Р ИСО 25539-1-2012 Имплантаты сердечно-сосудистые. Внутрисосудистые имплантаты. Часть 1. Эндоваскулярные протезы
Дата актуализации: 10.08.2017

 ГОСТ Р ИСО 25539-1-2012
ГОСТ Р ИСО 25539-1-2012
Имплантаты сердечно-сосудистые. Внутрисосудистые имплантаты. Часть 1. Эндоваскулярные протезы
| Обозначение: |  ГОСТ Р ИСО 25539-1-2012 ГОСТ Р ИСО 25539-1-2012 |
| Обозначение англ: |  GOST R ISO 25539-1-2012 GOST R ISO 25539-1-2012 |
| Статус: | действует |
| Название рус.: | Имплантаты сердечно-сосудистые. Внутрисосудистые имплантаты. Часть 1. Эндоваскулярные протезы |
| Название англ.: | Cardiovascular implants. Endovascular devices. Part 1. Endovascular prostheses |
| Дата добавления в базу: | 01.10.2014 |
| Дата актуализации: | 05.05.2017 |
| Дата введения: | 01.01.2014 |
| Область применения: | Стандарт устанавливает требования к эндоваскулярным протезам на основе современных знаний в области медицины. В нем приведены требования к предполагаемым рабочим характеристикам, особенностям конструкции, материалам, оценке конструкции, производству, стерилизации, упаковке и информации, предоставляемой изготовителем, исходя из аспектов безопасности. Его следует рассматривать как дополнение к ИСО 14630, в котором определены основные требования к рабочим характеристикам неактивных хирургических имплантатов. Стандарт применим к эндоваскулярным протезам, используемым при лечении аневризм аорты, аортальных стенозов и других сосудистых аномалий. Стандарт применим к системам доставки, если таковые являются составной частью системы раскрытия и размещения эндоваскулярного протеза. Стандарт не применим к сосудистым окклюдерам, за исключением подвздошных окклюдеров, используемых как неотъемлемая часть аорто-подвздошных устройств. Стандарт не применим к тем процедурам и устройствам, которые применялись до внедрения внутрисосудистых устройств, таких, например, как устройства для баллонной ангиопластики. |
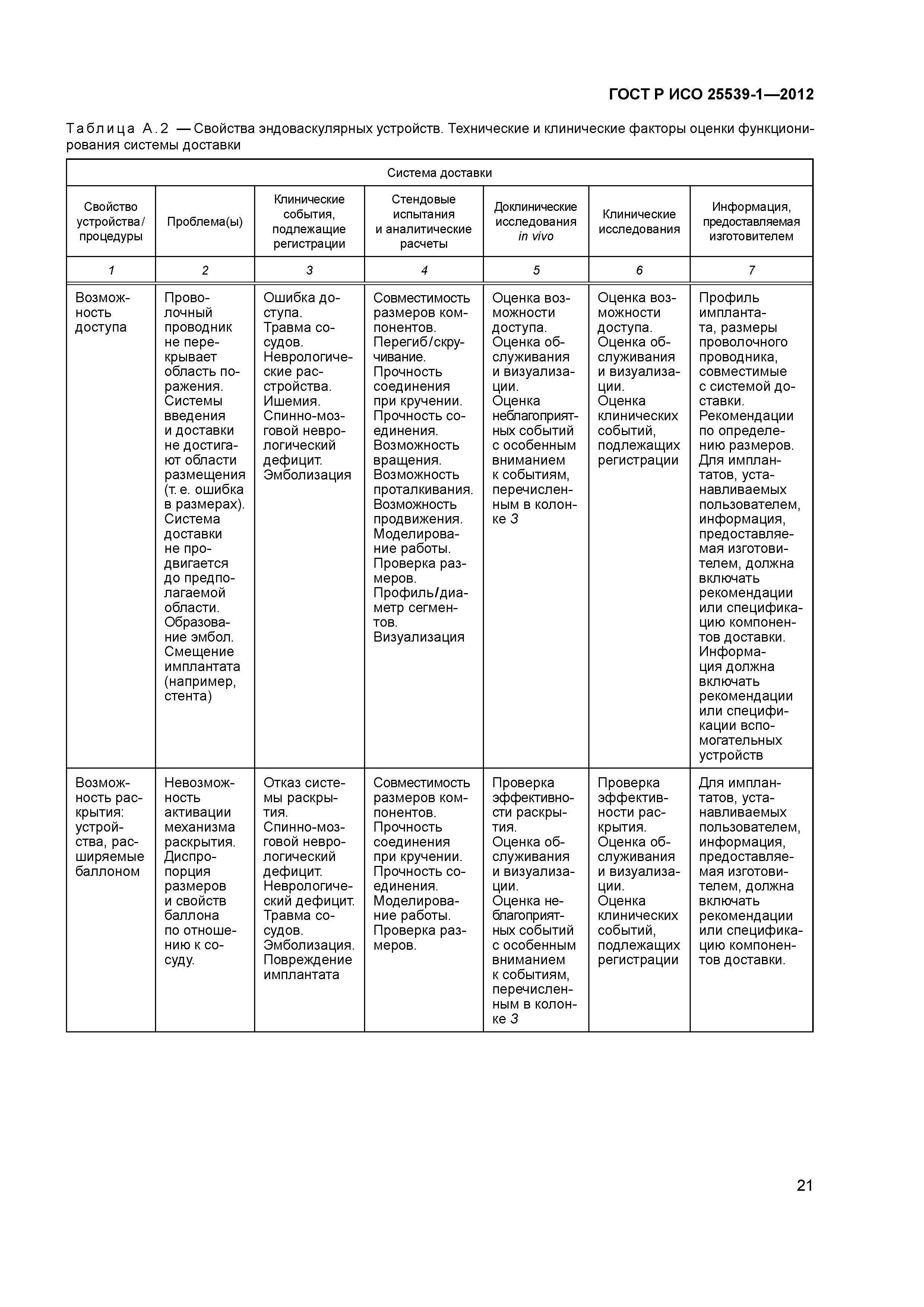
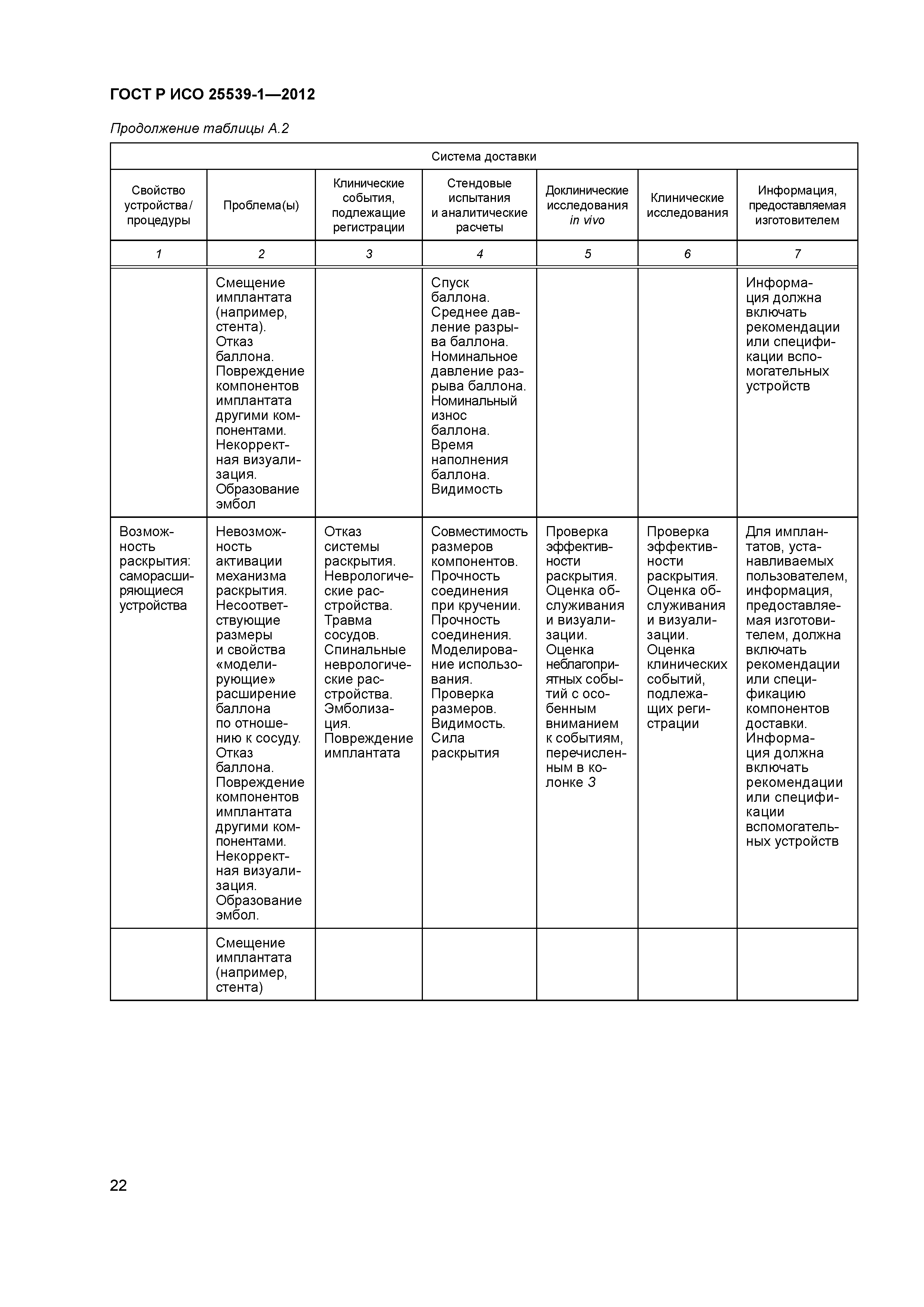
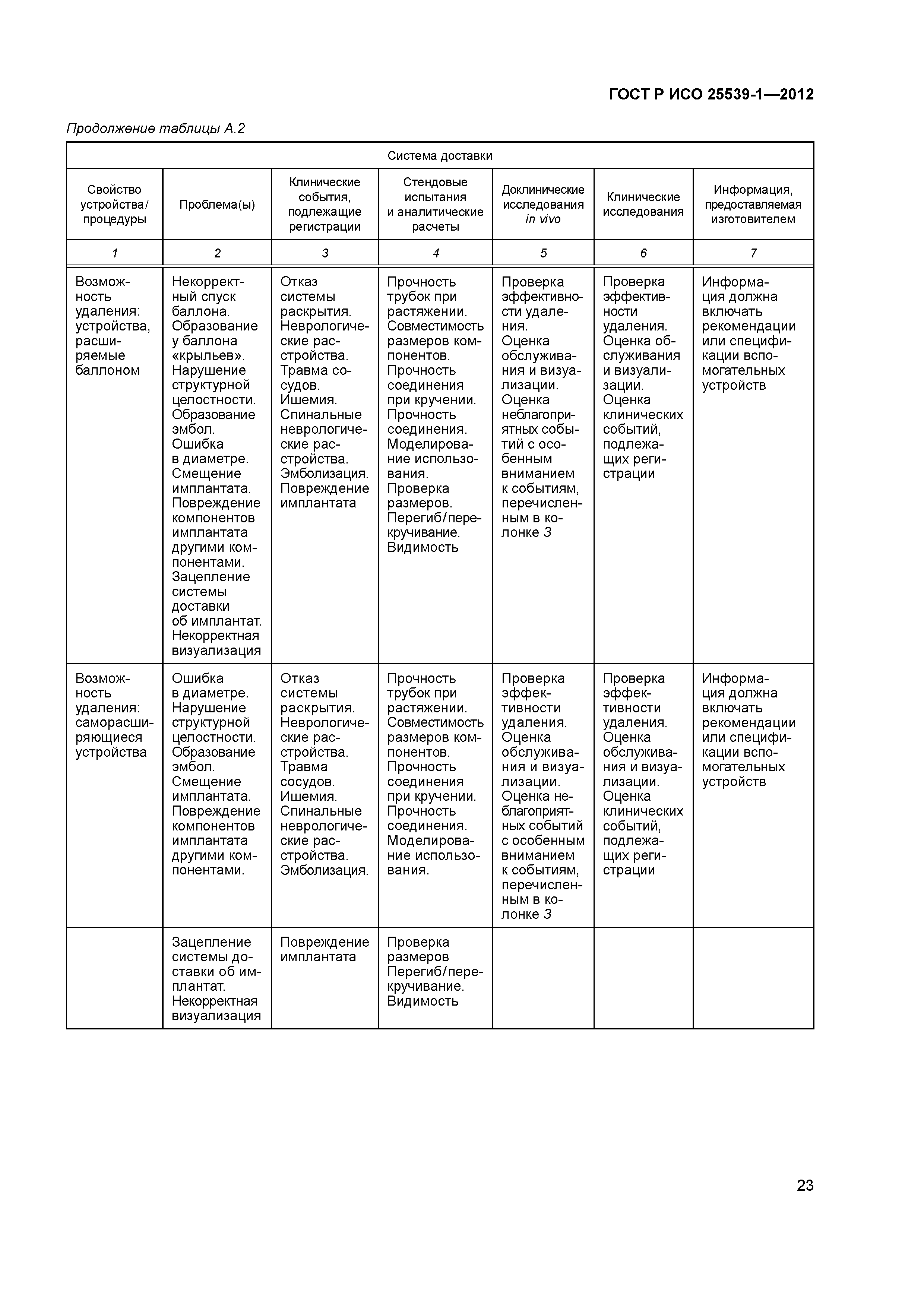
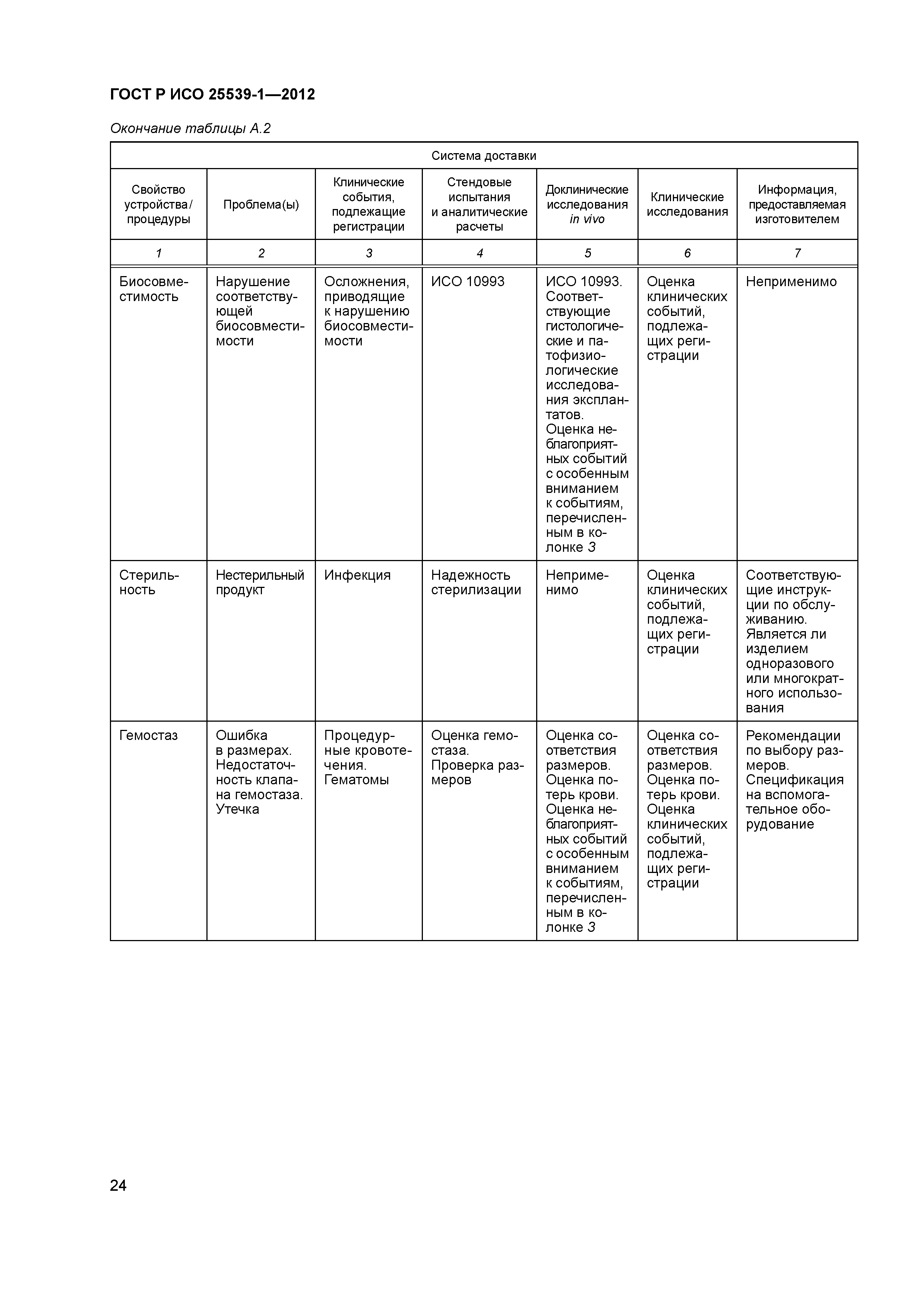
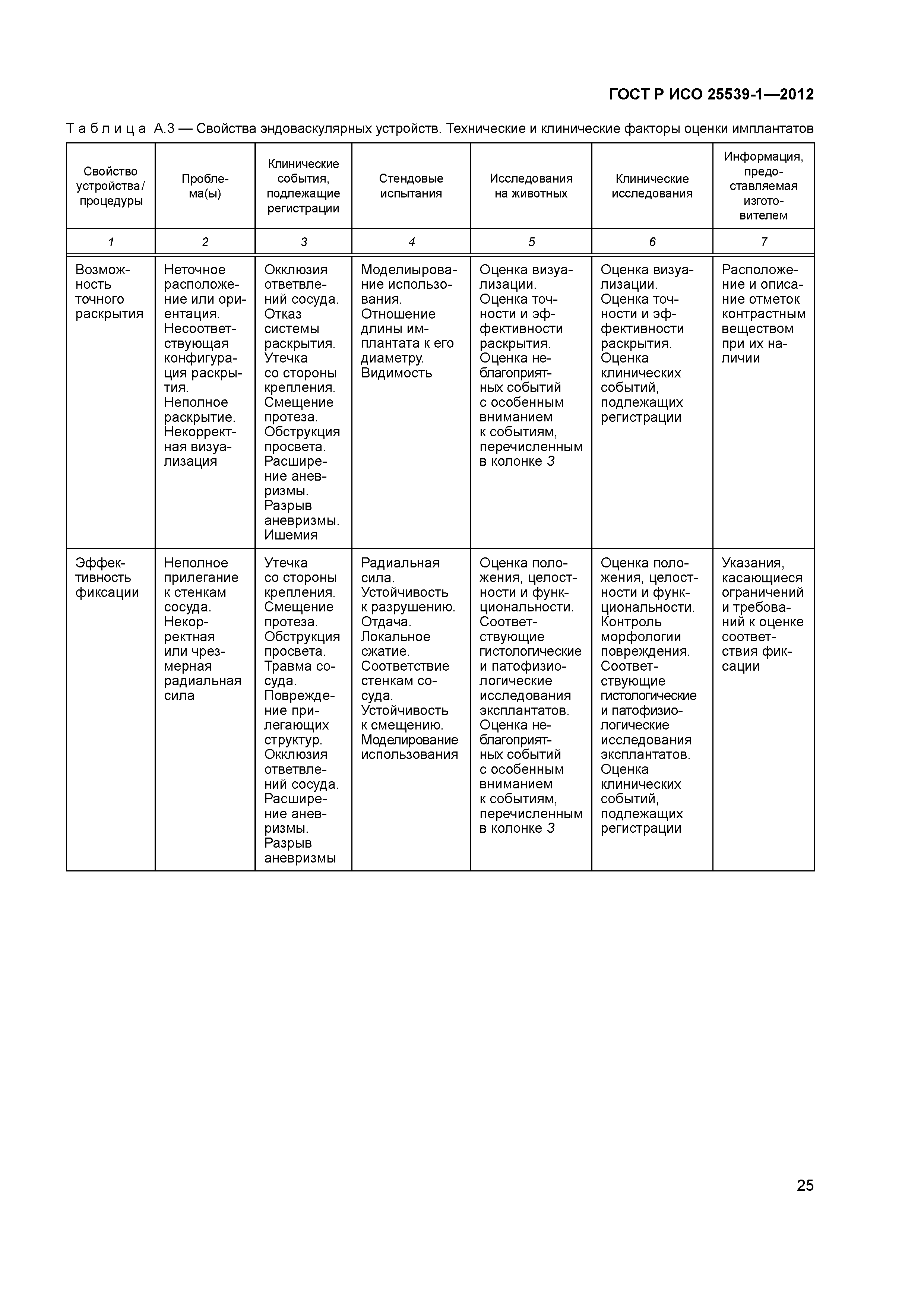
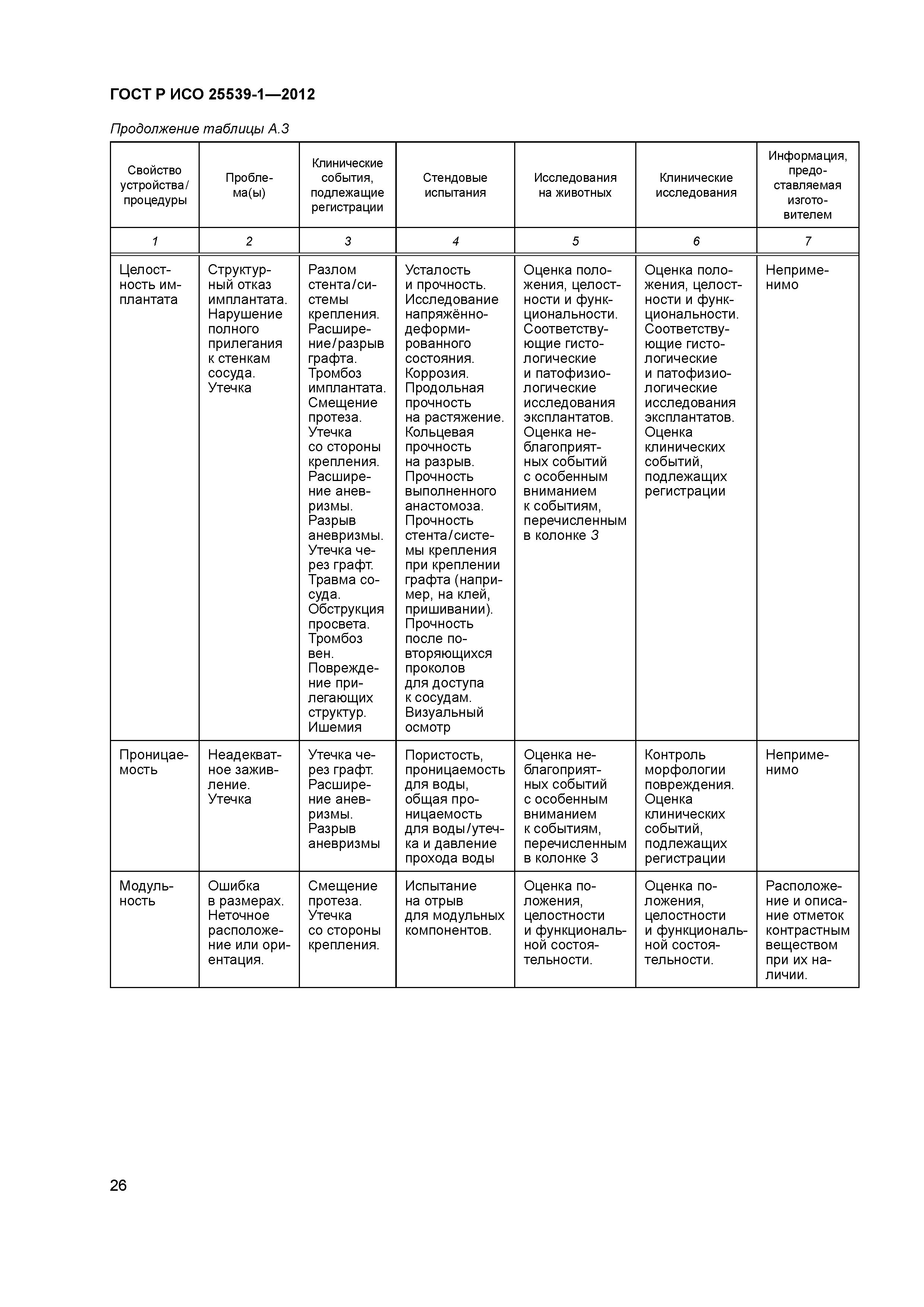
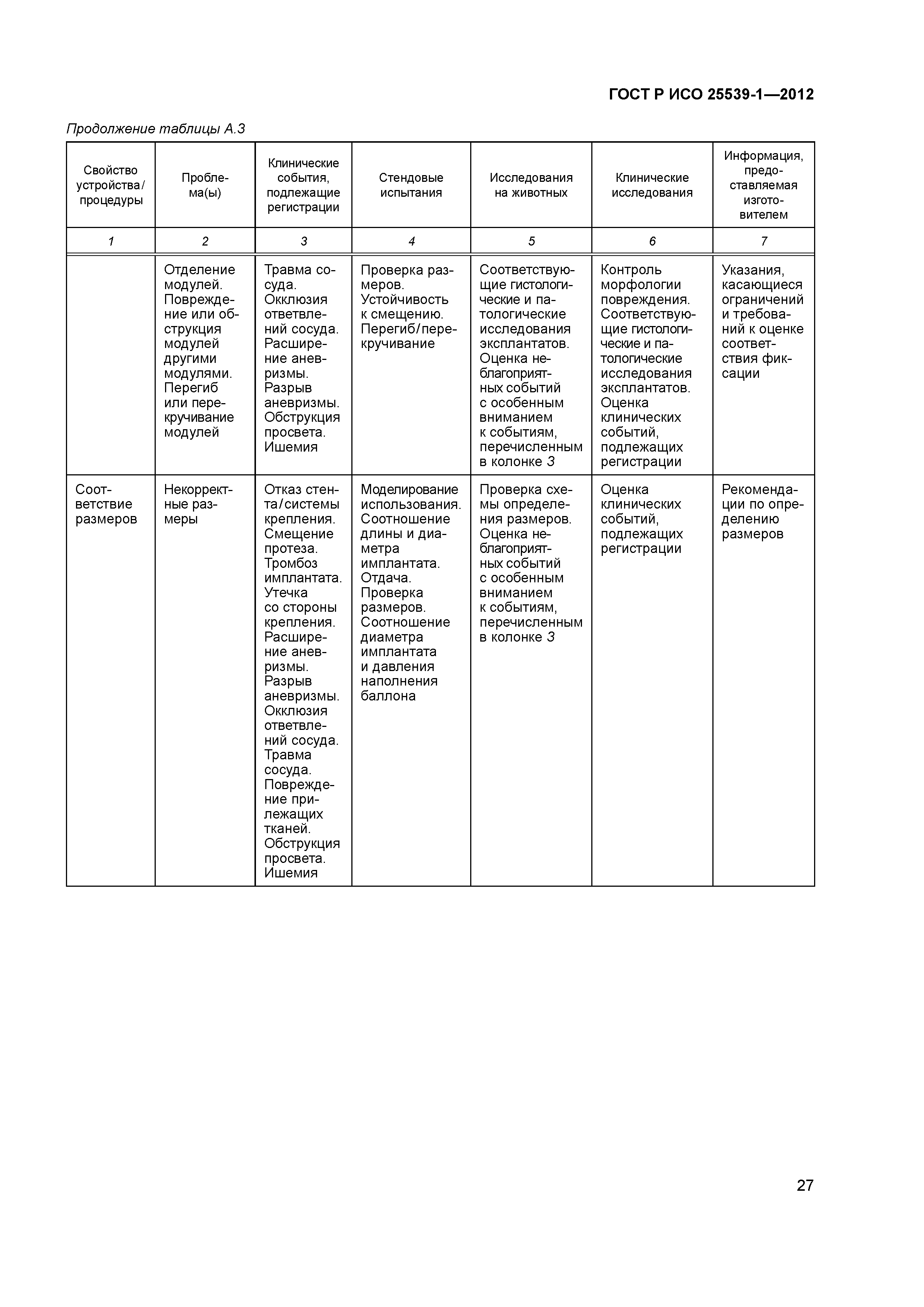
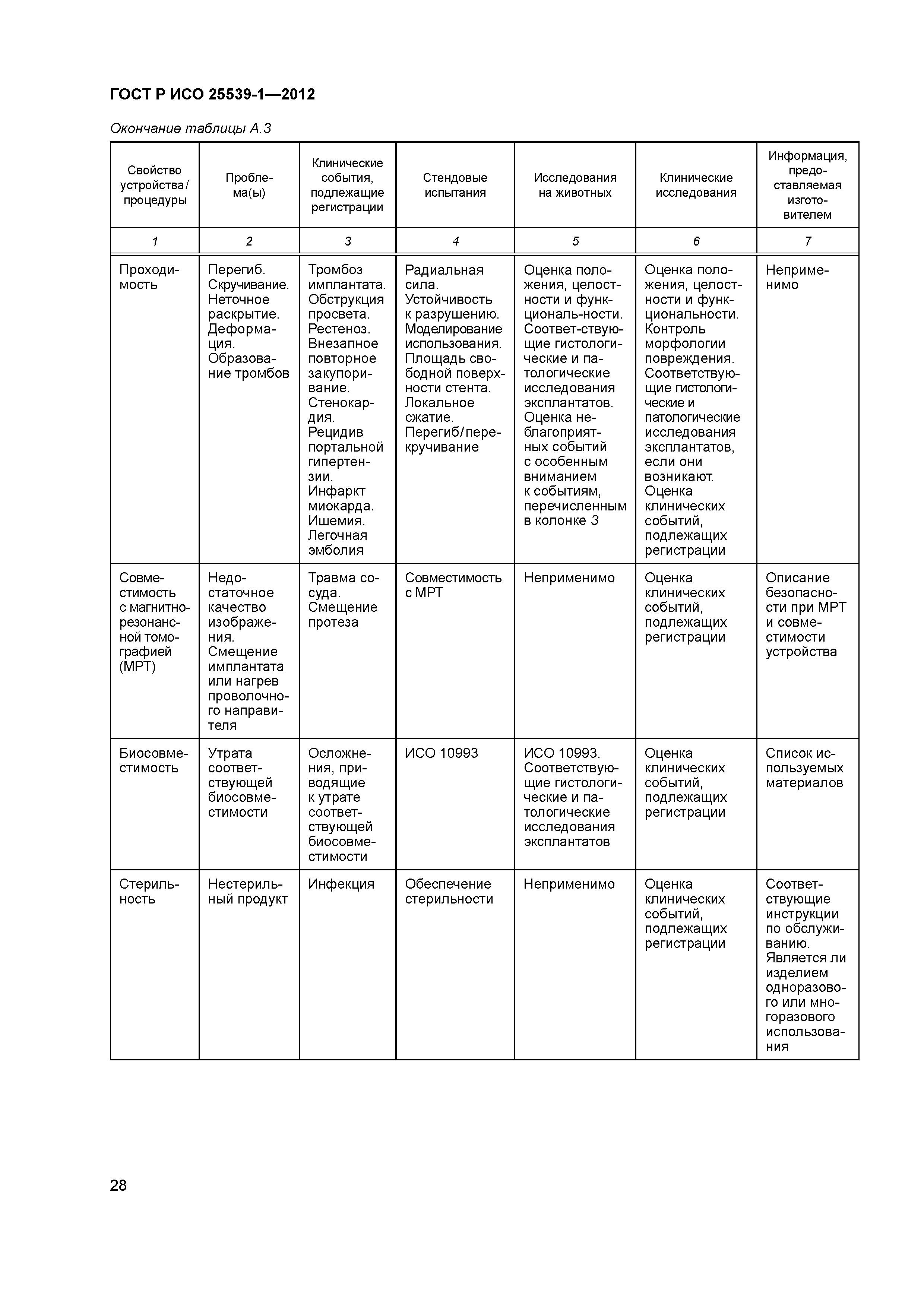
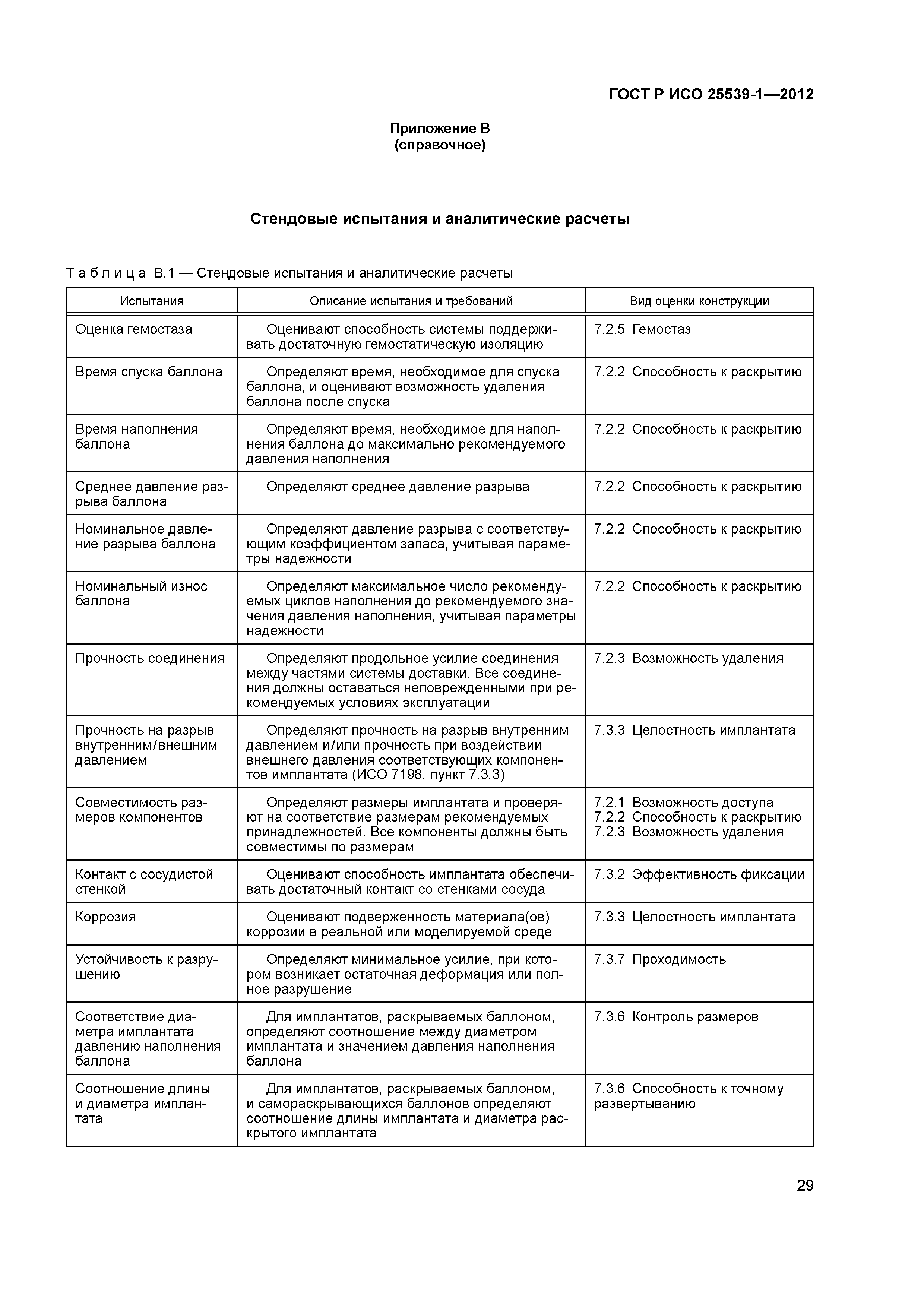
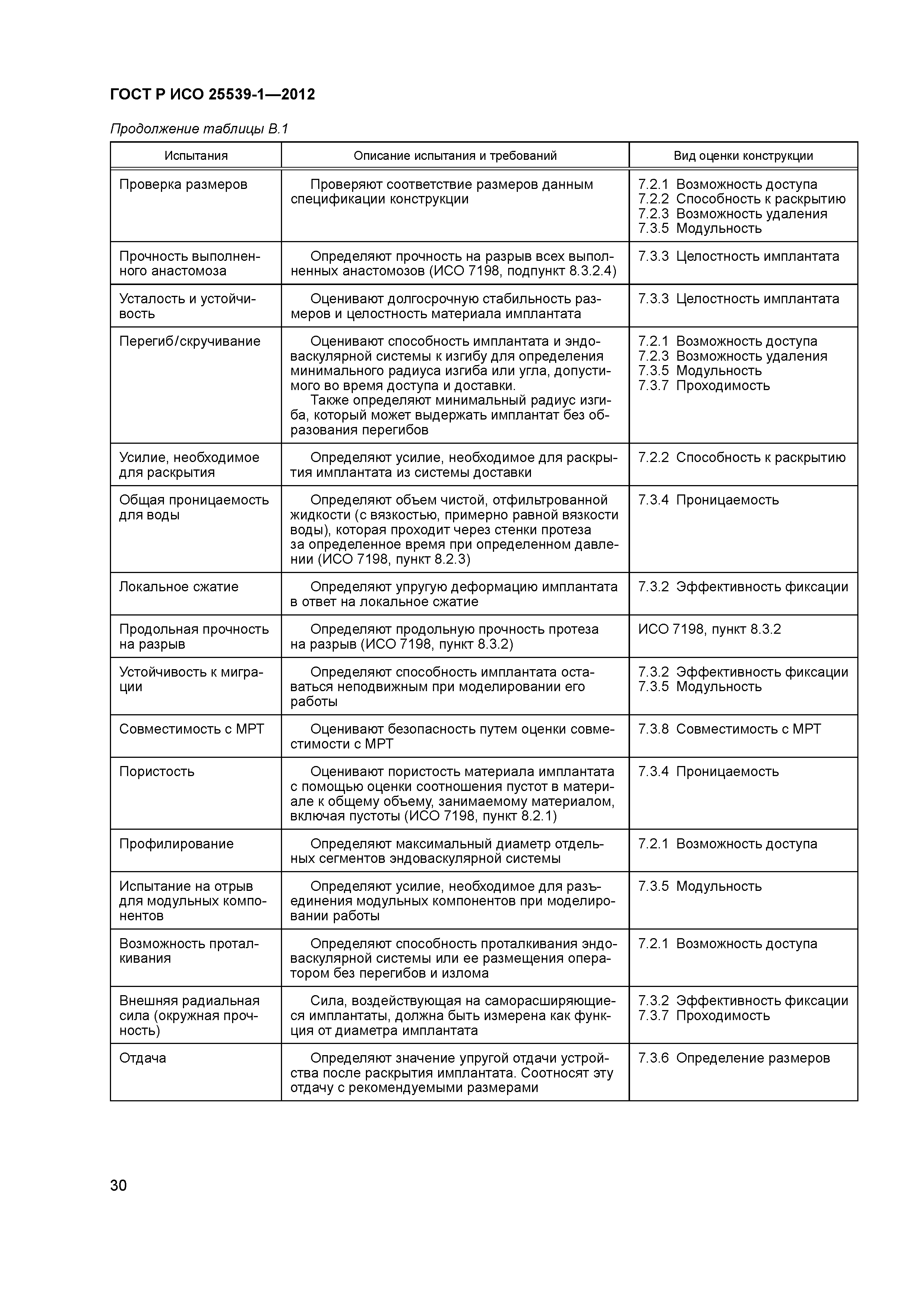
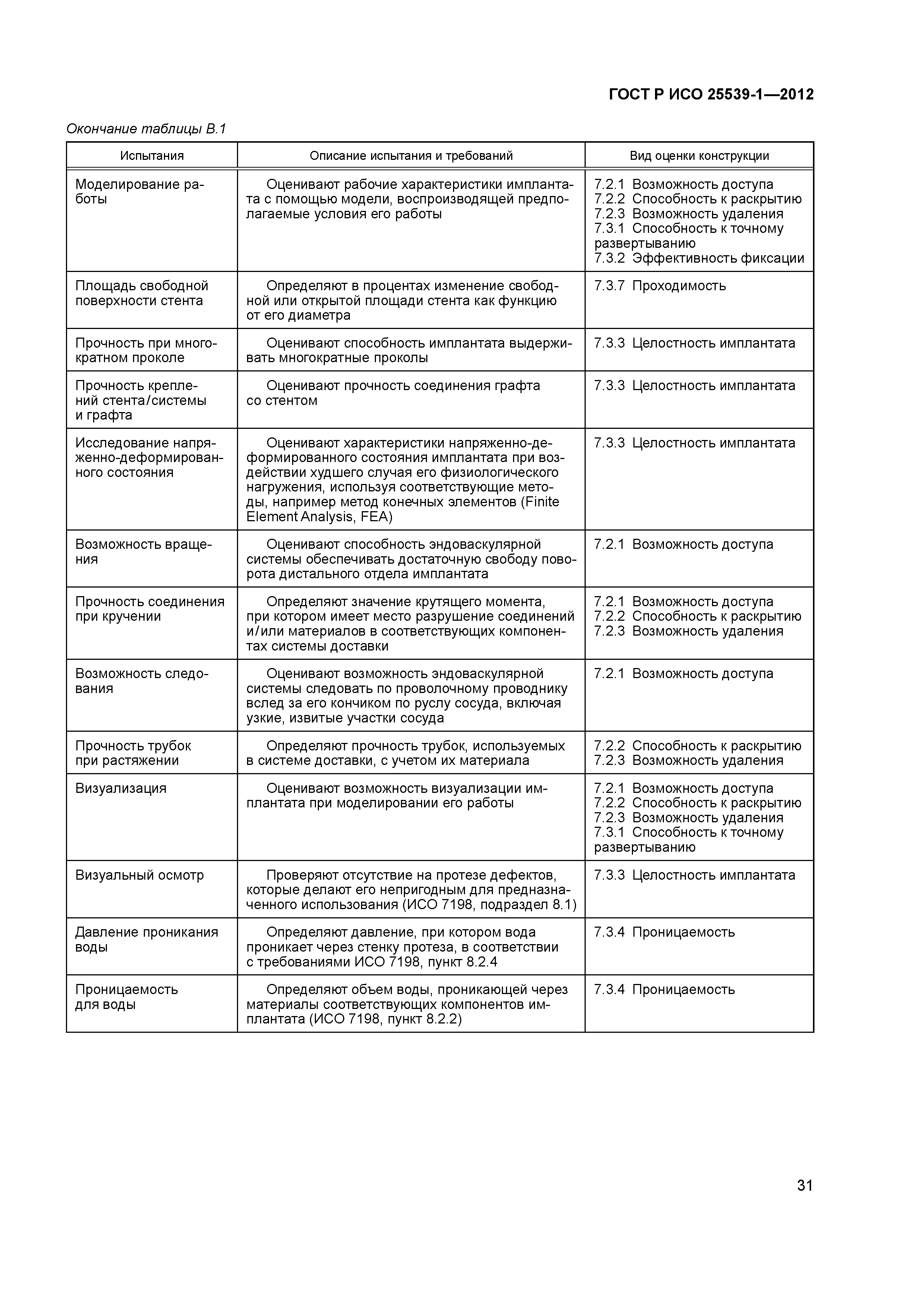
| Оглавление: | 1 Область применения 2 Нормативные ссылки 3 Термины и определения 4 Предполагаемые рабочие характеристики 5 Особенности конструкции 5.1 Общие положения 5.2 Система доставки 5.3 Имплантат 6 Материалы 7 Оценка конструктивной формы 7.1 Общие положения 7.2 Система доставки эндоваскулярного протеза 7.3 Имплантируемое изделие 7.4 Доклиническая in vivo оценка 7.5 Клиническая оценка 8 Изготовление 9 Стерилизация 9.1 Изделия, поставляемые в стерильном виде 9.2 Изделия, поставляемые в нестерильном виде 9.3 Остаточные продукты стерилизации 10 Упаковка 10.1 Защита от повреждений при хранении и транспортировании 10.2 Маркировка 10.3 Информация, предоставляемая изготовителем Приложение А (справочное) Свойства эндоваскулярных устройств. Технические и клинические вопросы Приложение В (справочное) Стендовые испытания и аналитические расчеты Приложение С (справочное) Определения видов осложнений и отказов, подлежащих регистрации Приложение D (справочное) Методы испытания Приложение Е (справочное) дополнение к D.5.3.19. Оценка усталостной и длительной прочности (в условиях пульсирующего потока): аналитический подход Приложение ДА (справочное) Сведения о соответствии ссылочных международных стандартов национальным стандартам Российской Федерации Библиография |
| Разработан: | ФГБУ НЦССХ им. А.Н. Бакулева РАМН |
| Утверждён: | 01.01.2014 Федеральное агентство по техническому регулированию и метрологии (266-ст) |
| Издан: | Стандартинформ (2014 г. ) |
| Расположен в: | |
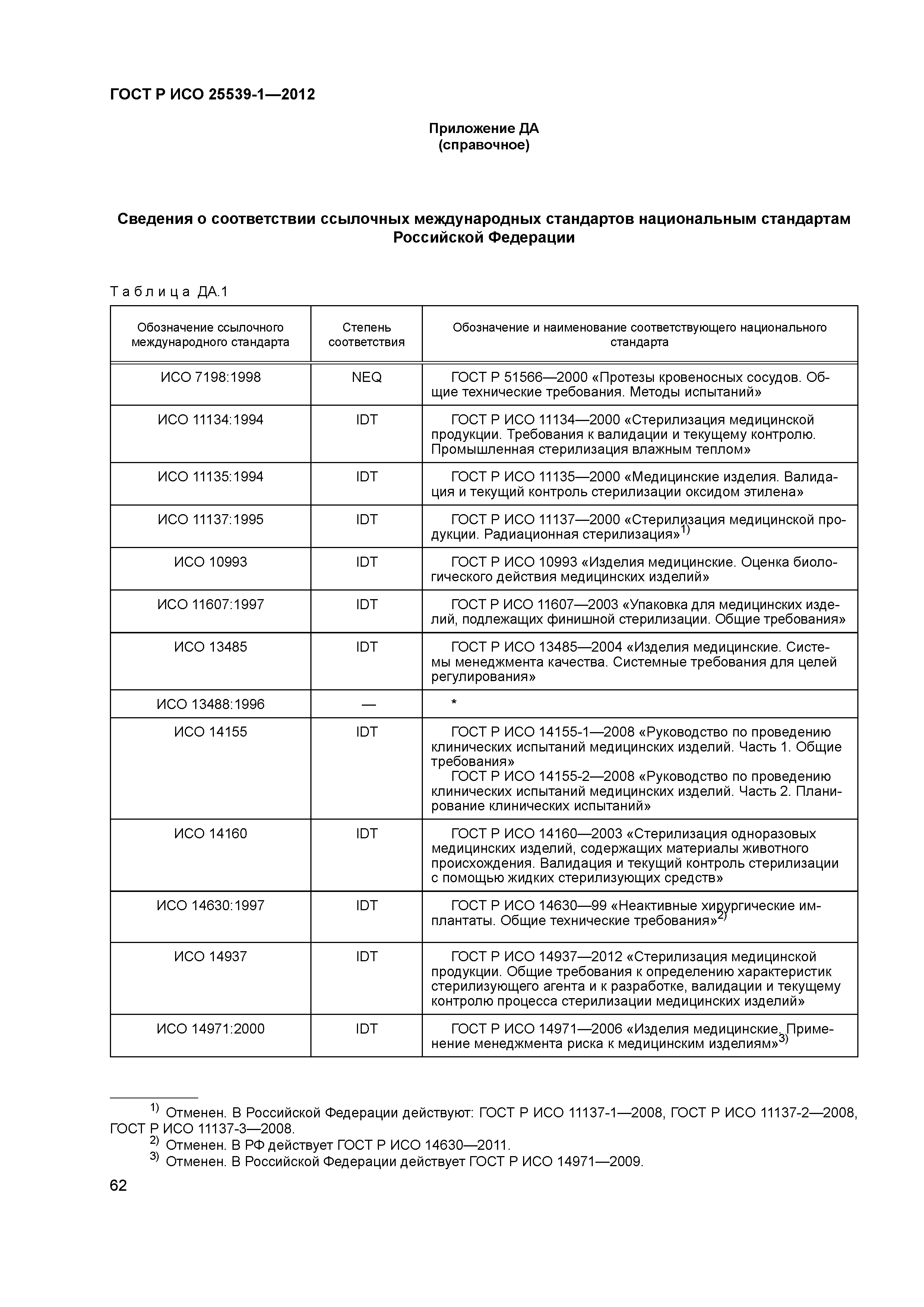
| Нормативные ссылки: |
|


























































© 2013 Ёшкин Кот :-) Карта сайта
 ГОСТ Р 51566-2000 «Протезы кровеносных сосудов. Общие технические требования. Методы испытаний»
ГОСТ Р 51566-2000 «Протезы кровеносных сосудов. Общие технические требования. Методы испытаний»